Аналитическая химия – это наука, разрабатывающая теоретические основы и методы химического анализа. Наиболее существенными теоретическими вопросами являются учение о химическом равновесии и теория растворов. Реакции аналитической химии в своем большинстве обратимы и для того чтобы при обратимой реакции достичь возможно более полного превращения одного из взятых веществ, необходимо действовать избытком того реагента, который вызывает это превращение.
Реакции, применяемые в аналитической химии, протекают чаще в водных растворах, поэтому в аналитической химии очень важно: а) знать, в какой мере различные электролиты распадаются в растворе на ионы;
б) определять, как изменяются концентрации тех или иных ионов в растворе при введении в него электролита с одноименным ионом; в) уметь рассчитывать концентрации катионов H+, гидроксид - ионов OH-, определять pH растворов.
Выполняя такие важные аналитические операции, как осаждение или отделение ионов, промывание и растворение осадков, имеют дело с гетерогенными системами. В гетерогенных системах может наступить равновесие «насыщенный раствор - осадок», но оно может быть смещено как в сторону образования осадка, так и в сторону его растворения. Условием образования осадка является превышение произведения концентраций ионов труднорастворимого электролита (ионного произведения – ИП) над его произведением растворимости (ИП>ПР). Условием растворения осадка является понижение ИП по отношению к значению ПР (ИП< ПР).
Исходя из значений ПР, можно рассчитать растворимость труднорастворимых веществ в воде и в растворах, содержащих другие электролиты. Растворимостью данного вещества называется концентрация вещества в определенном объеме его насыщенного раствора. Различают молярную растворимость в моль/л (S) и растворимость в г/л (P), которые связаны между собой следующей зависимостью: P = S × M, где M-молярная масса труднорастворимого вещества.
Пример 1. Произведение растворимости оксалата бария ВаС2О4 при 20°С равно 1,62×10-7. Вычислите растворимость соли (в моль/л и г/л) при указанной температуре.
Решение. В насыщенном растворе труднорастворимого электролита ВаС2О4 существует равновесие:
ВаС2О4 Û Ва2+ + С2О42 -
в осадке в растворе
При растворении каждого моля ВаС2О4 в раствор переходят 1 моль ионов Ва2+ и 1 моль ионов С2О42 - . Обозначим растворимость соли
S моль/л, тогда в насыщенном растворе ВаС2О4 концентрации ионов будут равны: [Ва2+ ] = S моль/л, [С2О42 - ] = S моль/л.
Отсюда,  = S×S = S2.
= S×S = S2.
Выразим растворимость: S = 
Подставив числовое значение  = 1,62×10-7, находим молярную растворимость соли в моль/л: S =
= 1,62×10-7, находим молярную растворимость соли в моль/л: S =  = 0,4 ×10-3 моль/л.
= 0,4 ×10-3 моль/л.
М  = 225,33 г/моль, следовательно, растворимость соли в г/л равна: P = S × M = 0,4 ×10-3 × 225,33 = 0,0913 г/л.
= 225,33 г/моль, следовательно, растворимость соли в г/л равна: P = S × M = 0,4 ×10-3 × 225,33 = 0,0913 г/л.
Пример 2. Растворимость фосфата серебра в воде при t=250C равна 6,15×10-3 г/л. Вычислите произведение растворимости данной соли.
Решение. Молярная растворимость фосфата серебра (S моль/л) равна S =  , где P - растворимость в г/л, М – молярная масса (г/моль). МAg3PO4 = 418,58 г/моль, следовательно,
, где P - растворимость в г/л, М – молярная масса (г/моль). МAg3PO4 = 418,58 г/моль, следовательно,
S=  моль/л.
моль/л.
В насыщенном растворе фосфата серебра существует равновесие:
Ag3PO4 Û 3Ag+ + PO43-
в осадке в растворе
При растворении каждого моля Ag3PO4 в раствор переходят 3 моль ионов Ag+ и 1 моль ионов РО43-. Так как молярная растворимость фосфата серебра S = 1,6×10-5 моль/л, то концентрации ионов в насыщенном растворе соответственно равны:
[Ag+]  моль/л,[PO43-]
моль/л,[PO43-]  .
.
Запишем выражение для произведения растворимости фосфата серебра и вычислим его значение:

Пример 3. Произведение растворимости сульфида магния при t = 250С равно 2,0×10-15. Образуется ли осадок MgS при смешении равных объемов 0,002М раствора нитрата магния и 0,0003М раствора сульфида натрия.
Решение. При смешении растворов нитрата магния и сульфида натрия протекает следующая реакция: Mg(NO3)2 + Na2S = MgS + 2NaNO3
Для образования осадка MgS необходимо, чтобы ИП > ПРMgS.
При смешении равных объемов растворов объем смеси стал в два раза больше объема каждого из взятых растворов, следовательно, концентрации растворенных веществ уменьшаются вдвое, т.е.

Нитрат магния и сульфид натрия как сильные электролиты, в водных растворах диссоциируют практически полностью:
Mg(NO3)2 ® Mg2++ 2NO3 -
Na2S ® 2Na+ + S 2-
Из уравнений диссоциации следует, что из одного моля нитрата магния и одного моля сульфида натрия образуется по одному молю соответственно ионов Mg2+ и S 2 -.
Поэтому концентрация ионов Mg2+ и S 2– равна концентрации соответствующей соли в общем растворе:
C Mg2+ = C Mg(NO3)2 = 0,001 моль/л; СS 2 - = СNa2S = 0,00015 моль/л.
Рассчитаем произведение концентраций ионов (ИП) и сравним его со значением произведения растворимости для сульфида магния:
 .
.
Так как 1,5×10-7 > 2,0×10-15, значит ИП >ПРMgS, и осадок MgS образуется.
Пример 4. Вычислите рН 0,0042М раствора гидроксида калия.
Решение. Гидроксид калия – электролит сильный, практически полностью диссоциирует на ионы КОН ® К+ + ОН -, поэтому концентрация гидроксид ионов в растворе равна концентрации гидроксида калия:

Зная, что ионное произведение воды KH2O =  = 10-14, можно найти концентрацию катионов водорода:
= 10-14, можно найти концентрацию катионов водорода:

Отсюда  .
.
Пример 5. Вычислите рН 0,2 М раствора уксусной кислоты.
Решение.  Уксусная кислота – электролит слабый, следовательно, расчет рН делаем, исходя из константы диссоциации этой кислоты Уравнение диссоциации кислоты:
Уксусная кислота – электролит слабый, следовательно, расчет рН делаем, исходя из константы диссоциации этой кислоты Уравнение диссоциации кислоты:
СН3СООН Û Н+ + СН3СОО -
Запишем выражение константы диссоциации:

 ;
;
По уравнению диссоциации делаем вывод, что на каждый образующийся H+- ион приходится один CH3COO - -ион, значит [H+]=[CH3COO - ]. Концентрацию недиссоциированных молекул слабой кислоты можно принять равной концентрации раствора кислоты. Следовательно, 

Отсюда:
 =
= 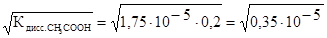 = 1,9×10-3 моль/л.
= 1,9×10-3 моль/л.

Пример 6. Во сколько раз изменится растворимость карбоната кальция СаСО3 в 0,1М растворе карбоната калия К2СО3 по сравнению с растворимостью его в воде? Произведение растворимости  .
.
Решение. Рассчитаем растворимость СаСО3 в воде – S (моль/л):
СаСО3 Û Са2+ + СО32 -
в осадке в растворе
 .
.
Обозначим растворимость СаСО3 равной S моль/л, тогда согласно уравнению диссоциации карбоната кальция в насыщенном растворе концентрация каждого из его ионов равна S моль/л.
 Следовательно, растворимость СаСО3 в воде будет равна:
Следовательно, растворимость СаСО3 в воде будет равна:
S =  моль/л.
моль/л.
Найдем растворимость СаСО3 в 0,1М растворе К2СО3. При введении сильного электролита, диссоциирующего по уравнению:
К2СО3 ® 2К+ + СО32 - , концентрация карбонат - ионов СО32 - повышается на 0,1 моль и становится равной (S + 0,1) моль/л, а концентрация катионов кальция остаётся равной S моль/л, тогда:
 .
.
Так как значение S2 много меньше произведения 0,1× S, то величиной S2 можно пренебречь и тогда:
 .
.
Отсюда, растворимость СаСО3 в 0,1М растворе К2СО3 будет равна:
 моль/л, и следовательно, уменьшится в
моль/л, и следовательно, уменьшится в  раз.
раз.
Буферные растворы (смесь слабой кислоты с ее солью или смесь слабого основания с его солью) широко распространены в природе и очень часто используются в химической практике, в том числе и при химическом анализе. В отличие от растворов кислот и оснований буферные растворы обладают важными свойствами:
1. рН буферных растворов практически не зависит от разбавления. Это обусловлено тем, что буферные растворы - это растворы слабых кислот или оснований с подавленной степенью диссоциации. Подавление степени диссоциации - результат присутствия в этих растворах сильного электролита, имеющего одноименный со слабым электролитом ион. Например, в аммонийном буферном растворе находятся слабое основание NH4OH и сильный электролит NH4Cl. Катион обоих электролитов одинаков.
2. рН буферных растворов практически не изменяется при добавлении к ним небольших количеств сильных кислот или щелочей. Это обусловлено тем, что буферные растворы являются одновременно и кислотой, и основанием. Например, в ацетатном буферном растворе CH3COOH выполняет функцию кислоты и в случае уменьшения концентрации ионов водорода в растворе поставляет их за счет диссоциации, а CH3COONa выполняет функцию основания и является акцептором ионов водорода при увеличении их концентрации в растворе.
3. Величина рН буферного раствора рассчитывается по формулам:
 и
и 
Пример 7. Определите рН аммонийного буферного раствора, если известен состав данного буфера: 0,1М NH4OH и 0,1М NH4Cl. Как изменится рН: а) если к 1 л буферного раствора добавить 0,01 моль гидроксида натрия; б) если разбавить буферный раствор в 10 раз?
Решение: Так как в состав буферного раствора входит основание, то вначале определим рОН буферного раствора по формуле:
 (1),
(1),
где  . Из таблицы III Приложения находим, что
. Из таблицы III Приложения находим, что  следовательно,
следовательно,

Подставляем все числовые значения в формулу (1) и находим

Зная, что рОН + рН = 14, находим значение рН буферного раствора:
pH = 14 - 4,75= 9,25
а) к 1 л буферного раствора добавили 0,01 моль NaOH, при этом гидроксид натрия будет реагировать с солью:
NaOH + NH4Cl = NH4OH + NaCl и изменятся концентрации и основания, и соли в буферном растворе.
По уравнению реакции:
из 1 моль NaOH образуется 1 моль NH4OH, следовательно, из 0,01 моль NaОН образуется 0,01 моль NH4OH. Концентрация NH4OH увеличится на 0,01 моль и станет равной: 
Концентрация NH4Cl уменьшится на 0,01 моль и станет равной:
 :
:
таким образом,  , рН= 14-4,66 = 9,33. Следовательно, рН буферного раствора увеличивается с 9,25 до 9,33, т.е. меняется незначительно.
, рН= 14-4,66 = 9,33. Следовательно, рН буферного раствора увеличивается с 9,25 до 9,33, т.е. меняется незначительно.
б) при разбавлении данного буферного раствора в 10 раз концентрации NH4OH и NH4Cl тоже уменьшаются в 10 раз, следовательно

рН = 14-4,75=9,25 – рН буферного раствора не изменяется.
ЗАДАНИЯ
491. Что такое водородный показатель (рН)? Числовые значения рН в кислом, щелочном и нейтральном растворах. Вычислите рН 0,1н. раствора хлороводородной кислоты.
492. Что называется произведением растворимости? Вычислите  , зная, что растворимость этой соли при данной температуре равна 0,013 г/л.
, зная, что растворимость этой соли при данной температуре равна 0,013 г/л.
493. Как влияет введение сильного электролита, содержащего одноименный ион, на растворимость малорастворимого электролита? Во сколько раз изменится растворимость сульфата бария в присутствии 0,1М раствора сульфата калия, если 
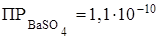 ?
?
494. Какие растворы называются буферными? Приведите примеры буферных растворов. Почему рН буферных растворов практически не изменяется при добавлении к ним небольших количеств сильных кислот или щелочей?
Определите рН аммонийного буферного раствора, если известен состав этого буфера: 0,1М NH4OH; 0,1М NH4Cl. Как изменится рН, если к 1 л буферного раствора добавить 0,001 моль хлороводородной кислоты и если разбавить буферный раствор в 5 раз?
495. Сформулируйте условия образования осадков. Получится ли осадок сульфата кальция при смешении равных объемов 0,01 М растворов CaCl2 и Na2SO4, если ПР  ?
?
496. Сформулируйте условия растворения осадков. Выпадет ли осадок сульфата стронция при смешении равных объемов 0,005 М растворов SrCl2 и K2SO4, если  ?
?
497. Сформулируйте условия образования осадков. Образуется ли осадок оксалата кальция (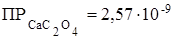 ) при смешении равных объемов 0,01М растворов CaCl2 и Na2C2O4?
) при смешении равных объемов 0,01М растворов CaCl2 и Na2C2O4?
498. Сформулируйте правило растворения осадков. Образуется ли осадок сульфата бария при смешении равных объемов 0,0005М растворов BaCl2 и K2SO4, если  ?
?
499. Сформулируйте понятие произведения растворимости. Вычислите произведение растворимости карбоната магния при комнатной температуре, если растворимость его в этих условиях равна 0,01 г в 100 мл раствора.
500. Как влияет добавление сильного электролита, содержащего одноименный ион на растворимость осадка? Произведение растворимости сульфата серебра Ag2SO4 равно 7×10-5. Рассчитайте растворимость соли и выразите ее в молях на литр и в граммах на литр.
501. Напишите выражения произведения растворимости для BaSO4, Ca3(PO4)2, Ag2CrO4. Вычислите произведение растворимости CaSO4, если 1л насыщенного раствора его содержит 1,5×10-2 моль соли.
502. Напишите выражение для константы диссоциации воды. Что показывает ионное произведение воды? Каково его численное значение? Определите характер среды растворов, если: а) [H+] = 10-9 моль/л; б) рН = 4; в) [OH-] = 10-6моль/л; г) рОН = 12
503. Какие растворы называются буферными? Приведите примеры буферных растворов. Почему рН буферных растворов не зависит от разбавления? Определите рН ацетатного буферного раствора, если известен состав этого буфера: 1М CH3COOH; 0,1M CH3COONa. Как изменится рН, если к 1 л буферного раствора добавить 0,01 моль хлороводородной кислоты и если разбавить буферный раствор в 20 раз?
504. Сформулируйте правило произведения растворимости. Вычислите произведение растворимости BaCrO4, если в 1 л насыщенного раствора его содержится 3,9×10-3 г хромата бария.
505. Как измеряют рН раствора в ходе анализа? Приведите примеры индикаторов. Вычислите рН 0,05 М раствора хлороводородной кислоты.
506. Напишите выражение произведения растворимости для сульфита кальция. Рассчитайте растворимость CaSO3 в воде и в 0,2 М растворе Na2SO3, если  .
.
507. Как влияет введение сильного электролита, содержащего одноименный ион, на растворимость малорастворимого электролита? Во сколько раз изменится растворимость оксалата кальция CaC2O4 в присутствии 0,01 моль Na2С2O4 в 1 л раствора, если  .
.
508. Сформулируйте условия образования и растворения осадков. Вычислите произведение растворимости Mg(OH)2, если в 1 л насыщенного раствора его содержится 6,4×10-3 г гидроксида магния.
509. Как изменится концентрация ионов водорода в растворе уксусной кислоты CH3COOH при добавлении ацетата натрия NaCH3COO? Вычислите концентрацию катионов водорода [H+] и рН 0,1М раствора уксусной кислоты, если K  .
.
510. Как изменится концентрация ионов ОН - в растворе гидроксида аммония при добавлении хлорида аммония? Вычислите концентрацию гидроксид-ионов [OH - ] и рОН 0,2М раствора гидроксида аммония, если K  =1,75×10-5.
=1,75×10-5.
Качественный анализ
Задача этого раздела аналитической химии – определение качественного состава анализируемой пробы (вещества или смеси веществ). Качественный анализ позволяет установить, из каких химических элементов состоит анализируемое вещество и какие ионы, группы атомов или молекул входят в его состав.
Качественный анализ используют в сельскохозяйственном производстве и при решении проблем защиты окружающей среды. Качественный анализ почвы помогает уяснить сущность почвообразовательных процессов, выявить содержание в почве ценных питательных элементов или установить наличие соединений, вредных для культурных растений.
ЗАДАНИЯ
511. Что называется групповым реагентом? Назовите групповые реагенты для катионов всех аналитических групп. Напишите уравнения реакций катионов II аналитической группы с групповым реагентом.
512. Какие условия осаждения III аналитической группы катионов? Напишите уравнения реакций катионов III аналитической группы с групповым реагентом.
513. Групповым реагентом второй аналитической группы является (NH4)2CO3. Почему нельзя заменить его реактивом Na2CO3 или K2CO3? Почему осаждение катионов II группы ведут при нагревании и при добавлении NH4Cl и NH4OH?
514. Какие катионы первой аналитической группы мешают открытию иона натрия? Ответ подтвердите уравнениями реакций.
515. Почему катион NH4+ мешает открытию Na+ и К+ -ионов? Ответ подтвердите уравнениями реакций.
516. Можно ли осадить катионы III аналитической группы действием группового реагента в кислой среде? Каковы должны быть условия осаждения? Ответ подтвердите уравнениями реакций.
517. Почему при действии группового реагента на катионы Fe3+ и Mn2+ получаются сульфиды, а на катионы Al3+ и Cr3+ получаются гидроксиды? Ответ подтвердите уравнениями реакций.
518. В виде каких соединений выпадают в осадок катионы третьей аналитической группы при действии группового реагента? Составьте уравнения соответствующих реакций.
519. Какие реакции произойдут при действии: а) избытка NaOH;
б) избытка NH4OH на раствор, содержащий ионы Fe3+, Mn2+, Zn2+. Составьте молекулярные и ионно-молекулярные уравнения реакций.
520. Укажите какие катионы будут находиться в растворе, какие в осадке и в виде каких соединений, если на раствор смеси катионов K+, NH4+, Ba2+, Fe3+, Al3+, Mn2+ подействовать избытком раствора NaOH? Составьте уравнения соответствующих реакций.
521. Какие катионы относятся к третьей аналитической группе и в чем заключается основное отличие катионов этой группы от катионов первой и второй групп? Напишите уравнения реакций катионов Zn2+, Fe3+, Al3+ с групповым реагентом.
522. Почему осаждение катионов третьей аналитической группы сульфидом аммония необходимо проводить в присутствии NH4OH и NH4Cl и при нагревании? Напишите уравнение реакции взаимодействия ионов алюминия с сульфидом аммония.
523. Какая реакция называется специфической? Приведите примеры. Гидроксиды каких катионов третьей группы проявляют амфотерные свойства? Подтвердите уравнениями реакций.
524. Что называется дробным и систематическим анализом? В каких случаях применяются эти анализы? В каком анализе применяют не только реакции обнаружения ионов, но также и реакции отделения их друг от друга? Приведите примеры.
525. В чем сущность «сухого» и «мокрого» способов выполнения аналитических реакций? Какими приемами осуществляют анализ «сухим» способом? Все ли реакции пригодны для качественного анализа?
526. В чем различие между макро-, микро- и полумикроанализом? Какие катионы могут присутствовать в анализируемом растворе, если отдельные порции его не дали осадков ни с HCl, ни с H2S, ни с (NH4)2S, ни с (NH4)2CO3?
527. Почему при осаждении катионов второй аналитической группы групповым реагентом (NH4)2CO3 добавляют гидроксид аммония и хлорид аммония и ведут осаждение при нагревании до 70-800С? Напишите уравнения реакций катионов второй группы с групповым реагентом.
528. Напишите молекулярные и ионно-молекулярные уравнения взаимодействия между гидроксидом аммония и катионами Fe2+, Zn2+, Co2+. Что произойдет, если подействовать избытком NH4OH? Составьте уравнения протекающих реакций.
529. Напишите уравнения реакций между пероксидом водорода и катионами Fe2+, Mn2+ в присутствии избытка гидроксида натрия. Как можно отделить катионы III аналитической группы от катионов II и I аналитических групп?
530. Какие анионы относятся к первой аналитической группе? Почему осаждение этих анионов раствором BaCl2 нужно проводить в нейтральной или слабощелочной среде? Составьте уравнения реакций ионов SO42 - , РO43 - , СO32 - , S2O32 - с групповым реагентом.
Количественный анализ
Задача этого раздела аналитической химии – определение количественного содержания отдельных элементов в соединениях (или отдельных веществ в смесях). С помощью количественного анализа находят массовые соотношения между элементами в соединениях, определяют количество растворенного вещества в определенном объеме раствора, иногда узнают процентное содержание какого-нибудь элемента в однородной смеси веществ.
В сельскохозяйственной практике чаще всего определяют содержание того или иного компонента в неоднородных веществах; например: азота, оксида фосфора (V) или оксида калия – в азотных, фосфорных или калийных удобрениях, микроэлементов - в почве, сахаров – в растительном материале. Количественный анализ имеет большое значение для биологии и агрохимии, почвоведения, физиологии растений.
Пример 1. На титрование 22 мл раствора гидроксида натрия
(Т  = 0,004254 г/мл) израсходовано 23,44 мл раствора хлороводородной кислоты. Вычислите титр раствора и молярную концентрацию эквивалентов кислоты.
= 0,004254 г/мл) израсходовано 23,44 мл раствора хлороводородной кислоты. Вычислите титр раствора и молярную концентрацию эквивалентов кислоты.
Решение. Находим молярную концентрацию эквивалентов гидроксида натрия в растворе по формуле:
 н.,
н.,
где М  =
=  г/моль.
г/моль.
Так как затрачиваемые на титрование объемы растворов обратно пропорциональны их молярным концентрациям эквивалентов веществ, следовательно  , отсюда
, отсюда

Титр раствора хлороводородной кислоты
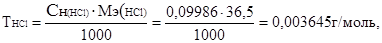
где Мэ(НСl) =  г/моль.
г/моль.
Пример 2. На титрование 0,4080 г карбоната калия затрачено 40,60мл раствора серной кислоты. Вычислите титр раствора и молярную концентрацию эквивалентов серной кислоты.
Решение. По закону эквивалентов  ;
;
отсюда  .
.
Найдем молярные массы эквивалентов


Подставляем эти значения в формулу и находим

Такое количество кислоты содержится в 40,60 мл раствора, следовательно

Молярную концентрацию эквивалентов серной кислоты рассчитываем по формуле:

Пример 3. В 200 мл раствора содержится 0,6975 г сульфата железа(II). На титрование 20 мл этого раствора в присутствии серной кислоты израсходовано 22мл раствора перманганата калия. Рассчитайте молярную концентрацию эквивалентов и титр раствора перманганата калия.
Решение. При титровании раствора сульфата железа (II) раствором перманганата калия происходит следующая окислительно-восстановительная реакция
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
окислитель восстановитель


 Mn+7 + 5ē = Mn+2 1 2 - восстановление
Mn+7 + 5ē = Mn+2 1 2 - восстановление
5 x 2
Fe+2 - 1ē = Fe+3 5 10 - окисление
Находим молярную концентрацию эквивалентов сульфата железа (II) по формуле 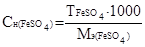 , где
, где


Следовательно, молярная концентрация эквивалентов сульфата железа(II) равна 
Исходя из соотношения:  вычисляем молярную концентрацию эквивалентов перманганата калия
вычисляем молярную концентрацию эквивалентов перманганата калия
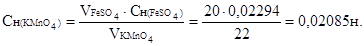
Титр раствора перманганата калия рассчитываем по формуле:
 , где
, где

следовательно, 
ЗАДАНИЯ
531. В 0,5 л раствора содержится 1,25 г карбоната натрия. На титрование 25 мл раствора карбоната натрия было израсходовано 12 мл раствора серной кислоты. Рассчитайте титр раствора и молярную концентрацию эквивалентов серной кислоты.
532. Рассчитайте молярную концентрацию эквивалентов и титр раствора хлороводородной кислоты, если на нейтрализацию 0,1735г карбоната натрия затрачено 20,55 мл раствора хлороводородной кислоты.
533. На нейтрализацию 20 мл 0,2135н. раствора хлороводородной кислоты затрачено 15,35 мл раствора гидроксида натрия. Определите молярную концентрацию эквивалентов и титр раствора гидроксида натрия.
534. На титрование 25 мл 0,1250н. раствора гидроксида натрия израсходовано 26,05 мл раствора серной кислоты. Определите титр раствора и молярную концентрацию эквивалентов серной кислоты.
535. Сколько граммов гидроксида натрия содержится в растворе, если на его нейтрализацию было израсходовано 22,5 мл 0,5н. раствора серной кислоты?
536. На титрование 2,2120 г карбоната натрия израсходовано 20,4 мл раствора хлороводородной кислоты. Вычислите титр и молярную концентрацию эквивалентов раствора хлороводородной кислоты.
537. На титрование 0,2020 г карбоната натрия затрачено 20,25мл раствора серной кислоты. Определите титр и молярную концентрацию эквивалентов раствора серной кислоты.
538. На титрование 25 мл раствора карбоната натрия, титр которого равен 0,005315г/мл, затрачено 26,82 мл раствора хлороводородной кислоты. Определите титр и молярную концентрацию эквивалентов раствора кислоты.
539. В 200 мл раствора содержится 1,0602 г карбоната натрия. На титрование 20 мл этого раствора было израсходовано 19,02 мл раствора хлороводородной кислоты. Рассчитайте титр и молярную концентрацию эквивалентов раствора хлороводородной кислоты.
540. Титр раствора карбоната калия равен 0,005320 г/мл. На титрование 20,00 мл этого раствора израсходовано 21,20 мл раствора серной кислоты. Рассчитайте титр и молярную концентрацию эквивалентов раствора серной кислоты.
541. Титр раствора серной кислоты равен 0,004902 г/мл. На титрование 20,00 мл этого раствора израсходовано 20,40 мл раствора гидроксида натрия. Рассчитайте титр и молярную концентрацию эквивалентов раствора гидроксида натрия.
542. На титрование 20,00 мл раствора азотной кислоты затрачено 15,00 мл 0,12н. раствора гидроксида натрия. Вычислите молярную концентрацию эквивалентов, титр раствора кислоты и массу азотной кислоты в 250 мл раствора.
543. В 250 мл раствора содержится 1,6802 г оксалата натрия Na2C2O4. На титрование 20 мл этого раствора в присутствии серной кислоты израсходовано 21,22 мл раствора перманганата калия KMnO4. Вычислите титр и молярную концентрацию эквивалентов раствора перманганата калия.
544. Титр раствора оксалата натрия ТNa2C2O4 = 0,006780г/мл. На титрование 25 мл этого раствора в присутствии серной кислоты израсходовано 24,84 мл раствора KMnO4. Рассчитайте титр и молярную концентрацию эквивалентов раствора перманганата калия.
545. В 200 мл раствора содержится 1,3484 г оксалата натрия Na2C2O4. На титрование 25 мл этого раствора в присутствии серной кислоты израсходовано 24,02 мл раствора перманганата калия. Вычислите титр и молярную концентрацию эквивалентов раствора перманганата калия.
546. Сколько мл раствора гидроксида калия, титр которого равен 0,01111г/мл, потребуется для нейтрализации 25,00 мл раствора хлороводородной кислоты, имеющего титр 0,007777г/мл?
547. На титрование 20,00 мл 0,1025н. раствора оксалата натрия Na2C2O4 израсходовано в присутствии серной кислоты 19,20 мл раствора перманганата калия. Вычислите титр и молярную концентрацию эквивалентов раствора перманганата калия.
548. На титрование 25 мл 0,1202н. раствора хлороводородной кислоты израсходовано 24,80 мл раствора гидроксида натрия. Вычислите молярную концентрацию эквивалентов, титр раствора щелочи и массу гидроксида натрия в 200 мл этого раствора.
549. Какой объем 0,15н. раствора гидроксида натрия пойдет на титрование 21,00 мл раствора серной кислоты с титром 0,003810 г/мл? Вычислите титр раствора гидроксида натрия.
550. На титрование 25,00 мл раствора щавелевой кислоты H2C2O4×2H2O, полученного растворением 1,7334г ее в мерной колбе вместимостью 250 мл, израсходовано в присутствии серной кислоты
22,10 мл раствора перманганата калия. Вычислите титр и молярную концентрацию эквивалентов раствора перманганата калия.
Органические соединения
При выполнении задания по органической химии формулы органических соединений следует давать структурно. Использование суммарных молекулярных формул, например С3Н6О или С3Н7ОН недопустимо, так как неясно, о каком конкретном соединении идет речь. Первой формуле соответствует три вещества, второй - два:
H H O
ê ê //
H - C - C - C альдегид
 ê ê
ê ê
Н Н Н 
H Н
ê ê

 С3Н6О
С3Н6О  H - C - C - C - H кетон
H - C - C - C - H кетон
ê êê ê
H O H
Н Н
ê ê
 H - C = C - C - ОH спирт
H - C = C - C - ОH спирт
ê ê
Н Н
Н Н Н
ê ê ê
 H - C - C - C - ОН пропанол - 1
H - C - C - C - ОН пропанол - 1
 ½ ½ ½
½ ½ ½
Н Н Н
С3Н7ОН Н Н Н
 ½ ½ ½
½ ½ ½
H - C - C - C - H пропанол-2
½ ½ ½
Н ОН Н
ЗАДАНИЯ
551. Напишите структурные формулы изомеров состава С5Н12, назовите изомеры. Получите один из них и покажите его химические свойства.
552. Напишите структурные формулы изомеров С5Н10, назовите изомеры. Получите один из них и покажите его химические свойства.
553. Напишите структурные формулы для изомеров состава С6Н12, назовите изомеры. Получите один из них и приведите реакции, характеризующие его свойства.
554. Получите двумя различными способами гексан. Напишите уравнения реакций гексана: а) с одной молекулой азотной кислоты; б) с одной молекулой хлора; в) горения. Укажите условия протекания реакций.
555. Получите пропан различными способами и покажите его химические свойства. Укажите условия протекания реакций.
556. По реакции Вюрца получите 2,3-диметилбутан и напишите реакции его бромирования и нитрования. Укажите условия протекания реакций.
557. Получите 2-метилбутан и напишите реакции его нитрования и бромирования. Укажите условия протекания реакций.
558. Получите двумя различными способами пропилен. Напишите уравнения реакций пропилена: а) с хлором; б) с хлороводородом; в) с водой; г) окисления. Укажите условия протекания реакций.
559. Напишите уравнения реакций: а) сульфирования; б) бромирования; в) нитрования бензола с образованием однозамещенных производных. Укажите условия протекания реакций.
560. Получите различными способами этилен и покажите его химические свойства. Укажите условия протекания реакций.
561. Изопрен. Получение, реакции взаимодействия с водородом и галогенами, полимеризация.
562. Напишите структурную формулу толуола. Дайте название в соответствии с номенклатурой ИЮПАК. Составьте уравнения реакций: а)хлорирования; б)окисления. Укажите условия протекания реакций и назовите продукты реакций.
563. Напишите структурную формулу бензола и уравнения реакции взаимодействия его с тремя молекулами: а) водорода; б) хлора; в) азотной кислоты. Укажите условия протекания реакций.
564. Получите двумя различными способами пропен. Напишите уравнения реакций: а) присоединения галогенводорода; б) окисления разбавленным раствором KMnO4 в щелочной среде; в) полимеризации пропена.
565. Получите двумя различными способами 2-метилпропен и напишите уравнения реакций гидратации, окисления и полимеризации этого вещества.
566. Напишите структурную формулу ацетилена и уравнения реакций получения его из карбида кальция и крекингом углеводородов. Составьте уравнения реакций полимеризации ацетилена с образованием бензола и винилацетилена.
567. Дайте определение реакции полимеризации. Напишите реакции полимеризации на примере образования полиэтилена и полипропилена.
568. Составьте структурные формулы фенола, о-крезола, м-крезола и n-крезола. Назовите эти соединения по системе ИЮПАК. Напишите уравнения реакций получения фенола по кумольному способу. Назовите продукты реакции.
569. Получите тремя различными способами 1-бутанол. Напишите уравнения соответст



 = S×S = S2.
= S×S = S2.
 = 1,62×10-7, находим молярную растворимость соли в моль/л: S =
= 1,62×10-7, находим молярную растворимость соли в моль/л: S =  = 0,4 ×10-3 моль/л.
= 0,4 ×10-3 моль/л. = 225,33 г/моль, следовательно, растворимость соли в г/л равна: P = S × M = 0,4 ×10-3 × 225,33 = 0,0913 г/л.
= 225,33 г/моль, следовательно, растворимость соли в г/л равна: P = S × M = 0,4 ×10-3 × 225,33 = 0,0913 г/л. , где P - растворимость в г/л, М – молярная масса (г/моль). МAg3PO4 = 418,58 г/моль, следовательно,
, где P - растворимость в г/л, М – молярная масса (г/моль). МAg3PO4 = 418,58 г/моль, следовательно, моль/л.
моль/л. моль/л,[PO43-]
моль/л,[PO43-]  .
.

 .
.
 = 10-14, можно найти концентрацию катионов водорода:
= 10-14, можно найти концентрацию катионов водорода:
 .
. Уксусная кислота – электролит слабый, следовательно, расчет рН делаем, исходя из константы диссоциации этой кислоты Уравнение диссоциации кислоты:
Уксусная кислота – электролит слабый, следовательно, расчет рН делаем, исходя из константы диссоциации этой кислоты Уравнение диссоциации кислоты:
 ;
;
 =
= 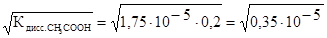 = 1,9×10-3 моль/л.
= 1,9×10-3 моль/л.
 .
. .
. Следовательно, растворимость СаСО3 в воде будет равна:
Следовательно, растворимость СаСО3 в воде будет равна: моль/л.
моль/л. .
. .
. моль/л, и следовательно, уменьшится в
моль/л, и следовательно, уменьшится в  раз.
раз. и
и 
 . Из таблицы III Приложения находим, что
. Из таблицы III Приложения находим, что  следовательно,
следовательно,


 :
: , рН= 14-4,66 = 9,33. Следовательно, рН буферного раствора увеличивается с 9,25 до 9,33, т.е. меняется незначительно.
, рН= 14-4,66 = 9,33. Следовательно, рН буферного раствора увеличивается с 9,25 до 9,33, т.е. меняется незначительно.
 , зная, что растворимость этой соли при данной температуре равна 0,013 г/л.
, зная, что растворимость этой соли при данной температуре равна 0,013 г/л.
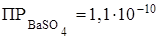 ?
? ?
? ?
?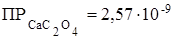 ) при смешении равных объемов 0,01М растворов CaCl2 и Na2C2O4?
) при смешении равных объемов 0,01М растворов CaCl2 и Na2C2O4? ?
? .
. .
. .
. =1,75×10-5.
=1,75×10-5. = 0,004254 г/мл) израсходовано 23,44 мл раствора хлороводородной кислоты. Вычислите титр раствора и молярную концентрацию эквивалентов кислоты.
= 0,004254 г/мл) израсходовано 23,44 мл раствора хлороводородной кислоты. Вычислите титр раствора и молярную концентрацию эквивалентов кислоты. н.,
н., =
=  г/моль.
г/моль. , отсюда
, отсюда
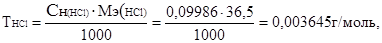
 г/моль.
г/моль. ;
; .
.






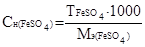 , где
, где


 вычисляем молярную концентрацию эквивалентов перманганата калия
вычисляем молярную концентрацию эквивалентов перманганата калия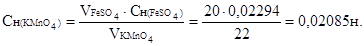
 , где
, где

 ê ê
ê ê

 С3Н6О
С3Н6О  H - C - C - C - H кетон
H - C - C - C - H кетон ½ ½ ½
½ ½ ½

