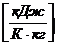СОДЕРЖАНИЕ
1. Основные сведения о процессах изменения фазового состояния воды. 2
2. Определение параметров состояния водяного пара. 6
2.1 Кипящая жидкость. 6
2.1.1 УДЕЛЬНАЯ ЭНТАЛЬПИЯ КИПЯЩЕЙ ЖИДКОСТИ.. 8
2.2 Сухой насыщенный пар. 9
2.2.1. ЭНТАЛЬПИЯ СУХОГО НАСЫЩЕННОГО ПАРА.. 11
2.3 Влажный насыщенный пар. 12
2.3.1 УДЕЛЬНЫЙ ОБЪЕМ ВЛАЖНОГО НАСЫЩЕННОГО ПАРА.. 12
2.3.2 УДЕЛЬНАЯ ВНУТРЕННЯЯ ЭНЕРГИЯ ВЛАЖНОГО НАСЫЩЕННОГО ПАРА 13
2.3.3 УДЕЛЬНАЯ ЭНТАЛЬПИЯ ВЛАЖНОГО НАСЫЩЕННОГО ПАРА.. 13
2.3.4 УДЕЛЬНАЯ ЭНТРОПИЯ ВЛАЖНОГО НАСЫЩЕННОГО ПАРА.. 14
2.4 Перегретый пар. 14
3.1 Т-S диаграмма водяного пара. 16
4. i-S диаграмма водяного пара. 20
5. Определение параметров водяного пара с помощью i-S диаграммы.. 23
6. Изображение простейших процессов на P-V, T-S и i-S диаграммах. Вычисление параметров водяного пара с помощью I-S диаграммы. 25
7. Примеры решения задач. 31
8. ПРИЛОЖЕНИЕ. 46
Таблица 1. Насыщенный водяной пар (по температуре) 46
Таблица 2. Насыщенный водяной пар (по давлению) 50
Таблица 3. Вода и перегретый водяной пар. 55
I-S диаграмма водяного пара. 63
9. СПИСОК ЛИТЕРАТУРЫ.. 64
1. Основные сведения о процессах изменения фазового состояния воды.
На рис.1 изображено, так называемое фазовое пространство. Заштрихованные области на рис.1 – это фазовые поверхности. Например, область Ж+П соответствует точкам одновременного сосуществования двух фаз: жидкой и паровой.

Рис.1 Фазовое пространство

Рис. 2 Фазовая P-υ диаграмма

Рис. 3 Фазовая Р-Т диаграмма воды
| 1 – процесс плавления;
2 – кристаллизация (отвердевание);
3 – парообразование;
| 4 – конденсация;
5 – сублимация (возгонка);
6 – десублимация (конденсация)
|
Фаза – однородная часть системы. У воды фазовые состояния совпадают с агрегатными состояниями: твердым, жидким и газообразным (собственно газовым или паровым).
Обозначение фаз: Т – твердая, Ж – жидкая, Г – газообразная.
Пар (П) – газообразное состояние вещества при температуре ниже критической (Т кр).
На рис. 2 и 3 приведены проекции фазового пространства на плоскости PV и РТ, соответственно.
Процесс перехода из жидкости в пар называется парообразованием.
Испарение - парообразование со свободной поверхности вещества.
Кипение - парообразование внутрь пузырьков, образующихся по всему объему жидкости.
Процесс перехода из паровой фазы в жидкую называется конденсацией.
Процесс перехода твердой фазы в жидкую называется плавлением, обратный – кристаллизацией (отвердеванием).
Процесс перехода вещества из твердой фазы в газообразную называется сублимацией (возгонкой), а процесс перехода из паровой фазы в твердую – десублимацией (конденсацией). Твердая и жидкая фазы называются конденсированными фазами.
Сублимация – парообразование со свободной поверхности твердого вещества. Например, при атмосферном давлении углекислый газ и нафталин переходят из твердого состояния сразу в парообразное.
Испарение происходит всегда, но при низких температурах количество молекул, вылетающих со свободной поверхности, не будет равно количеству молекул, возвращающихся обратно.
Если при Р = const повышать температуру, то наступит момент равенства этих процессов, называемый насыщением.
При температуре насыщения давление водяного пара над поверхностью жидкости равно давлению окружающей среды. В этом состоянии жидкость и пар называются насыщенными. Значение температуры насыщения зависит от величины давления. Например, при нормальном физическом давлении (101325 Па, 760 мм. рт.ст.) температура насыщения равна 100°С. Чем выше давление, тем больше температура насыщения. Повышение температуры кипения воды свыше 100°С обеспечивается за счет создания повышенного давления (принцип действия скороварки и автоклава). Между давлением насыщения и температурой насыщения существует однозначная зависимость, задаваемая уравнением Клайперон-Клаузиуса (рассматривается далее). Значения давления и температуры насыщения содержатся в специальных таблицах насыщенного водяного пара. Вход в эти таблицы либо по давлению, либо по температуре (см. Приложение). Связь между давлением и температурой насыщения – это линия АК на рис. 3, каждая точка которой соответствует уравнению Клайперона-Клаузиуса. Линия АК называется кривой парообразования.
Точка А – тройная точка, где сосуществуют одновременно все три фазы. Эта точка для воды имеет строго фиксированные параметры: t тр = 0.01°С, P тр = 610,8 Па.
Точка К – критическая точка, выше которой одновременное сосуществование двух фаз невозможно. При температуре выше критической различий между жидкостью и газом данного вещества нет: свойства совпадают.
Параметры точки К для воды: Р кр = 22,129МПа, t кр= 374,14°С.
Если надо превратить лед в перегретый пар, то вода должна пройти через 6 состояний: вода твердая (лед), недогретая жидкость (t<tнас), насыщенная (кипящая) жидкость (t = t нас , начало парообразования) влажный насыщенный пар, сухой насыщенный пар, перегретый пар.
Точки на кривой АК (рис. 2) соответствуют кипящей жидкости. Линия АК – линия насыщения жидкости (или нижняя пограничная кривая), на которой точки принято обозначать одним штрихом (например С′).
Точки на линии KF (рис. 2), называемой верхней пограничной кривой, соответствуют сухому насыщенному пару.
Между кривыми АК и KF (рис. 2) лежит область влажного насыщенного пара.
Влажный насыщенный пар – механическая смесь капелек жидкости и сухого насыщенного пара.
Степенью сухости пара (х) называется массовая доля сухого насыщенного пара во влажном насыщенном паре.
Точки на кривой KF соответствуют состоянию, когда капелек кипящей жидкости во влажном насыщенном паре уже нет.
Перегретым называется пар, температура которого больше температуры насыщения при данном давлении.
Влагосодержанием (степенью влажности) называется величина У =1– x, то есть массовая доля кипящей жидкости во влажном насыщенном паре.
У =1 на линии АК и У =0 на линии KF.
У воды твердой известно 5 кристаллических модификаций: III1, III2, III3, III5, III6.
Модификация III1 – обычный лед, остальные модификации существуют только при высоких давлениях.
Вода относится к аномальным веществам, у которых удельный объем твердой фазы больше, чем удельный объем жидкой фазы. Аномальные вещества: чугун, висмут и др. У аномальных веществ кривая плавления на рис. 3 идет из точки А влево вверх, у нормальных веществ – вправо вверх. У аномальных веществ с ростом давления температура плавления понижается (это свойство используется в коньках и лыжах). Правее верхней пограничной кривой (х=1) пар находится в перегретом состоянии. В расчетах процессов водяного пара используется температура t (° С) и Т (° К). Во всех формулах используется абсолютное давление Р. Если в системе давления выше атмосферного В, то Р=Р ман+ В, если в системе разряжение (вакуум), то абсолютное давление Р=В – Р вак, где Рвак – показания вакуумметра.
В практических расчетах используется понятие удельной энтальпии водяного пара i, (Дж/кг):
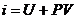 ,
,
где V – удельный объем.
Внутренняя энергия идеального газа (U) зависит только от температуры. Энтальпия же, в отличии от внутренней энергии, учитывает еще и потенциальную энергию сжатой системы (Р V). В процессах при постоянной температуре изменение удельной энтропии S, (Дж/(К·кг)) характеризует теплоту (q Т), которой обменивается система и окружающая среда.
Так как  , то q Т = ТΔ S
, то q Т = ТΔ S
Кипящая жидкость
Состоянию кипящей жидкости соответствует нижняя пограничная кривая (х =0).
Обозначим через q′ теплоту, необходимую для нагрева жидкости от 00С до t нас при Р = const.
Из общей термодинамики известна общая формула теплоемкости
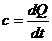 Þ q′=
Þ q′=  ,@
,@  р t нас
р t нас
Полагая среднюю массовую изобарную теплоемкость ( р) воды в диапазоне температур 0 - t нас равной 4,19 (кДж/(кг·К)), получим
р) воды в диапазоне температур 0 - t нас равной 4,19 (кДж/(кг·К)), получим
q′ = 4.19 tнас, [кДж/кг]
из первого начала термодинамики: q= ΔU + A
и формулы для работы термодеформационной системы в изобарном процессе:

для нашего случая получим:
q ′ = (U ′ – Uo ′) + P (V ′ – Vo ′);
Здесь: второе слагаемое – это работа расширения жидкости в случае нагрева её от 0° С до t нас при постоянном давлении:
А p = P (V ′ – Vo ′),
где Vo ′ и Uo ′ – удельный объем и удельная внутренняя энергия жидкости при 00 С.
в инженерских расчетах условились принимать внутреннюю энергию системы при t =0° С, равной нулю.
таким образом, при
U 0′ = 0 и
q ′ > U ′
При давлениях, не превышающих 4МПа,
(V ′ – V 0 ′) ≈ 0 и
Это приближенное равенство используется в практических расчетах.
При давлениях, превышающих 4 МПа, приближенным соотношением пользоваться нельзя и расчет должен производиться по точной формуле:
(*)
2.1.1 УДЕЛЬНАЯ ЭНТАЛЬПИЯ КИПЯЩЕЙ ЖИДКОСТИ.
Из общей термодинамики
i = U + PV Þ i ′ = U ′ + PV ′.
Подставим сюда значение U′из формулы (*) данного параграфа:
i ′ = q ′ – PV ′ + PVo ′ + PV ′ = q ′ + PVo ′, [кДж /кг]
,
следовательно
i ′> q ′> U ′
для практических расчетов слагаемым PV 0′ пренебрегают и тогда получается приближенное соотношение:
.
2.1.2 УДЕЛЬНАЯ ЭНТРОПИЯ КИПЯЩЕЙ ЖИДКОСТИ (S′)
В инженерных расчетах условились принимать энтропию системы при 0°С равной нулю
Δ S = S′ – S0′, откуда S′ = S0′ + Δ S,
Здесь S 0 ′- удельная энтропия жидкости при 0° С
Т.к. S 0′ = 0, то S ′ = Δ S.
Из общей термодинамики известно соотношение:
dq = TdS Þ ΔS =  .
.
Для нашего случая:
Δ S =  .
.
Подставляя в эту формулу 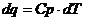 и интегрируя при
и интегрируя при  , получим:
, получим:
Δ S = 4,19 ln 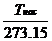 ,
,
Откудаудельная энтропия кипящей жидкости:
| | | |
| S′ = 4,19 ln 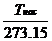
| |
| | , [ 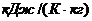 ] ]
| |
|
Сухой насыщенный пар
Состоянию сухого насыщенного пара (снп) соответствуют точки на верхней пограничной кривой (х =1) рис 2.
2.2.1 СКРЫТАЯ ТЕПЛОТА ПАРООБРАЗОВАНИЯ.
Скрытая теплота парообразования (r) – это количество теплоты, необходимое для перевода одного 1 кг кипящей жидкости в состояние сухого насыщенного пара. Эта теплота подводится на участке С′C′′, (рис 2).
Скрытая теплота парообразования r – измеряется в Дж/кг или в кДж/кг.
В процессе парообразования (C′C″), протекающем при постоянном давлении и постоянной температуре, подвод теплоты не приводит к росту температуры влажного насыщенного пара, поэтому теплота (r) называется скрытой.
С ростом давления скрытая теплота парообразования уменьшается и в критической точке К (Р кр=22,129 МПа, Т кр = 374,14о С) равна нулю.
Как известно из общей термодинамики площадь под кривой на T - S диаграмме – это теплота процесса.
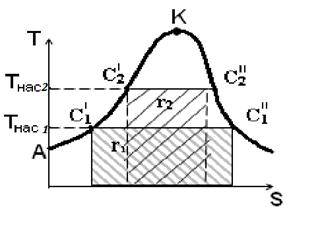
Рис. 4. Графическое изображение скрытой теплоты парообразования (r) на T-S диаграмме водяного пара
Из первого начала термодинамики
Q = ΔU + A,
записанного для процесса парообразования (C′C″), скрытая теплота парообразования равна
откуда удельная внутренняя энергия сухого насыщенного пара
|
| | | U′′ = r + U′ – P (V′′ – V′)
| |
Обозначим:
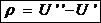
и
Здесь: 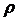 - Работа дисгрегации, т.е. работа, затрачиваемая на преодоление сил сцепления между молекулами воды в процессе парообразования. Величину ρ часто именуют внутренней теплотой парообразования.
- Работа дисгрегации, т.е. работа, затрачиваемая на преодоление сил сцепления между молекулами воды в процессе парообразования. Величину ρ часто именуют внутренней теплотой парообразования.
Ψ – работа расширения в процессе превращения кипящей жидкости в сухой насыщенный пар. Другое название ψ – внешняя теплота парообразования.
ψ/ρ = 0,008 … 0,15


Рис. 5. Графическое изображение зависимости составляющих скрытой теплоты парообразования от величины температуры насыщения
При парообразовании теплота r потребляется, а при конденсации такое же количество теплоты выделяется, т.е. скрытая теплота парообразования равна теплоте конденсации по абсолютной величине.
Влажный насыщенный пар
Состояние кипящей жидкости и сухого насыщенного пара характеризуется всего одним параметром (Р нас или t нас), т.к. Р нас и t нас связаны между собой уравнением Клапейрона–Клаузиуса
,
которому соответствует линия АК на Р-Т диаграмме (рис. 3).
Для того чтобы определить состояние влажного насыщенного пара, нужно знать 2 параметра, а именно: Р нас (или t нас) и степень сухости (х).
Напомним, что степень сухости (х) – это массовая доля сухого насыщенного пара во влажном насыщенном паре, т.е. количество килограммов сухого насыщенного пара в 1кг влажного насыщенного пара.
степень влажности (у) – это массовая доля кипящей жидкости во влажном насыщенном паре, т.е. количество килограммов кипящей жидкости в 1кг влажного насыщенного пара: 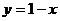
Перегретый пар
Перегрев пара – это разность температуры перегретого пара и температуры насыщения:
Δ tпп = t – tнас
Теплота перегрева (q пп)– теплота, которую нужно подвести к 1 кг сухого насыщенного пара с температурой tнас для превращения его в перегретый пар с температурой t.
|
| | q пп = 
| |
,
Здесь Срп – удельная изобарная теплоемкость перегретого пара.
Если в диапазоне от температуры насыщения до температуры перегретого пара взять среднее значение 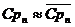 ,
,
то 
Из I закона термодинамики:
q пп = (U – U ″) + P (V – V ″),
Откуда удельная внутренняя энергия перегретого пара (U):
U = qпп+ U″ – P (V – V″),
Здесь V – удельный объем перегретого пара при заданных значениях Р и t (берется из таблиц перегретого пара).
Удельная ЭНТАЛЬПИЯ перегретого пара при P = const:
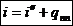
Или из определения энтальпии:
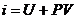
Удельная энтропия перегретого пара:
ΔS = S – S ″,
S = S″ + ΔS = 4,19 ln 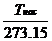 +
+  + ΔS,
+ ΔS,
ΔS =  =
=  ln
ln  ,
,

 ,
, 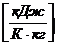
Перегретый пар на практике иногда называют «острым» паром.
I-S диаграмма водяного пара

СПИСОК ЛИТЕРАТУРЫ
Основная:
1. В.Н. Диденко, О.И. Варфоломеева. Фазовые переходы. Методическое пособие.
-Ижевск, 2003.
2. Кудйнов В.А., Карташов Э.М. Техническая термодинамика. - М.: Высшая школа, 2000. - 262 с.
3. Теплотехника./Под ред. Луканина В.Н. - М.: Высшая школа, 1999. - 672с.
4. Лариков Н.Н. Теплотехника. - М.: Стройиздат, 1985. -432с.
5. Рабинович – Сборник задач по математике.
Дополнительная:
1. Болгарский А.В., Мухачев Г.А., Щукин В.К. Термодинамика и теплопередача. -М.: Высшая школа, 1975. - 496 с.
2. Юдаев Б.Н. Техническая термодинамика и теплопередача. - М.: Высшая школа,
1982.
СОДЕРЖАНИЕ
1. Основные сведения о процессах изменения фазового состояния воды. 2
2. Определение параметров состояния водяного пара. 6
2.1 Кипящая жидкость. 6
2.1.1 УДЕЛЬНАЯ ЭНТАЛЬПИЯ КИПЯЩЕЙ ЖИДКОСТИ.. 8
2.2 Сухой насыщенный пар. 9
2.2.1. ЭНТАЛЬПИЯ СУХОГО НАСЫЩЕННОГО ПАРА.. 11
2.3 Влажный насыщенный пар. 12
2.3.1 УДЕЛЬНЫЙ ОБЪЕМ ВЛАЖНОГО НАСЫЩЕННОГО ПАРА.. 12
2.3.2 УДЕЛЬНАЯ ВНУТРЕННЯЯ ЭНЕРГИЯ ВЛАЖНОГО НАСЫЩЕННОГО ПАРА 13
2.3.3 УДЕЛЬНАЯ ЭНТАЛЬПИЯ ВЛАЖНОГО НАСЫЩЕННОГО ПАРА.. 13
2.3.4 УДЕЛЬНАЯ ЭНТРОПИЯ ВЛАЖНОГО НАСЫЩЕННОГО ПАРА.. 14
2.4 Перегретый пар. 14
3.1 Т-S диаграмма водяного пара. 16
4. i-S диаграмма водяного пара. 20
5. Определение параметров водяного пара с помощью i-S диаграммы.. 23
6. Изображение простейших процессов на P-V, T-S и i-S диаграммах. Вычисление параметров водяного пара с помощью I-S диаграммы. 25
7. Примеры решения задач. 31
8. ПРИЛОЖЕНИЕ. 46
Таблица 1. Насыщенный водяной пар (по температуре) 46
Таблица 2. Насыщенный водяной пар (по давлению) 50
Таблица 3. Вода и перегретый водяной пар. 55
I-S диаграмма водяного пара. 63
9. СПИСОК ЛИТЕРАТУРЫ.. 64
1. Основные сведения о процессах изменения фазового состояния воды.
На рис.1 изображено, так называемое фазовое пространство. Заштрихованные области на рис.1 – это фазовые поверхности. Например, область Ж+П соответствует точкам одновременного сосуществования двух фаз: жидкой и паровой.

Рис.1 Фазовое пространство

Рис. 2 Фазовая P-υ диаграмма

Рис. 3 Фазовая Р-Т диаграмма воды
| 1 – процесс плавления;
2 – кристаллизация (отвердевание);
3 – парообразование;
| 4 – конденсация;
5 – сублимация (возгонка);
6 – десублимация (конденсация)
|
Фаза – однородная часть системы. У воды фазовые состояния совпадают с агрегатными состояниями: твердым, жидким и газообразным (собственно газовым или паровым).
Обозначение фаз: Т – твердая, Ж – жидкая, Г – газообразная.
Пар (П) – газообразное состояние вещества при температуре ниже критической (Т кр).
На рис. 2 и 3 приведены проекции фазового пространства на плоскости PV и РТ, соответственно.
Процесс перехода из жидкости в пар называется парообразованием.
Испарение - парообразование со свободной поверхности вещества.
Кипение - парообразование внутрь пузырьков, образующихся по всему объему жидкости.
Процесс перехода из паровой фазы в жидкую называется конденсацией.
Процесс перехода твердой фазы в жидкую называется плавлением, обратный – кристаллизацией (отвердеванием).
Процесс перехода вещества из твердой фазы в газообразную называется сублимацией (возгонкой), а процесс перехода из паровой фазы в твердую – десублимацией (конденсацией). Твердая и жидкая фазы называются конденсированными фазами.
Сублимация – парообразование со свободной поверхности твердого вещества. Например, при атмосферном давлении углекислый газ и нафталин переходят из твердого состояния сразу в парообразное.
Испарение происходит всегда, но при низких температурах количество молекул, вылетающих со свободной поверхности, не будет равно количеству молекул, возвращающихся обратно.
Если при Р = const повышать температуру, то наступит момент равенства этих процессов, называемый насыщением.
При температуре насыщения давление водяного пара над поверхностью жидкости равно давлению окружающей среды. В этом состоянии жидкость и пар называются насыщенными. Значение температуры насыщения зависит от величины давления. Например, при нормальном физическом давлении (101325 Па, 760 мм. рт.ст.) температура насыщения равна 100°С. Чем выше давление, тем больше температура насыщения. Повышение температуры кипения воды свыше 100°С обеспечивается за счет создания повышенного давления (принцип действия скороварки и автоклава). Между давлением насыщения и температурой насыщения существует однозначная зависимость, задаваемая уравнением Клайперон-Клаузиуса (рассматривается далее). Значения давления и температуры насыщения содержатся в специальных таблицах насыщенного водяного пара. Вход в эти таблицы либо по давлению, либо по температуре (см. Приложение). Связь между давлением и температурой насыщения – это линия АК на рис. 3, каждая точка которой соответствует уравнению Клайперона-Клаузиуса. Линия АК называется кривой парообразования.
Точка А – тройная точка, где сосуществуют одновременно все три фазы. Эта точка для воды имеет строго фиксированные параметры: t тр = 0.01°С, P тр = 610,8 Па.
Точка К – критическая точка, выше которой одновременное сосуществование двух фаз невозможно. При температуре выше критической различий между жидкостью и газом данного вещества нет: свойства совпадают.
Параметры точки К для воды: Р кр = 22,129МПа, t кр= 374,14°С.
Если надо превратить лед в перегретый пар, то вода должна пройти через 6 состояний: вода твердая (лед), недогретая жидкость (t<tнас), насыщенная (кипящая) жидкость (t = t нас , начало парообразования) влажный насыщенный пар, сухой насыщенный пар, перегретый пар.
Точки на кривой АК (рис. 2) соответствуют кипящей жидкости. Линия АК – линия насыщения жидкости (или нижняя пограничная кривая), на которой точки принято обозначать одним штрихом (например С′).
Точки на линии KF (рис. 2), называемой верхней пограничной кривой, соответствуют сухому насыщенному пару.
Между кривыми АК и KF (рис. 2) лежит область влажного насыщенного пара.
Влажный насыщенный пар – механическая смесь капелек жидкости и сухого насыщенного пара.
Степенью сухости пара (х) называется массовая доля сухого насыщенного пара во влажном насыщенном паре.
Точки на кривой KF соответствуют состоянию, когда капелек кипящей жидкости во влажном насыщенном паре уже нет.
Перегретым называется пар, температура которого больше температуры насыщения при данном давлении.
Влагосодержанием (степенью влажности) называется величина У =1– x, то есть массовая доля кипящей жидкости во влажном насыщенном паре.
У =1 на линии АК и У =0 на линии KF.
У воды твердой известно 5 кристаллических модификаций: III1, III2, III3, III5, III6.
Модификация III1 – обычный лед, остальные модификации существуют только при высоких давлениях.
Вода относится к аномальным веществам, у которых удельный объем твердой фазы больше, чем удельный объем жидкой фазы. Аномальные вещества: чугун, висмут и др. У аномальных веществ кривая плавления на рис. 3 идет из точки А влево вверх, у нормальных веществ – вправо вверх. У аномальных веществ с ростом давления температура плавления понижается (это свойство используется в коньках и лыжах). Правее верхней пограничной кривой (х=1) пар находится в перегретом состоянии. В расчетах процессов водяного пара используется температура t (° С) и Т (° К). Во всех формулах используется абсолютное давление Р. Если в системе давления выше атмосферного В, то Р=Р ман+ В, если в системе разряжение (вакуум), то абсолютное давление Р=В – Р вак, где Рвак – показания вакуумметра.
В практических расчетах используется понятие удельной энтальпии водяного пара i, (Дж/кг):
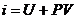 ,
,
где V – удельный объем.
Внутренняя энергия идеального газа (U) зависит только от температуры. Энтальпия же, в отличии от внутренней энергии, учитывает еще и потенциальную энергию сжатой системы (Р V). В процессах при постоянной температуре изменение удельной энтропии S, (Дж/(К·кг)) характеризует теплоту (q Т), которой обменивается система и окружающая среда.
Так как  , то q Т = ТΔ S
, то q Т = ТΔ S
Определение параметров состояния водяного пара.
Кипящая жидкость
Состоянию кипящей жидкости соответствует нижняя пограничная кривая (х =0).
Обозначим через q′ теплоту, необходимую для нагрева жидкости от 00С до t нас при Р = const.
Из общей термодинамики известна общая формула теплоемкости
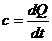 Þ q′=
Þ q′=  ,@
,@  р t нас
р t нас
Полагая среднюю массовую изобарную теплоемкость ( р) воды в диапазоне температур 0 - t нас равной 4,19 (кДж/(кг·К)), получим
р) воды в диапазоне температур 0 - t нас равной 4,19 (кДж/(кг·К)), получим
q′ = 4.19 tнас, [кДж/кг]
из первого начала термодинамики: q= ΔU + A
и формулы для работы термодеформационной системы в изобарном процессе:

для нашего случая получим:
q ′ = (U ′ – Uo ′) + P (V ′ – Vo ′);
Здесь: второе слагаемое – это работа расширения жидкости в случае нагрева её от 0° С до t нас при постоянном давлении:
А p = P (V ′ – Vo ′),
где Vo ′ и Uo ′ – удельный объем и удельная внутренняя энергия жидкости при 00 С.
в инженерских расчетах условились принимать внутреннюю энергию системы при t =0° С, равной нулю.
таким образом, при
U 0′ = 0 и
q ′ > U ′
При давлениях, не превышающих 4МПа,
(V ′ – V 0 ′) ≈ 0 и
Это приближенное равенство используется в практических расчетах.
При давлениях, превышающих 4 МПа, приближенным соотношением пользоваться нельзя и расчет должен производиться по точной формуле:
(*)
2.1.1 УДЕЛЬНАЯ ЭНТАЛЬПИЯ КИПЯЩЕЙ ЖИДКОСТИ.
Из общей термодинамики
i = U + PV Þ i ′ = U ′ + PV ′.
Подставим сюда значение U′из формулы (*) данного параграфа:
i ′ = q ′ – PV ′ + PVo ′ + PV ′ = q ′ + PVo ′, [кДж /кг]
,
следовательно
i ′> q ′> U ′
для практических расчетов слагаемым PV 0′ пренебрегают и тогда получается приближенное соотношение:
.
2.1.2 УДЕЛЬНАЯ ЭНТРОПИЯ КИПЯЩЕЙ ЖИДКОСТИ (S′)
В инженерных расчетах условились принимать энтропию системы при 0°С равной нулю
Δ S = S′ – S0′, откуда S′ = S0′ + Δ S,
Здесь S 0 ′- удельная энтропия жидкости при 0° С
Т.к. S 0′ = 0, то S ′ = Δ S.
Из общей термодинамики известно соотношение:
dq = TdS Þ ΔS =  .
.
Для нашего случая:
Δ S =  .
.
Подставляя в эту формулу 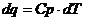 и интегрируя при
и интегрируя при  , получим:
, получим:
Δ S = 4,19 ln 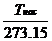 ,
,
Откудаудельная энтропия кипящей жидкости:
| | | |
| S′ = 4,19 ln 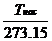
| |
| | , [ 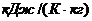 ] ]
| |
|
Сухой насыщенный пар
Состоянию сухого насыщенного пара (снп) соответствуют точки на верхней пограничной кривой (х =1) рис 2.
2.2.1 СКРЫТАЯ ТЕПЛОТА ПАРООБРАЗОВАНИЯ.
Скрытая теплота парообразования (r) – это количество теплоты, необходимое для перевода одного 1 кг кипящей жидкости в состояние сухого насыщенного пара. Эта теплота подводится на участке С′C′′, (рис 2).
Скрытая теплота парообразования r – измеряется в Дж/кг или в кДж/кг.
В процессе парообразования (C′C″), протекающем при постоянном давлении и постоянной температуре, подвод теплоты не приводит к росту температуры влажного насыщенного пара, поэтому теплота (r) называется скрытой.
С ростом давления скрытая теплота парообразования уменьшается и в критической точке К (Р кр=22,129 МПа, Т кр = 374,14о С) равна нулю.
Как известно из общей термодинамики площадь под кривой на T - S диаграмме – это теплота процесса.

Рис. 4. Графическое изображение скрытой теплоты парообразования (r) на T-S диаграмме водяного пара
Из первого начала термодинамики
Q = ΔU + A,
записанного для процесса парообразования (C′C″), скрытая теплота парообразования равна
откуда удельная внутренняя энергия сухого насыщенного пара
|
| | | U′′ = r + U′ – P (V′′ – V′)
| |
Обозначим:
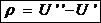
и
Здесь: 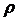 - Работа дисгрегации, т.е. работа, затрачиваемая на преодоление сил сцепления между молекулами воды в процессе парообразования. Величину ρ часто именуют внутренней теплотой парообразования.
- Работа дисгрегации, т.е. работа, затрачиваемая на преодоление сил сцепления между молекулами воды в процессе парообразования. Величину ρ часто именуют внутренней теплотой парообразования.
Ψ – работа расширения в процессе превращения кипящей жидкости в сухой насыщенный пар. Другое название ψ – внешняя теплота парообразования.
ψ/ρ = 0,008 … 0,15


Рис. 5. Графическое изображение зависимости составляющих скрытой теплоты парообразования от величины температуры насыщения
При парообразовании теплота r потребляется, а при конденсации такое же количество теплоты выделяется, т.е. скрытая теплота парообразования равна теплоте конденсации по абсолютной величине.






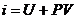 ,
, , то q Т = ТΔ S
, то q Т = ТΔ S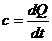 Þ q′=
Þ q′=  ,@
,@  р t нас
р t нас


 .
. .
.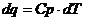 и интегрируя при
и интегрируя при  , получим:
, получим: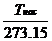 ,
,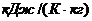 ]
]

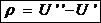 и
и
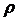 - Работа дисгрегации, т.е. работа, затрачиваемая на преодоление сил сцепления между молекулами воды в процессе парообразования. Величину ρ часто именуют внутренней теплотой парообразования.
- Работа дисгрегации, т.е. работа, затрачиваемая на преодоление сил сцепления между молекулами воды в процессе парообразования. Величину ρ часто именуют внутренней теплотой парообразования.


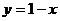

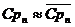 ,
,
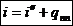
 + ΔS,
+ ΔS, =
=  ln
ln  ,
,
 ,
,