

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
Топ:
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Строение алкадиенов.
π -электронные облака двойных связей перекрываются между собой, образуя единое π -облако. В сопряженной системе электроны делокализованы по всем атомам углерода:

Чем длиннее молекула, тем она более устойчива.
Изомерия алкадиенов.
Для диенов характерна изомерия углеродного скелета, изомерия положения двойных связей и пространстве
Важнейшие представители сопряженных диенов:
СН2 = СН-СН = СН2 СН2 = С (СН3)-СН = СН2.
бутадиен-1,3 изопреннная изомерия.
Физические свойства алкадиенов.
Бутадиен-1,3 – легко сжижающийся газ с неприятным запахом. А изопрен – жидкость.
Получение диенов.
1. Дегидрирование алканов:


2. Реакция Лебедева (одновременное дегидрирование и дегидратация):
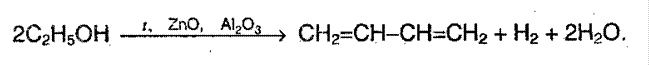
Химические свойства алкадиенов.
Химические свойства алкадиенов обусловлены наличием двойных связей. Реакция присоединения может протекать в 2х направлениях: 1,4 и 1,2 – присоединение. Например,
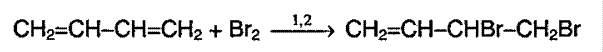

Способность алкадиенов к полимеризации:
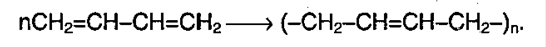
Для получения изопренового каучука используют реакцию при воздействии металлоорганических катализаторов:
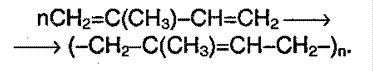
Применение алкадиенов.
Основная сфера использования диенов и их производных – это производство каучука.
Алкены – непредельные углеводороды, в составе которых есть одна двойная связь. Примеры алкенов:
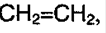
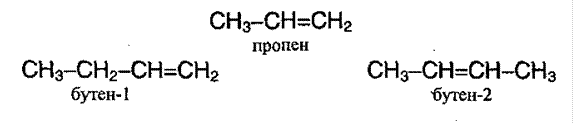
Все атомы углерода находятся в sp2 – гибридизации; атомы находятся в плоскости, образуя угол 120 °С. Негибридизованные р -орбитали находятся над и под плоскостью молекулы, образуя π – связь. Эта связь менее прочная, поэтому боковое перекрывание не очень эффективно, чем осевое.
|
|
Изомерия алкенов.
Для алкенов характерна изомерия углеродного скелета, изомерия положения кратной связи и пространственная изомерия:

Физические свойства алкенов.
Температуры плавления и кипения несколько выше, чем у алканов. Алкены нерастворимы в воде, хорошо растворимы в органических растворителях.
Методы получения алкенов.
1. Крекинг алканов при 400-700°С. Реакция идет по свободнорадикальному механизму:

2. Дегидрирование алканов:

3. Реакция элиминирования (отщепление): от соседних атомов углерода отщепляются 2 атома или 2 группы атомов, и образуется двойная связь. К таким реакциям относят:
А) Дегидратацию спиртов (нагрев свыше 150°С, при участии серной кислоты, как водоотнимающего реагента):
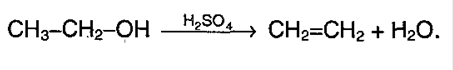
Б) Отщепление галогенводородов при воздействии спиртового раствора щелочи:
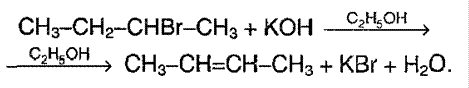
Атом водорода отщепляется преимущественно от того атома углерода, который связан с меньшим числом атомов водорода(наименее гидрогенизированного атома) – правило Зайцева.
В) Дегалогенирование:
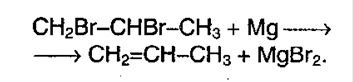
Применение алкенов.
Алкены – основные соединения для промышленного синтеза стирола, ацетона, фенола, полипропилена, глицерина и т.д.
Поделиться
Распечатать
Алкины – это непредельные углеводороды, молекулы которых содержат тройную связь. Представитель – ацетилен, гомологи его:



Общая формула – CnH2n-2.
Строение алкинов.
Атомы углерода, которые образуют тройную связь, находятся в sp- гибридизации. σ -связи лежат в плоскости, под углом 180 °С, а π -связи образованы путем перекрывания 2х пар негибридных орбиталей соседних атомов углерода.
Изомерия алкинов.
Для алкинов характерна изомерия углеродного скелета, изомерия положения кратной связи.
Пространственная изомерия не характерна.
Получение алкинов.
1. Отщепление 2х молекул галогенводорода от дигалогенавконов, которые находятся либо у соседних атомов углерода или у одного. Отщепление происходит под воздействием спиртового раствора щелочи:
|
|

2. Действие галогеналканов на соли ацетиленовых углевородородов:
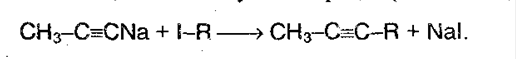
Реакция протекает через образование нуклеофильного карбаниона:
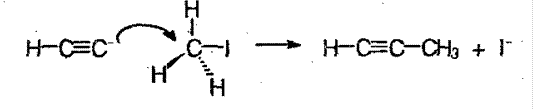
3. Крекинг метана и его гомологов:

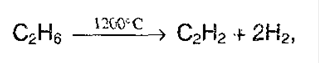
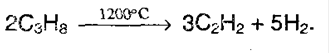
В лаборатории ацетилен получают:
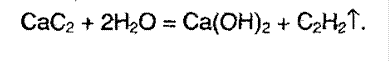
Применение алкинов.
На основе алкинов производят много различных соединений, имеющих широкое применение в промышленности. Например, получают изопрен – исходное соединения для производства изопренового каучука.
Ацетилен используют для сварки металлов, т.к. процесс его горения весьма экзотермичный.
Арены (ароматические углеводороды) – соединения, в молекулах которых содержится одно или несколько бензольных колей – циклических групп атомов углерода со специфическим характером связей.
Бензол – молекулярная формула С6Н6. Впервые была предложена А. Кекуле:
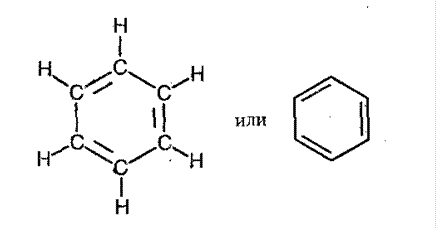
Строение аренов.
Все 6 атомов углерода находятся в sp2 -гибридизации. Каждый атом углерода образует 2 σ -связи с двумя соседними атомамиуглерода и одним атомом водорода, которые находятся в одной плоскости. Углы составляют 120°. Т.е. все атомы углерода лежат в одной плоскости и образуют шестигранник. У каждого атома есть негибридная р -обиталь, на которой находится неспаренный электрон. Эта орбиталь перпендикулярна плоскости, и поэтому π -электронное облако «размазано» по всем атомам углерода:

Все связи равноценны. Энергия сопряжения – количество энергии, которую надо затратить, чтобы разрушить ароматическую систему.
Именно это обуславливает специфические свойства бензола – проявление ароматичности. Это явление было открыто Хюккелем, и называется правилом Хюккеля.
Изомерия аренов.
Арены можно разделить на 2 группы:
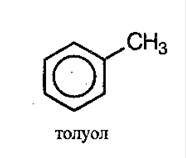

Общая формула аренов – СnH2n-6.
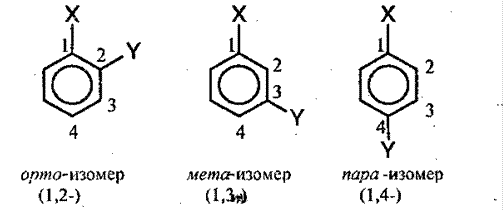
Для аренов характерна структурная изомерия, которая объясняется взаимным расположением заместителей в кольце. Если в кольце находится 2 заместителя, то они могут находиться в 3-х различных положениях – орто (о-), мета (м-), пара (п-):
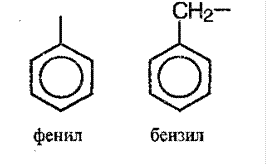
Если от бензола «отобрать» один протон, то образуется радикал - C6H 5, которое носит название арильного радикала. Простейшие:
|
|
Называют арены словом «бензол» с указанием заместителей в кольце и их положения:

Физические свойства аренов.
Первые члены ряда – жидкости без цвета с характерным запахом. Они хорошо растворяются в органических растворителях, но нерастворимы в воде. Бензол токсичен, но имеет приятный запах. Вызывает головную боль и головокружения, при вдыхании больших количеств паров можно потерять сознание. Раздражает слизистую оболочку и глаза.
Получение аренов.
1. Из алифатических углеводородов с помощью «ароматизации» предельных углеводородов, входящих в состав нефти. При пропускании над платиной или оксидом хрома наблюдается дигидроциклизация:

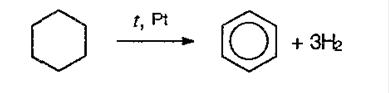
2. Дегидрирование циклоалканов:
3. Из ацетилена (тримеризация) при пропускании над раскаленным углем при 600°С:
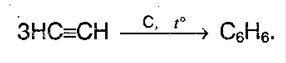
4. Реакция Фриделя – Крафтса в присутствии хлорида алюминия:
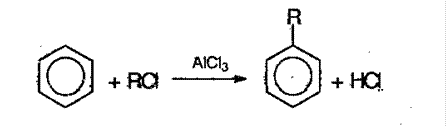
5. Сплавление солей ароматических кислот с щелочью:
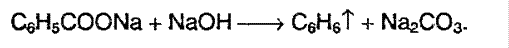
Химические свойства аренов.
Реакции замещения аренов.
Ядро аренов обладает подвижной π -системой, на которую действуют электрофильные реагенты. Для аренов характерно электрофильное замещение, которое можно представить так:
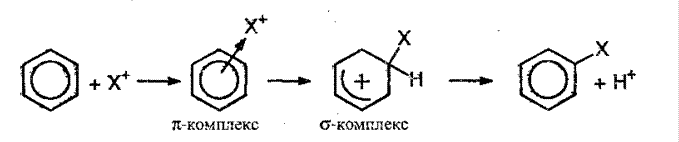
Электрофильная частица притягивается к π -системе кольца, затем образуется прочная связь между реагентом Х и одним из атомов углерода, при этом единство кольца нарушается. Для восстановления ароматичности выбрасывается протон, а 2 электрона С-Н переходят в π-систему кольца.
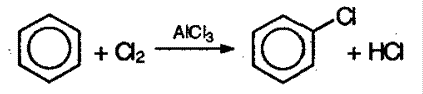
1. Галогенирование происходит в присутствии катализаторов – безводных хлоридов и бромидов алюминия, железа:
2. Нитрование аренов. Бензол очень медленно реагирует с концентрированной азотной кислотой при сильном нагревании. Но если добавить серную кислоту, то реакция протекает очень легко:
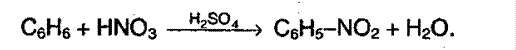
3. Сульфирование протекает под воздействием 100% - серной кислоты – олеума:
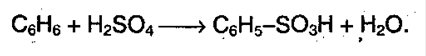
4. Алкилирование алкенами. В результате происходит удлинение цепи, реакция протекает в присутствии катализатора – хлорида алюминия:
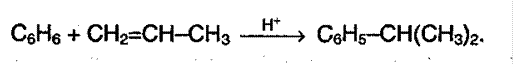
|
|
Состав природного газа
Природный газ на 98% состоит из метана СН4, свойства которого почти полностью определяют свойства и характеристики природного газа. Также в его составе присутствуют гомологи метана – пропан С3Н8, этан C2H6 и бутан С4Н10. Иногда природный газ может содержать сероводород, гелий и углекислый газ.
Метан (CH 4) – газ без цвета и запаха, легче воздуха. Метан горюч, но достаточно легко хранится. Чаще всего используется как горючее в промышленности и быту.
Этан (C 2 H 6) – газ, не обладающий цветом и запахом, слегка тяжелее воздуха. Горюч не менее, чем метан, но как топливо не применяется. Используется в основном для получения этилена, который является самым востребованным органическим веществом во всём мире. Это сырьё для производства полиэтилена.
Пропан (C 3 H 8) – тоже газ, не имеющий запаха и цвета, ядовит. Обладает полезным свойством: при небольшом давлении пропан сжижается, что значительно облегчает процесс отделения от примесей и его транспортировку. Сжиженным пропаном заправляются зажигалки.
Бутан (C 4 H 10) – очень схож по своим свойствам с пропаном, но обладает более высокой плотностью. Тяжелее воздуха в два раза. Пропан и бутан сегодня широко используются в качестве альтернативного топлива для автомобилей.
Источник: http://greenvolt.ru/bioenergetika/svojstva-i-xarakteristiki-prirodnogo-gaza/
Нефть представляет собой природную маслянистую, легковоспламеняющуюся жидкость с характерным запахом, от светло-желтого до коричнево-бурого и черного цвета (иногда встречается изумрудно-зеленая и даже практически бесцветная нефть).
Так как нефть является сложной смесью углеводородов и гетероатомных соединений, говорить о каких-либо константах для данной субстанции не представляется возможным. По этой же причине физические свойства нефти находятся в строгой зависимости от ее химического и фракционного составов. Кроме того, на свойства нефти могут оказывать влияние внешние факторы, такие, например, как условия хранения, неправильное соблюдение которых приводит к испарению легких фракций и т.п.
Тем не менее, нефть характеризуется определенным набором физических параметров, которые позволяют контролировать качество нефти, классифицировать нефть, оценивать ее стоиомость, а также рассчитывать и проектировать нефтепроводы, перерабатывающую и другую технологическую аппаратуру.
Стоит отметить, что физические свойства нефти, находящейся глубоко в пласте, значительно отличаются от свойств уже поднятой на поверхность и дегазированной нефти. Это объясняется влиянием на залегающую нефть давления, температуры, а также наличием растворенного газа. Физические характеристики пластовой нефти, в свою очередь, необходимо знать при расчете запасов нефти и газа, составлении технологических схем разработки месторождений и выборе метода извлечения нефти.
|
|
Основные физические свойства нефти это:
Строение алкадиенов.
π -электронные облака двойных связей перекрываются между собой, образуя единое π -облако. В сопряженной системе электроны делокализованы по всем атомам углерода:

Чем длиннее молекула, тем она более устойчива.
Изомерия алкадиенов.
Для диенов характерна изомерия углеродного скелета, изомерия положения двойных связей и пространстве
Важнейшие представители сопряженных диенов:
СН2 = СН-СН = СН2 СН2 = С (СН3)-СН = СН2.
бутадиен-1,3 изопреннная изомерия.
Физические свойства алкадиенов.
Бутадиен-1,3 – легко сжижающийся газ с неприятным запахом. А изопрен – жидкость.
Получение диенов.
1. Дегидрирование алканов:


2. Реакция Лебедева (одновременное дегидрирование и дегидратация):
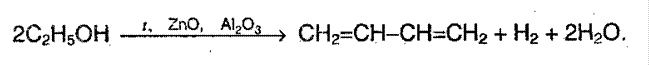
|
|
|

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!