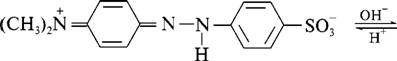Для фиксирования конца титрования используют визуальные (титрование с индикатором, цветным или флуоресцентным) и инструментальные методы (потенциометрическое, амперометрическое, фотометрическое титрование). Цветные индикаторы в кислотно-основном титровании – это слабые органические кислоты и основания, протонированные и непротонированные формы которых различаются по структуре и окраске. Существуют одноцветные (например, фенолфталеин) и двухцветные (например, метиловый оранжевый) индикаторы. Изменение окраски индикатора связано с таутомерией органических молекул, содержащих хромофор. Такие соединения обладают подвижными p-электронами, и в зависимости от распределения электронной плотности молекуле можно приписать несколько структур; предельные структуры называются таутомерами. На распределение электронной плотности влияет наличие ауксохромных групп. Ауксохромы связаны с ненасыщенным углеродным скелетом хромофора так, что положение двойных связей изменяется. Разность энергий основного и возбужденного (под действием света) состояний таких веществ мала, поэтому молекула поглощает свет в видимой части спектра, и вещество имеет определенную окраску. На рис. 5.4. показаны таутомерные переходы метилового оранжевого.
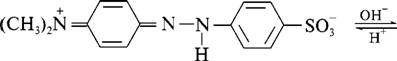

Рис. 4. Таутомерные переходы индикатора метилового оранжевого
Однако существуют соединения, не содержащие хромофоров, у которых под влиянием среды структура изменяется так, что появляются хромофорные группы. Таковы фталеины. Например, фенолфталеин в кислой среде бесцветен. В щелочной среде в результате перераспределения электронной плотности в его молекуле образуется хиноидная структура (хромофор), находящаяся в равновесии со своей таутомерией формой. Вещество приобретает красную окраску.
Группу индикаторов, схожую с фталеинами, составляют сульфофталеины: бромкрезоловый зеленый, феноловый красный, тимоловый синий и другие соединения. Например, в растворе фенолового красного в равновесии находятся красная и желтая формы.
Отдельную группу составляют трифенилметановые красители: кристаллический фиолетовый, метиловый фиолетовый, малахитовый зеленый и др.
По химической природе кислотно-основные индикаторы являются слабыми органическими кислотами или основаниями, частично диссоциирующими в растворе:
HInd ↔ H+ + Ind-,
где HInd – недиссоциированная молекула индикатора; Ind- – анион индикатора. Согласно теории ионных окрасок Оствальда, HInd и Ind- имеют разную окраску. Изменение цвета индикатора при изменении pH эта теория связывает со смещением равновесия диссоциации индикатора. С увеличением концентрации ионов водорода это равновесие смещается влево (в соответствии с принципом Ле Шателье), и раствор приобретает окраску HInd; при уменьшении кислотности возрастает концентрация Ind-, и окраска раствора изменяется. Равновесие диссоциации индикатора характеризуется константой диссоциации KHInd
KHind=[H]⋅[Ind][HInd]KHind=[H]⋅[Ind][HInd] (4.1)
Рассмотрим один из наиболее распространенных индикаторов – метиловый оранжевый. Кислая форма HInd у него имеет красный цвет, а основная Ind- – желтый. Из выражения (4.1) можно получить
KHInd/ [H+] = [Ind-]/ [HInd] (4.2)
Это соотношение показывает, что с увеличением концентрации ионов водорода дробь [Ind-]/[HInd] будет уменьшаться. Если кислотность раствора снижать, то отношение [Ind-]/[HInd] будет расти, и интенсивность желтой окраски увеличится. При логарифмировании (4.2) получаем
pH = pKHInd + lg [Ind- ]/ [HInd] (4.3)
Глаз человека способен установить появление окрашенных частиц, если их содержание будет примерно в 10 раз или более превышать концентрацию других окрашенных частиц в растворе. Это означает, что если отношение [Ind-]/[HInd] будет близко к значению 10/1 и больше, то цвет раствора на глаз будет восприниматься как цвет индикаторной формы Ind , а если отношение [Ind ]/[HInd] будет близко к 1/10 и меньше, то цвет раствора будет восприниматься как окраска индикаторной формы HInd. При выполнении условия 0,1 ≤ [Ind ]/[HInd] ≤ 10 наблюдается промежуточная окраска индикатора.
Интервал pH, в котором индикатор изменяет свою окраску, называется интервалом перехода индикатора.
Чтобы его найти, подставим предельные значения отношения [Ind ]/[HInd], равные 10 и 0,1, в уравнение (4.3)
ΔpH = pKHInd ± 1 (4.4)
Выражение (4.4) показывает, что интервал перехода индикатора составляет примерно две единицы pH. Область pH, в которой находится интервал перехода, определяется величиной pKHInd. Если pKHInd< 7, интервал перехода находится в кислой области; если pKHInd > 7 – в щелочной. Соотношение (4.4) является приближенным, так как оно не учитывает спектральную чувствительность глаза и разницу в интенсивности окраски кислотной и щелочной форм индикатора. Например, у метилового оранжевого pKHInd=3,36. Из формулы (4.4) следует, что изменение цвета метилового оранжевого будет происходить в области pH от 2,36 до 4,36. Экспериментально наблюдаемый интервал перехода этого индикатора лежит в области pH 3,1…4,4. В таблице 4.3 приведены параметры некоторых часто используемых кислотно-основных индикаторов.
Таблица 4.3. Кислотно-основные индикаторы
| Индикатор
| Интервал перехода pH
| pK HInd
| Изменение окраски
|
| Метиловый оранжевый
| 3,1…4,4
| 3,36
| Красная-желтая
|
| Фенолфталеин
| 8,2…9,8
| 9,53
| Бесцветная - красная
|
| Лакмус
| 5,0 …. 8,0
| 7,00
| Красный- синий
|
Кислотно-основные индикаторы изменяют свою окраску в области интервала перехода, независимо от того, достигнута или не достигнута точка эквивалентности.
Правильно выбранный индикатор изменяет окраску в области скачка титрования. Наблюдаемое при титровании резкое изменение цвета индикатора при добавлении лишь одной капли титранта связано с резким (в несколько единиц) изменением pH в области скачка. У неправильно выбранного индикатора изменение окраски может происходить задолго до наступления точки эквивалентности (в недотитрованных растворах) или после нее (в перетитрованных). При этом изменение цвета раствора не будет столь резким, как вблизи точки эквивалентности.
Выбирают индикатор с помощью кривой титрования. Для этого на график кривой титрования наносят интервал перехода индикатора. У правильно подобранного индикатора интервал перехода полностью или частично перекрывается скачком титрования. Если такого перекрывания нет, индикатор для данного титрования не подходит. Отличным индикатором для рассмотренного выше титрования сильной кислоты сильным основанием является лакмус, интервал перехода которого находится в середине скачка титрования (рис. 3.1). Фенолфталеин также может быть использован для данного титрования, так как его интервал перехода (8,2…9,8) захватывает область скачка титрования. Явно непригодным индикатором для титрования 0,1 М HCl раствором NaOH был бы, например, метиловый оранжевый (табл. 4.3).
Величину pH, при которой заканчивается титрование с данным индикатором, называют показателем титрования и обозначают pT. Показатель титрования находится близко к середине интервала перехода индикатора. У метилового оранжевого pT 4,0, у фенолфталеина 9,0 и т.д. Правило выбора индикатора можно сформулировать также, пользуясь понятием pT. Индикатор пригоден для данного титрования, если его pT лежит в пределах скачка титрования.
Примеры решения задач
Пример 1. Определить содержание хлороводорода в растворе, если на нейтрализацию 25 см3 раствора НСl, взятого пипеткой из мерной колбы ёмкостью 500,00 см3, расходуется 21,65 см3 0,0962 н раствора NaOH.
Решение.
1. определяем концентрацию раствора НСl:
N НСl ∙ V НСl= N NaOH ∙ V NaOH
N НСl = (0, 0962 ∙ 21.65)/25.00 = 0.0836 моль/л
2. Находим титр НСl:
Т НСl = (N НСl ∙ meqHCl) /1000 = (0.0836 ∙ 36.5)/1000 = 0.003051 г/см3
3. Вычисляем массу хлороводорода в растворе:
m НСl = TНСl ∙ V = 0.003051 ∙ 500 = 1.5257 г
Пример 2. Определить массовую долю гидроксида натрия в образце, если навеска технического едкого натра массой 0,1095 г растворена в воде и на титрование полученного раствора израсходовано 25,50 см3 0,1002 н раствора Н2SO4.
Решение.
- 1) Находим массу NaOH, находящуюся в приготовленном растворе:
- mNaOH = THSO4/NaOH ∙ VH2SO4 = (NH2SO4 ∙ meqNaOH ∙ V H2SO4)/ 1000 = (0.1002 ∙40.01 ∙25.50)/1000 = 0.1022 г
- ) Находим массовую долю гидроксида натрия в образце:
W = (mNaOH ∙ 100) / mнавески = (0,1022 ∙ 100)/0,1095 = 93,36 %.
Пример 3. Какую навеску технического NaOH, содержащего 40% примесей, необходимо взять для определения NaOH, если для определения полученного раствора израсходовано 30.00 см3 0,1000 н раствора HCl.
Решение.
1) Определяем массу NaOH, содержащуюся в навеске, взятой для анализа:
m NaOH = THCl/NaOH ∙ VHCl = (NHCl ∙ meqNaOH∙ VHCl)/1000 = (0.1000 ∙ 40.01∙30.00)/1000 = 0.1200 г
2) Находим массу навески технического NaOH:
mнавески = (m NaOH ∙ 100)/W NaOH) = (0.1200 ∙ 100)/40 = 0.3001 г
Задачи для самостоятельного решения
1) Нарисовать в общем виде кривую титрования угольной кислоты сильной щелочью (гидроксидом натрия) и обратный процесс – титрования карбоната натрия сильной кислотой (соляной). На что будет похожа кривая титрования в обоих случаях и как это можно объяснить?
2) Нарисовать кривую титрования гидроксида кальция (насыщенный раствор – «известковое молоко») сильной кислотой (соляной).