

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Дупликация генов – один из главных способов появления новых признаков. Ранее на отдельных примерах было показано, что эволюционная судьба паралогов (копий удвоившегося гена) может складываться по‑разному. Паралог может приобрести новую функцию, сохранить старую или специализироваться на одном из аспектов старой функции, разделив сферы действия с другими паралогами. Все это по‑разному сказывается на таких важных характеристиках организма (и отдельных его подсистем), как сложность и помехоустойчивость. Канадские генетики попробовали количественно оценить эволюционные последствия 56 генных дупликаций, произошедших у предков пекарских дрожжей. Для этого они изучили влияние каждой дупликации на систему взаимодействий между белками в клетке. Оказалось, что в 22 случаях дупликация повысила помехоустойчивость системы. Это проявляется в том, что при потере или поломке одного из паралогов его функции частично или полностью берет на себя другой, сохранившийся. Однако в 19 других случаях утрата одного паралога не только не компенсировалась, но и нарушила работу второго, сохранившегося паралога. Таким образом, исследование показало, что копии удвоившегося гена часто становятся взаимозависимыми, после чего одна из них уже не может нормально работать без второй. В результате система не только усложняется, но и становится менее надежной (более чувствительной к помехам).


Удвоение генов – один из главных источников эволюционных новшеств, потому что появившаяся в геноме «лишняя» копия гена на какое‑то время получает небывалую эволюционную свободу. Возникающие в ней мутации не подвергаются немедленной отбраковке, даже если нарушают исходную функцию белка, поскольку сохраняется вторая копия, по‑прежнему исправно выполняющая эту функцию.
|
|
Чаще всего одна из копий удвоившегося гена (такие копии, как мы помним, называют паралогами) просто деградирует под грузом мутаций, выходит из строя или вовсе утрачивается. Но существует и ряд более интересных сценариев, таких как неофункционализация (появление у одного из паралогов новой функции; см. Исследование № 16) и субфункционализация (когда паралоги делят между собой разные аспекты исходной функции).
С одной стороны, если функции паралогов остаются отчасти перекрывающимися, дублирующими друг друга, это повышает помехоустойчивость. Мутация, слегка нарушающая работу одного из паралогов, скорее всего, не принесет большого вреда, ведь второй паралог его «подстраховывает». С другой стороны, такие мутации и отбраковываться отбором будут менее эффективно, так что в долгосрочной перспективе по мере накопления мутаций в одном из паралогов (или в обоих) степень дублирования уменьшится. В итоге может произойти субфункционализация.
Субфункционализация может сопровождаться «бессмысленным», не приносящим пользы усложнением (см. Исследование № 18) и снижением помехоустойчивости. Почему так происходит? Допустим, некая функция ранее успешно выполнялась одним белком. Но вот произошла дупликация – и вместо одного белка появились два одинаковых паралога. После этого мутации могут испортить один из аспектов функциональности первого паралога. Эти мутации не будут отбракованы отбором, поскольку данную работу нормально выполняет второй паралог. Но и второй паралог, в свою очередь, может так же легко утратить какой‑то другой аспект своей функциональности, сохранившийся у первого паралога. В результате функция, которая отлично выполнялась у предков одним белком, у потомков будет с точно такой же эффективностью (то есть без всякого выигрыша) выполняться двумя белками. Система станет сложнее, хотя никакой пользы организму это не принесет.
|
|
Таким образом, судьба паралогов может складываться по‑разному. Возможные сценарии теоретически просчитаны и проиллюстрированы отдельными изученными примерами. Логичный следующий шаг – количественная оценка вероятности (частоты реализации) этих сценариев.
Именно это и попытались сделать канадские биологи (Diss et al., 2017). Их крайне трудоемкое исследование было выполнено на пекарских дрожжах (Saccharomyces cerevisiae). Ученые выбрали для анализа 112 белков, составляющих 56 паралогичных пар и выполняющих широкий круг функций. По каждому из этих белков удалось получить данные о взаимодействиях с другими белками. В среднем каждый из 112 белков взаимодействует примерно с двумя десятками других, то есть в общей сложности рассматривалось более 2000 попарных белок‑белковых взаимодействий.
Для выявления белок‑белковых взаимодействий у дрожжей ранее был разработан хитроумный метод. Главная идея состоит в сборке какого‑нибудь необходимого клетке белка (обозначим его Х) из двух половинок. Ген белка X из клеток предварительно удаляют. Затем этот ген разрезают на две части и присоединяют их к генам двух других белков, А и Б, про которые нужно выяснить, взаимодействуют они друг с другом или нет. Если белки А и Б взаимодействуют, то они должны хотя бы иногда сближаться – и тогда присоединенные к ним половинки белка Х получают возможность свернуться в функциональную молекулу. Этот номер пройдет не со всяким белком, но все же многие белки способны выполнять свою работу, даже если их части не соединены ковалентными связями, а только сближены в пространстве. Итак, если дрожжи с разделенными таким образом половинками белка Х живут и размножаются, значит, белки А и Б взаимодействуют друг с другом. Более того, по скорости размножения клеток можно судить о силе белок‑белкового взаимодействия. При помощи этого метода исследователи выясняли, как наличие или отсутствие одного паралога влияет на белок‑белковые взаимодействия, осуществляемые вторым. Здесь возможны три ситуации (рис. 17.1):
1) Отсутствие влияния. Это значит, что взаимодействие данного паралога с третьим белком не зависит от наличия или отсутствия в клетке второго паралога.
2) Компенсация. В этом случае удаление паралога, который в норме взаимодействует с третьим белком, приводит к тому, что сила взаимодействия оставшегося паралога с этим белком возрастает. Иными словами, второй паралог берет на себя функцию взаимодействия с третьим белком, компенсируя утрату первого паралога. Компенсация свидетельствует о том, что генная дупликация повысила устойчивость белок‑белкового взаимодействия. Теперь, чтобы его сильно нарушить, потребуется повреждение (например, мутационное) сразу обоих паралогов.
|
|
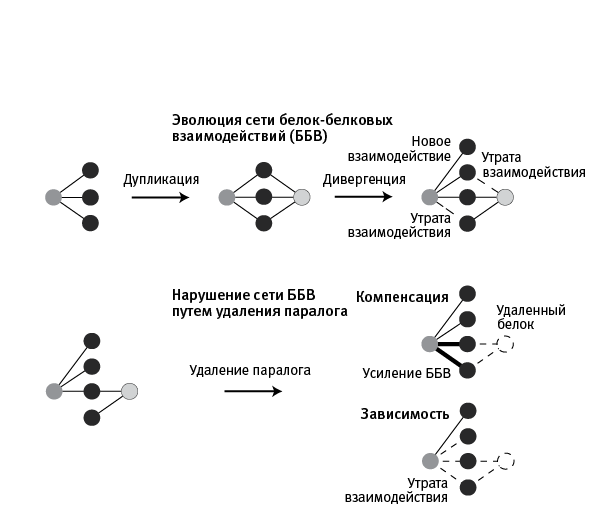
рис. 17.1. Изменение сети белок‑белковых взаимодействий при дупликации генов (вверху) и при удалении одного из паралогов (внизу). Темно‑серые и светло‑серые кружки – паралоги, возникшие в результате дупликации гена, кодирующего исходный белок (темно‑серый). Черные кружки – белки, с которыми взаимодействует исходный белок и его потомки, паралоги. Сразу после дупликации функции паралогов идентичны. Затем они начинают накапливать функциональные различия (происходит дивергенция). При этом могут приобретаться новые взаимодействия и утрачиваться старые. В итоге складывается новая сеть белок‑белковых взаимодействий, например такая, как слева внизу. Степень устойчивости этой сети может быть оценена в экспериментах по удалению одного из паралогов (здесь светло‑серого). В случае «компенсации» сохранившийся паралог берет на себя функции утраченного, что проявляется в усилении белок‑белковых взаимодействий. Получается, генная дупликация повысила устойчивость системы. В случае «зависимости» сохранившийся паралог не только не берет на себя чужие функции, но и частично утрачивает собственные. Стало быть, генная дупликация сделала систему более хрупкой (поскольку до дупликации для данного белок‑белкового взаимодействия достаточно было двух исправных белков, а теперь требуются три, причем поломка любого из них может нарушить взаимодействие). По рисунку из Diss et al., 2017.
3) Зависимость. Паралог, который в норме взаимодействует с третьим белком, теряет эту способность при удалении другого паралога. Это значит, что генная дупликация сделала белок‑белковое взаимодействие более хрупким, поскольку теперь повреждение любого паралога может его нарушить.
|
|
В ходе экспериментов выяснилось, что компенсация и зависимость возникают примерно с одинаковой частотой. Компенсация была обнаружена в 22 парах паралогов (из 56) и затрагивала в общей сложности 91 белок‑белковую связь (из примерно 2000 рассмотренных). Зависимость оказалась характерна для 19 пар паралогов и затрагивала 137 белок‑белковых взаимодействий. При этом компенсация и зависимость редко встречались вместе у одной и той же пары паралогов.
Ученые также заметили, что взаимное влияние паралогов в большинстве случаев асимметрично, то есть только один из двух способен компенсировать утрату другого (19 случаев из 22) или находится в зависимости от другого (14 случаев из 19).
На чем основан механизм компенсации? По идее, то, какой из двух паралогов будет взаимодействовать с третьим белком, может зависеть от количества (концентрации) каждого из паралогов, а также от их аффинности, то есть, грубо говоря, от прочности связывания с этим белком. Дополнительные эксперименты показали, что компенсирующий эффект чаще всего обусловлен различиями в аффинности. В нормальной ситуации с третьим белком связывается тот из паралогов, который лучше умеет это делать. Но если высокоаффинный паралог удалить, то второй, избавившись от конкуренции со стороны более «умелого» партнера, начинает выполнять его работу.
А механизм зависимости, как выяснилось, преимущественно связан с тем, что два паралога объединяются в комплекс – гетеромер, причем один из паралогов стабилизирует другой и помогает ему выполнять его работу. Дополнительные эксперименты на других парах паралогов у дрожжей, а также на культурах человеческих клеток показали, что зависимость одного паралога от другого действительно чаще всего встречается в случае образования гетеромеров.
Анализ данных по белок‑белковым взаимодействиям у разных эукариот продемонстрировал, что паралоги, объединяющиеся в гетеромеры, – довольно частое явление. У разных видов эукариот от 6 до 27 % всех пар паралогов образуют гетеромеры. Почему же белки, возникшие из одного предкового белка в результате генной дупликации, объединяются друг с другом, образуя гетеромеры? По‑видимому, часто это происходит оттого, что удваивается белок, уже исходно образовывавший комплексы из двух одинаковых белковых молекул – гомомеры. Типичный сценарий развития зависимости может быть следующим.
Предковый белок образует гомомеры – и в таком виде осуществляет взаимодействие с другими белками. После дупликации в одном из паралогов накапливаются мутации, мешающие ему образовывать гомомеры, но не мешающие связываться с другим паралогом. У второго паралога в этом случае могут закрепиться мутации, помогающие связываться с «подпорченным» партнером. Так появляются гетеромеры – комплексы из двух различающихся паралогов, один из которых (а иногда и оба) уже не способен образовывать гомомеры. Гетеромер взаимодействует с другими белками так же, как это делал раньше гомомер исходного, еще не удвоившегося белка. В итоге получается, что после дупликации сложность молекулярной организации возрастает (то, что раньше делали белковые молекулы одного типа, теперь делают совместными усилиями белковые молекулы двух разных типов), хотя очевидной пользы организму это не приносит, а помехоустойчивость межбелковых взаимодействий снижается.
|
|
Данный механизм формирования зависимости одного паралога от другого очень похож на «бессмысленное усложнение» (см. Исследование № 18). По‑видимому, такое не приносящее пользы усложнение, обусловленное разнонаправленной мутационной деградацией паралогов с последующей компенсаторной «подгонкой» их друг к другу, является важной эволюционной закономерностью, которая, возможно, в какой‑то степени объясняет прогрессирующий рост сложности в некоторых эволюционных линиях.
Не исключено, что наличие партнера‑помощника, компенсирующего дефекты зависимого паралога, дает последнему дополнительную эволюционную свободу. В принципе, это может способствовать приобретению зависимым паралогом новых функций. Таким образом, в отдаленной перспективе «бессмысленное усложнение» может открывать перед организмами новые эволюционные горизонты. Насколько часто эти возможности реализуются, покажут дальнейшие исследования.
Исследование № 18
Бессмысленное усложнение
Данное исследование, на наш взгляд, имеет большое мировоззренческое значение. Оно наглядно показывает, как в ходе эволюции сложное может развиться из простого совершенно случайно и без всякой пользы. Организм усложняется, не получая от этого никакой выгоды: эффективность выполнения всех функций остается на прежнем уровне. Этот пример, добавляя конкретики описанным выше оценкам последствий генных дупликаций (см. Исследование № 17), еще раз подчеркивает «недальновидность» естественного отбора, его работу только «здесь и сейчас». С помощью генно‑инженерных экспериментов американские биологи расшифровали последовательность событий, в результате которых у предков пекарских дрожжей ( Saccharomyces cerevisiae ) усложнилась одна из регуляторных систем. Предковый ген удвоился, и в каждой из двух копий стали накапливаться свои мутации. В итоге каждая копия утратила ту или иную часть исходных функций. Функции, утраченные каждой из копий, были разными, благодаря чему копии перестали быть избыточными – теперь оба гена, по‑разному подпорченные мутациями, стали жизненно необходимы организму. Дальнейшая специализация двух генов подстегивалась тем, что поначалу они конкурировали, мешая друг другу работать. Минимизация конкуренции потребовала закрепления дополнительных мутаций. В конце концов система усложнилась (два специализированных гена вместо одного многофункционального), хотя сами дрожжи ничего от этого не выиграли. Усложнение стало побочным эффектом цепочки отчасти случайных, отчасти закономерных событий, начало которым положило случайное удвоение гена.


Данное исследование было выполнено биологами из Калифорнийского университета в Сан‑Франциско (США) в 2013 году (Baker et al., 2013). Работа пролила свет на процесс появления эволюционных новшеств в результате генных дупликаций – на два важных его аспекта.
Во‑первых, она показала, что генные дупликации могут чисто автоматически, через ряд взаимообусловленных промежуточных шагов, приводить к усложнению регуляторных генных сетей. Это происходит даже в том случае, если в подобном усложнении нет необходимости и организм мог бы продолжать с тем же успехом обходиться простой регуляторной сетью.
Во‑вторых, работа показала, что копиям удвоившегося гена (паралогам) не всегда удается легко и быстро разделить функции, особенно если ген включен в сложную сеть межмолекулярных взаимодействий. В этом случае копии, едва начав делить функции, начинают конкурировать и мешать друг другу работать. Для устранения этой проблемы требуется закрепление дополнительных мутаций, что способствует окончательному превращению паралогов в два специализированных белка со строгим разделением обязанностей.
Авторы изучили последствия дупликации гена Mcm 1 у дрожжей. Этот ген есть у всех грибов. Он кодирует важный регуляторный белок, который, объединяясь в комплексы с другими регуляторными белками (кофакторами), присоединяется к ДНК, чтобы активировать близлежащие гены (рис. 18.1). Mcm 1 в целом консервативен, хотя и имеет некоторые различия у разных видов.
У некоторых дрожжей, например Kluyveromyces lactis, гены метаболизма аргинина (ARG) регулируются комплексом из двух белковых молекул Mcm1 (такие комплексы называют гомодимерами), который, в свою очередь, соединяется с кофактором Arg81 (рис. 18.1, а). У пекарских дрожжей, Saccharomyces cerevisiae, и их ближайшей родни белковый комплекс, регулирующий работу генов ARG, устроен сложнее. Он включает не два, а три разных белка. Вместо гомодимера из двух молекул Mcm1 пекарские дрожжи используют гетеродимер – соединенные молекулы белков Mcm1 и Arg80 (рис. 18.1, б), и уже этот гетеродимер соединяется с Arg81.
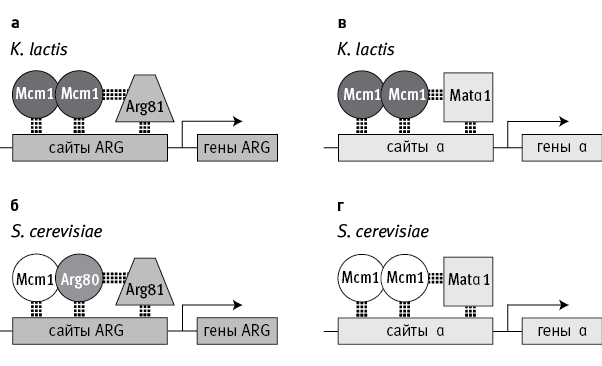
рис. 18.1. Схема регуляции работы генов, связанных с метаболизмом аргинина (гены ARG) и с половым размножением (гены α), у дрожжей Kluyveromyces lactis и Saccharomyces cerevisiae. Комплексы белков‑регуляторов присоединяются к регуляторным участкам ДНК (сайты ARG, сайты α) возле контролируемых генов. У K. lactis обе группы генов (ARG и α) регулируются гомодимерами – комплексами из двух молекул белка Mcm1 (а, в). У S. cerevisiae гены α регулируются такими же гомодимерами (г), а для регуляции генов ARG используется гетеродимер, состоящий из Mcm1 и дополнительного регуляторного белка Arg80, которого нет у K. lactis (б). Ген Arg80 появился у предков S. cerevisiae в результате дупликации исходного гена Mcm1 и последующего разделения функций. Arg81 и Matα1 – кофакторы. По рисунку из Baker et al., 2013.
Другая группа генов (гены α, отвечающие за «половые признаки» дрожжей, относящихся к полу α; см. Исследование № 7 и рис. 7.1) у всех дрожжей регулируется одинаково – при помощи гомодимера Mcm1 в комплексе с кофактором Matα1 (рис. 18.1, в, г).
Таким образом, у S. cerevisiae гены α регулируются так же, как у других дрожжей, а гены ARG – более сложным способом, с участием дополнительного белка Arg80, которого у сородичей нет. Исследователи задались целью разобраться в причинах этого различия.
Сравнение последовательностей рассматриваемых генов у разных видов дрожжей показало, что Arg 80 произошел от Mcm 1 в результате генной дупликации. У предков S. cerevisiae исходный ген, кодировавший белок Mcm1, подвергся удвоению. После этого в двух копиях закрепились разные мутации. Одна из копий (это Mcm 1 пекарских дрожжей) изменилась несущественно и сохранила большую часть исходных регуляторных функций, а другая (Arg 80) изменилась сильнее и специализировалась на регуляции генов ARG.
На основе аминокислотных последовательностей белков Mcm1/Arg80 всех видов дрожжей, у которых эти последовательности известны, исследователи построили эволюционное дерево, а также реконструировали аминокислотные последовательности трех предковых белков, занимающих на дереве ключевые позиции (рис. 18.2).
Первый из «воскрешенных» белков получил название AncMADS (Anc – от слова ancestor («предок»), MADS – обширная группа регуляторных белков, к которой относится в том числе и Mcm1). AncMADS – это тот белок, ген которого подвергся дупликации у общего предка пекарских дрожжей и их ближайшей родни. Второй реконструированный белок, AncMcm1, – это исходный вариант белка Mcm1 пекарских дрожжей и их родни, то есть одного из двух паралогов, сформировавшихся после дупликации и разделения функций. Наконец, AncArg80 – это исходный вариант второго паралога, белка Arg80.
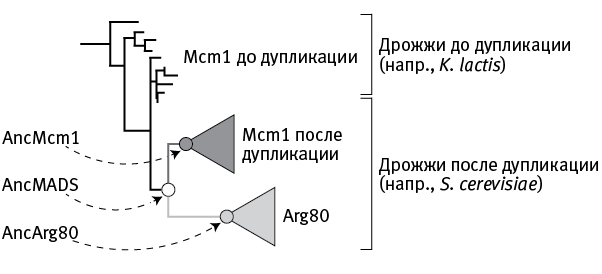
рис. 18.2. Эволюционное дерево белков Mcm1/Arg80. Кружками показано положение трех реконструированных предковых белков. По рисунку из Baker et al., 2013.
Исследователи синтезировали гены реконструированных предковых белков и внедрили их в клетки пекарских дрожжей, у которых их собственные гены Mcm 1 и Arg 80 были предварительно отключены. Утрата белка Mcm1 смертельна для дрожжей при любых обстоятельствах, а без Arg80 у них нарушается метаболизм аргинина, что критично в среде, где аргинин (или его предшественник орнитин) служит единственным источником азота.
Оказалось, что исходная (до дупликации) версия предкового белка AncMADS прекрасно справляется с работой обоих современных белков Mcm1 и Arg80. То есть в опыте дрожжи, лишенные одного из этих белков или обоих сразу, выживают и нормально размножаются, если в их геном вставлен ген белка AncMADS.
Предковый белок AncMcm1 успешно заменяет современный Mcm1, но не может возместить утрату Arg80. Аналогичным образом предковый белок AncArg80 компенсирует потерю Arg80, но не спасает дрожжи, лишенные Mcm1.
Эти результаты (а также другие экспериментальные данные, но о них мы умолчим, чтобы не пришлось добавлять к этой главе четвертый значок «мозг») показали, что вскоре после дупликации две копии исходного гена, кодирующего белок AncMADS, накопили мутации, которые привели к частичной потере функциональности паралогичными белками. Один из них (AncMcm1) утратил способность соединяться с кофактором Arg81, а другой (AncArg80) разучился связываться с кофактором Matα1 (рис. 18.3).
Удалось найти и конкретные аминокислотные замены, изменившие структуру «кофактор‑связывающего кармана» белковой молекулы, что и привело к частичной утрате функциональности. AncMcm1 потерял способность взаимодействовать с Arg81 из‑за одной замены, которая была унаследована всеми современными вариантами белка Mcm1 «постдупликационных» дрожжей (то есть пекарских и их ближайшей родни). AncArg80 лишился способности взаимодействовать с Matα1 из‑за трех других аминокислотных замен (которые тоже передались современным потомкам этого белка).

рис. 18.3. Частичная утрата функциональности паралогичными белками (у пекарских дрожжей). По рисунку из Baker et al., 2013.
Эти результаты показывают, что разделение функций между паралогами было основано на субфункционализации, то есть частичной утрате разных аспектов исходной функции двумя копиями удвоившегося гена. Многие теоретики и раньше считали такой сценарий разделения функций наиболее вероятным.
Сразу после удвоения гена мутация в одной из его копий не приносит вреда и не отсеивается отбором, даже если нарушает функциональность, – ведь остается вторая копия, успешно справляющаяся с той работой, которую больше не может выполнять первая. Но как только одна из копий утратит какую‑то функцию, отбор уже не допустит подобной потери второй копией, ведь организму необходима хоть одна работающая версия гена. Что, впрочем, не мешает второй копии потерять другую функцию, пока еще сохранившуюся у первой. Если это произойдет, копии перестанут быть «избыточными». Теперь ни одна из них не может быть утрачена без резкого снижения приспособленности (а значит, отбор не позволит им потеряться). В итоге вместо одного «неразборчивого», многофункционального белка организм получает два специализированных.
Самое интересное, что такое усложнение молекулярной организации вовсе не обязано быть «полезным», то есть повышать приспособленность организма. Вполне возможно, что после дупликации и разделения функций организм будет чувствовать себя ничуть не лучше, чем до этих событий. Например, в описанных экспериментах дрожжи, у которых специализированные белки Mcm1 и Arg80 были заменены на предковый универсальный AncMADS, росли не хуже обычных. В отдаленной перспективе дупликация и субфункционализация могут открыть новые эволюционные возможности, ведь две копии исходного гена (и их функции) теперь имеют право эволюционировать более или менее независимо. Но естественный отбор ничего не знает об отдаленных перспективах, он ориентируется только на «здесь и сейчас». Усложнение молекулярной организации в данном сценарии – лишь побочное (хотя и закономерное) следствие случайного удвоения гена.
Не остановившись на достигнутом, ученые решили проверить гипотезу, согласно которой после удвоения многофункциональных белков, таких как AncMADS, вовлеченных к тому же в сложную сеть взаимодействий с другими белками, возникшие паралоги могут конфликтовать и мешать друг другу работать. Например, новообразовавшийся паралог AncArg80, разучившийся взаимодействовать с кофактором Matα1, мог бы по ошибке присоединяться к регуляторной области генов α, занимая то место на ДНК, куда должен прикрепляться другой паралог, AncMcm1. В результате регуляция генов α оказалась бы нарушена. Если такой конфликт между паралогами действительно когда‑то существовал, то в дальнейшем отбор должен был поддержать и закрепить мутации, снижающие его остроту.
В поисках подобных мутаций исследователи обратили внимание на ту часть молекулы AncArg80, которая отвечает за присоединение белка к ДНК. Здесь обнаружилось пять аминокислотных замен, делающих связь белка с ДНК менее прочной. Может быть, именно благодаря этим заменам белок AncMcm1 и его потомки, сохранившие способность крепко цепляться за ДНК, и одерживают верх над Arg80 в конкуренции за право присоединиться к регуляторной области генов α? Чтобы проверить эту смелую гипотезу, ученые сконструировали версию AncArg80, лишенную вышеупомянутых пяти замен в ДНК‑связывающей области. Ген этого белка внедрили в геном дрожжей вместо изъятого оттуда гена Arg 80. Результат подтвердил ожидания исследователей: у модифицированных дрожжей регуляция генов α оказалась полностью нарушена. Когда пять мутаций вернули на место, гены α снова заработали нормально.
Следовательно, адаптивный смысл пяти замен, ослабивших связь Arg80 с ДНК, скорее всего, действительно состоял в том, чтобы сгладить конфликт между паралогами. Благодаря этим заменам Arg80 не лезет не в свое дело и не мешает другому паралогу, Mcm1, регулировать работу генов α. Можно сказать, что закрепление этих пяти замен окончательно превратило копии удвоившегося AncMADS в два разных белка. Приняв такую формулировку, согласимся с авторами, полагающими, что в данном случае конфликт между паралогами способствовал усложнению системы генной регуляции (усложнение, напомним, состояло в том, что гены ARG, для управления которыми ранее хватало двух белков‑регуляторов, теперь стали контролироваться тремя).
Кроме того, ослабление связи Arg80 с ДНК объясняет, почему гены ARG регулируются гетеродимером Mcm1+Arg80, а не гомодимером Arg80+Arg80. По‑видимому, белок Mcm1 просто‑напросто помогает Arg80 удерживаться на ДНК (на регуляторных участках генов ARG). Что мешает гомодимерам Mcm1+Mcm1 присоединяться к этим участкам, конкурируя с гетеродимерами и нарушая работу генов ARG, – пока неясно.
По мнению исследователей, конфликты между паралогами могут быть важным фактором, направляющим процесс формирования эволюционных новшеств путем дупликации генов.
Исследование № 19
|
|
|

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!