Биологическая роль.
1.
Входят в состав в мембран, участвуя в их избирательной проницаемости.
2.
Дипальмитоилфосфатидилхолин (до 80%), является компонентом сурфактанта, выстилающего альвеолы легких и препятствующей слипанию стенок альвеол во время вдоха.
3.
Фосфатидилэтаноламин и фосфатидилхолин мембран взаимодействует с ферментами, образуя комплексы, которые активируют факторы свертывания крови. Фосфатидилсерин активирует процессы фибринолиза, связываясь с другими ферментами.
4.
Обладают липотропным действием, препятствуя отложению нейтрального жира в печени.
5.
Продукты их распада участвуют в патогенезе бронхиальной астмы, атеросклероза.
6.
Фосфатидилсерин влияет на освобождение гистамина.
Жировое перерождение (инфильтрация) печени.
Гепатоциты переполняются нейтральным жиром (ТАГ), разрушаются, образуются кисты, вокруг них разрастается соединительная ткань, развивается жировая дистрофия. Эта патология возникает вследствие нарушения синтеза фосфолипидов, связанный с недостатком липотропных фактров: метионина, полиеновых ненасыщенных жирных кислот, холина, В12, В15, фолиевой кислоты, липокаина (вырабатывается в ПЖЖ), поступающей только в составе пищи.
ФЛ входят в состав ЛПОНП, которые транспортируют эндогенные ТАГ из печени тканям. Следовательно, нарушение образования ЛПОНП приводит к нарушению их выведения и накопления в печени.
 4.8. Схема распада фосфолипидов мембран. Образование эйкозаноидов из арахидоновой кислоты: простагландинов, лейкотриенов, тромбоксанов, простациклинов. Роль в норме и патологии (атеросклероз, бронхиальная астма, ревматоидный артрит).
4.8. Схема распада фосфолипидов мембран. Образование эйкозаноидов из арахидоновой кислоты: простагландинов, лейкотриенов, тромбоксанов, простациклинов. Роль в норме и патологии (атеросклероз, бронхиальная астма, ревматоидный артрит).
От фосфолипидов мембран под действием фосфолипазы А2, отщепляется арахидоновая кислота, которая используется для синтеза эйкозаноидов (напомнить о строении). Активация фосфолипаз происходит под действием различных факторов: гормонов, гистамина, цитокинов, в условиях гипоксии, иммунных воздействий и др.
В клетках имеется 2 основных пути превращения арахидоновой кислоты:
1 – циклооксигеназный, приводящий к синтезу простагландинов – предшественников тромбоксанов и простациклинов;
2 – липооксигеназный, заканчивающийся образованием лейкотриенов.
Простагландины
1.
Влияют на сокращение гладких мышц.
2.
Способствуют секреторной функции желудка.
3.
Участвуют в воспалительных реакциях.
4.
Модулируют действие гормонов.
5.
Влияют на гемодинамику почек.
6.
Автономно регулируют нервное возбуждение.
Простациклины – образуются в стенках кровеносных сосудов сердца, матки, слизистых желудка.
Расслабляют гладкую мускулатуру
Способствуют фибринолизу, и тем самым препятствует свертыванию крови.
Тромбоксаны являются антагонистами простациклинов, образуются в тромбоцитах, в мозге, способствуют свертыванию крови
1.
вызывая агрегацию тромбоцитов
2.
оказывают сосудосуживающее действие.
Накопление служит причиной тромбоза, атеросклероза
Лейкотриены в лейкоцитах, макрофагах.
1.
Вызывают сокращение гладких мышц дыхательных путей
2.
Стимулируют секрецию гликопротеинов, увеличивают количество слизи в дыхательных путях
3.
Участвуют в аллергических и иммунологических реакциях.
4.
Повышают проницаемость сосудов..
5.
Затрудненное дыхание при бронхиальной астме связано с действием лейкотриенов. Ревматоидные артриты также обусловлены действием лейкотриенов.
10.8.Холестерол, строение, биологическая роль. Поступление и выведение из организма. Последовательность реакций синтеза холестерола до мевалоновой кислоты. Пути превращения холестерола в организме: окисление, эстерификация, дегидрирование. Возрастные особенности содержания холестерина у детей.
Холестерол – стероид, характерный только для животных организмов. 50% синтезируется в печени, 15-20% в тонком кишечнике, остальной – в коже, коре надпочечников, половых железах. В сутки синтезируется 1г холестерола. С пищей поступает 300-500мг.
N в крови = 3,9-5,2 ммоль/л
У новорожденных ХС – 1,3-2,6 ммоль/л
В 12-14 лет – достигает нормы.
Биологическая роль.
1.
Входит в состав клеточных мембран, влияя на их свойства.
2.
Субстрат для синтеза желчных кислот, стероидных гормонов, витамин Д3.
3.
Поддерживает тургор кожи.
Реакция синтеза ХС происходит в цитолизе клеток, это один из самых длинных метаболических путей в организме человека, включает около 100 последовательных реакций.

1.
Основной путь превращения ХС – это его окисление. 80% от всего количества окисляется в печени в желчные кислоты, 3% в стероидные гормоны. При реакциях окисления в молекуле ХС появляются полярные группы, гидроксилы, карбоксилы, повышается его растворимость в воде, что способствует выведению из организма.
2.
Второй путь превращения ХС в организме – это образование эфиров ХС (эстерификация). Эфиры ХС составляют около 10% от общего количества ХС в организме. При этом растворимость уменьшается и это приводит к накоплению в организме. У новорожденных относительно низкий коэффициент эстерификации по сравнению с более старшим возрастом детей = 0,58-1 ммоль/л, что связано с дефицитом полиненасыщенных жирных кислот.
3.
Дегидрирование. В положении 7, 8 образуются двойные связи, что приводит к образованию 7-дегидрохолестерола (предшественника витамина Д3)
Выведение холестерола.
Чтобы поддерживать постоянный уровень его в организме необходимо выводить 1,5г в сутки. 1г в сутки окисляется в желчные кислоты, 200-300мг в сутки с калом в виде копростанола, 100мг со слущенным эпителием, 40 мг идет на синтез стероидных гормонов, с мочой 1-2мг в сутки.
11.8.ЛПНП и ЛПВП – транспортные формы холестерола в крови. Регуляция метаболизма холестерола. Биохимические основы гиперхолестеролемии (атеросклероз, желчнокаменная болезнь
Ключевую роль в регуляции метаболизма холестерина играют рецепторы ЛПНП. Впервые эти рецепторы были обнаружены на клетках кожи человека учеными Браун и Гольштейн в 1973г в Далласе (Техасском медицинском центре). За это открытие они получили нобелевскую премию по медицине в 1985г.
ЛПНП поставляют холестерин в различные клетки. Рецепторы, связывая белково-липидные комплексы ЛПНП не только обеспечивают клетки холестерином, но и снижают уровень ЛПНП в крови. Ясно, чем больше рецепторов ЛПН на поверхности клетки и чем эффективнее они взаимодействуют с ЛПН, тем быстрее холестерин удаляется из крови.
Происходит это в следующие этапы:
Рецепторы (по химической природе – гликопротеины) на плазматической мембране клеток узнают те ЛП, в состав которых входит апопротеин В-100 и связывается с ними.
Комплекс рецептор-ЛПНП проникает в клетку путем эндоцитоза, образуя пузырек-эндосому.
Эндосомы сливаются с лизосомами. Под действием ферментов лизосом белковая часть расщепляется до свободных аминокислот. Эфиры холестерина расщепляются кислой липазой до св. ХС. Накапливающийся в клетках ХС оказывает тройное действие на метаболизм.
1. Тормозит синтез ХС самой клеткой, ингибируя по механизму обратной связи фермент ОмГ-редуктазу.
2. Индуцирует процесс образования эфиров ХС в цитоплазме клетки (активирует ЛХАТ) лецитинацетилхолестеролтрансфераза.
3. Избыток ХС по принципу обратной связи подавляет образование новых рецепторов ЛПНП. В результате количество рецепторов уменьшается и клетка начинает связывать меньше ЛПНП.
В регуляции синтеза рецепторов ЛПНП участвуют: инсулин, Т3, половые гормоны, которые увеличивают их количество, а глюкагон подавляет.
Эффекты инсулина и Т3 могут объяснить механизм гиперхолестеринемии, риск атеросклероза при сахарном диабете или при гипотиреозе.
Гиперхолестеринемия – повышение уровня ХС в крови при норме 3,9-5,2 ммоль/л. Факторы риска:
1.
Гиперкалорийное питание (избыточное поступление углеводов, жиров)
2.
Гиподинамия
3.
Курение
4.
Сопутствующие заболевания (гипертоническая болезнь, сахарный диабет, гипотиреоз, ожирение)
5.
Стресс (адреналин приведет к синтезу ацетилКоа → ХС).
Атеросклероз.
Заболевание, связанное с накоплением холестерола и его эфиров, в ЛПНП, в эндотелии сосудов.
Рассмотрим развитие атеросклеротической бляшки в клетках эндотелия кровеносных сосудов.
В области бляшки часто образуются тромбы, суживающие просвет сосуда, что приводит к острому нарушению кровообращения и развитию инфаркта миокарда, инсульта.
Желчнокаменная болезнь.
Патологический процесс, при котором в желчном пузыре образуются камни, основу которых составляет ХС. Выделения ХС в желчь должно сопровождаться пропорциональным выделением желчных кислот и ФЛ, удерживающих гидрофобные молекулы ХС в желчи в мицеллярном состоянии. Если эти пропорции нарушены, то ХС начинает осаждаться в желчном пузыре, образуя вязкий осадок, который постепенно становится твердым. Камни могут состоять не только из холестерола (белого цвета), но и из смеси ХС, билирубина, белков, кальция – смешанные (коричневого цвета).
Причины: гиперкалорийное питание, избыток ХС в пище, застой желчи, нарушение энтерогепатической циркуляции желчных кислот, а также их синтеза, инфекции желчного пузыря.
9.8.Пути метаболизма ацетил-КоА в клетке. Кетоновые тела. Механизм биосинтеза. Биологическая роль. Причины и последствия возникновения кетонемии и кетонурии у детей.
К кетоновым телам относятся:
Ацетоуксусная кислота
β оксимасляная (β окси-бутират)
Ацетон
В норме 0,9-1,7 ммоль/л (1-3 мг/дл)
Функции кетоновых тел:
Источник энергии (ацетоацетат 33 АТФ, β окси-бутират 21 АТФ).
Регуляторная (регулирует скорость липолиза в жировых клетках). Образование кетоновых тел идет в печени. Из печени они поступают в периферические ткани: скелетные мышцы сердца. Мозг потребляет кетоновые тела только при недостатке глюкозы. В периферических тканях кетоновые тела окисляются с образованием энергии. У детей они служат дополнительным энергетическим материалом в период активного роста.
Но часто из-за несовершенства регуляции обменных процессов, диетических ошибок (кетогенная пища), переутомления могут привести к накоплению большого количества кетоновых тел 20-30 ммоль/л (при Ν – 1,7 ммоль/л). При этом возникает ацидоз на ранней стадии, кетоз – поздней. Понижается рН крови, ацетонемическая рвота, запах ацетона при дыхании. Об этой – детской патологии должно быть известно каждому педиатру. Развитие этого состояния может перейти в кому и вызвать смерть. Кетоз может возникнуть при сахарном диабете, при голодании, при беременности, при токсикозе.

7.8. Классификация высших жирных кислот. Биологическая роль. ω-3 и ω-6 кислоты-незаменимые компоненты пищи. Биосинтез жирных кислот (липогенез), основные стадии процесса, особенности. Регуляция
Жирные кислоты – это соединения с длинной цепью углеродных атомов имеют на одном конце СООН. В организме находится более 70 ж.к. Наиболее часто встречаются ж.к. с 16, 18, 20 углеродными атомами.
Жирные кислоты могут быть предельные – 25% в организме и непредельные (ненасыщенные) 75%.
Атомы углерода нумеруются, начиная с карбоксильной группы,
ω 3 2 1
СН3…….СН2 – СН2 – СООН
а углерод концевой метильной группы – ω (омега) углерод.
Для указания = связей, их положения, было принято такое обозначение:
∆ 9 это значит, что двойная связь находится между 9 и 10 атомами углерода,
ω – 3 это значит, что двойная связь между 3 и 4 атомами углерода, если их отсчитывать с ω(омега) конца.
ω – 3, ω – 6, ω – 9 жирные кислоты семейства животного происхождения.
Роль полиеновых ВЖК.
1.
Повышают растворимость ХС (активируют превращения ХС в желчные кислоты, копростанол).
2.
Обеспечивают нормальное состояние кровеносных сосудов (способствуют образованию большого количества простациклинов).
3.
Эйконол, полученный из ткани морских рыб, содержащих тимнодоновую и докозогексановую кислоты – препарат для лечения атеросклероза.
4.
Стимулируют иммунитет (повышают устойчивость к инфекционным заболеваниям, рентгеновскому облучению).
Особенности:
1.
Протекает в цитоплазме.
2.
У человека происходит синтез только пальмитиновой кислоты.
3.
Принимает участие АПБ – полиферментный комплекс, состоящий из 6 ферментов.
4.
Необходимо участие реакций карбоксилирования, СО2, АТФ, НАДФ∙Н2.
Удлинение пальмитиновой кислоты происходит с участием ацетил-КоА, с образованием стеариновой кислоты. В печени и в тканях мозга из стеариновой кислоты образуются ВЖК с длинной углеродной цепью от С20 до С24, необходимых для образования глико- и сфинголипидов. Из ненасыщенных жирных кислот в организме синтезируется только олеиновая в результате дегидрирования стеариновой кислоты (десатурация) – под влиянием ферментов десатураз, которые могут образовывать двойные связи только у 9 углеродного атома, ω-3 и ω-6 не синтезируются в организме и обязательно должны поступать с пищей.

 8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. процессов. Ожирение, причины.
8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. процессов. Ожирение, причины.
Ожирение – полигенное заболевание, сопровождающееся накопление ТАГ в адипоцитах, которое является фактором риска развития инфаркта миокарда, инсульта, СД, гипертонической и желчнокаменной болезни.
Ожирение бывает:
1.
первичное – оно развивается в результате алиментарного дисбаланса – избыточное калорийное питание по сравнению с расходованием энергии.
Причины: - генетические нарушения до 80%
- состав и количество потребляемой пищи
- система питания в семье
- уровень физической активности
- психологические факторы
Рассмотрим генетические факторы в развитии ожирения. Метаболические различия между тучными и худыми людьми. У людей, склонных к ожирению, вероятно, имеется более прочное сопряжение дыхания и окислительного фосфорилирования, т.е. более эффективный метаболизм. Возможно разное соотношение аэробного и анаэробного гликолиза. Анаэробный гликолиз (как менее эффективный) «сжигает» гораздо больше глюкозы, в результате снижается переработка в жиры.
У человека обнаружен ген ожирения. Продуктом экспрессии этого гена служит белок лептин, который содержит 167 аминокислотных остатков, взаимодействует с рецептором гипоталамуса, в результате снижается секреция нейропептида У, стимулируя пищевое поведение. У 80% больных концентрация лептина в крови тучных людей больше в 4 раза чем у нормы.
2. вторичное ожирение – ожирение развивающееся в результате какого-либо основного заболевания, чаще эндокринного. Например Иценко-Кушинга, гипофиз, гипоталамуса и др.
Нейтральные жиры.
В их состав входит 3х атомный спирт глицерин и высшие жирные кислоты: олеиновая кислота 55%, пальмитиновая 20%, линолевая 10%.

 1.9. Белки, биологическая роль. Нормы белка в питании для детского организма. Азотистый баланс, коэффициент изнашивания, физиологический минимум. Заменимые и незаменимые аминокислоты. Биологическая ценность белков. Белковая недостаточность. Квашиоркор..
1.9. Белки, биологическая роль. Нормы белка в питании для детского организма. Азотистый баланс, коэффициент изнашивания, физиологический минимум. Заменимые и незаменимые аминокислоты. Биологическая ценность белков. Белковая недостаточность. Квашиоркор..
Белки – высокомолекулярные азотсодержащие соединения, состоящие из аминокислот, связанных пептидными связями, - являются носителями жизни. Роль белков: транспортная, защитная, каталитическая, структурная, сократительная, регуляторная, рецепторная, энергетическая.
Состояние белкового обмена организма зависит не только от количества принимаемого белка, но и от его качественного состава. Те белки, которые по аминокислотному составу близки к аминокислотному составу организма, лучше подвергаются гидролизу в ЖКТ, т.е. степень их усвоения большая. Эти белки являются биологически более ценными. Они содержат более полный ассортимент незаменимых аминокислот. Под биологической ценностью индивидуального белка понимают его относительно питательную ценность по сравнению со стандартным белковым препаратом с учетом фактора перевариваемости и аминокислотного состава. Стандартным белковым препаратом, содержащим все незаменимые аминокислоты и легко перевариваемым, является, например лактальбумин. Белки, не содержащие какую-либо незаменимую аминокислоту, не обладают биологической ценностью. Растительные белки менее ценны, чем животные (мясо, рыба, молоко и т.д.), так как бедны лизином, метионином и триптофаном, а также труднее перевариваются. В организме могут синтезироваться только некоторые аминокислоты (заменимые), а те которые не синтезируются, называются незаменимыми. Для детей до 3-месячного возраста их 10: лейцин, изолейцин, лизин, треонин, триптофан, фенилаланин, гистидин, цистин, аргинин, валин. У взрослого организма 8 аминокислот являются незаменимыми (аргинин и гистидин – условно заменимые).
Основная масса азота в пище приходится на белки. При обмене белка, содержащийся в нем азот выделяется из организма в виде азотистых веществ. Для изучения и понимания хода и состояния обмена белков большое значение имеет определение азотистого баланса – это разница между количеством поступившего в организм азота и выведенного в виде конечных азотистых продуктов.
Виды азотистого баланса:
«положительный» – если азота выведено меньше, чем введено, т.е. азот задерживается в организме (в норме это имеет место у беременных, в растущем организме). При этом происходит накопление белков в тех или иных органах и тканях.
«нулевой» – азотистое равновесие.
«отрицательный» – если азота выведено больше, чем введено. Это значит, что в организме идет распад белков органов и тканей (сахарный диабет, ожоги, злокачественные новообразования и др.), который не компенсируется белками пищи. Он наблюдается при заболеваниях, связанных с усиленным распадом белков тканей, в старческом возрасте.
Коэффициент изнашивания – это результат ежесуточного распада тканевого белка, который равняется 23,2 г. Определен он был на добровольцах, у которых на 8-10 день безбелковой диеты начинает выделяться постоянное количество азота (53 мг в сутки на 1 кг массы тела).
Определив физиологический минимум белка, равный 30-45 г в сутки, при котором в организме устанавливается азотистое равновесие, ученые научно обосновали и рекомендовали суточную потребность белка, равную 100-120 г. Одинаково она зависит от многих факторов: возраста, вида выполняемой работы, физиологических и патологических состояний и т.д. Потребность в белке у детей: 1-3 года – 4,0 г/кг массы, 11-13 лет – 2,5 г/кг массы, 14-17 лет – 1,8 г/кг массы.
При тяжелых формах пищевых дистрофий, например, при «квашиоркоре» (в переводе «золотой или красный мальчик») – заболевании, которое распространено среди детей развивающихся стран, наблюдаются тяжелые поражения печени, остановка роста, отечность, атония мышц, анемия, резкое снижение сопротивляемости организма инфекциям. У лиц негроидной расы волосы приобретают красно-коричневый оттенок. Болезнь часто заканчивается летальным исходом.
При белковой недостаточности наблюдается резкое снижение интенсивности процессов дезаминирования, трансаминирования, биосинтеза аминокислот и синтеза мочевины в печени. Эти нарушения обусловлены нарушением ферментативных функций печени и других органов. Следствием их являются накопление аминокислот в крови, экскреция с мочой свободных аминокислот (до 10-20 г/сут, в норме – 1г/сут) и резкое снижение образования и выделения мочевины с мочой.
Аминоацидурия – дефект белков одной из транспортных систем аминокислот в почках, где происходит их реабсорбция, сопровождающийся потерей их с мочой в 3-5 раз больше нормы.
Цистинурия – дефект белка, транспортирующего цистин, приводит к повышенному выделению с мочой преимущественно цистина и образованию цистиновых камней в почках.
Кетонурия – болезнь, сопровождающаяся появлением мочи с запахом ''кленового сиропа'', является следствием недостаточности декарбоксилазы кетопроизводных аминокислот, т.е. валина, лейцина и изолейцина. В результате нарушения окислительного декарбоксилирования происходит повышение содержания в крови этих аминокислот и их кетопроизводных, а также выделение их с мочой. Моча таких больных имеет характерный запах ''кленового сиропа''. Клинически у таких детей наблюдается рвота, периодические судороги, мышечная ригидность.
2.9.Особенности процессов переваривания белков у детей. Эндопептидазы – пепсин, трипсин, химотрипсин; проферменты протеиназ и механизмы их превращения в ферменты. Экзопептидазы: карбоксипептидаза, аминопептидазы, дипептидазы. Роль соляной кислоты в процессе пищеварения.
Переваривание белков в ЖКТ следует рассматривать как начальный этап обмена веществ, при котором белки лишаются видовой специфичности и в виде аминокислот усваиваются организмом. Фермент ЖКТ осуществляет поэтапное расщепление пептидных связей белковой молекулы.
Протеазы, гидролизующие пептидные связи внутри белковой молекулы относятся к эндопептидазам: пепсин, ренин (у детей) гастриксин, трипсин, химотрипсин, эластаза – синтезируются в неактивной форме. Механизм активирования связан с отщеплением концевого пептида, приводящее к формированию трехмерной структуры и образованию активного центра ферментов. Трипсин разрывает пептидные связи, образованные основными аминокислотами: лизином и аргинином, пепсин – между циклическими аминокислотами, ренин створаживает молоко.
Ферменты, гидролизующие пептидную связь, образованную концевыми аминокислотами относятся к экзопептидазам: карбоксипептидазы синтезируются в виде предшественников в поджелудочной железе, содержат Zn, разрывают пептидные связи, образованные ароматическими аминокислотами.
Переваривание белков начинается в желудке. Большую роль в этом процессе занимает соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов – гастринов, которые вызывают секрецию соляной кислоты (образуется в обкладочных клетках желудочных желез) и профермента пепсиногена. Под действием соляной кислоты происходит денатурация белков пищи, не подвергшихся термической обработке. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Она активирует пепсиноген и создает оптимум рН для действия пепсина.
Желудочное содержимое (химус) в процессе перевариваня поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение секретина, поступающего в кровь. Он стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина (рН резко возрастает от 1,5-2,0 до 7,0).
Поступление пептидов в тонкий кишечник вызывает секрецию холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5 – 8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
Под влиянием протеолитических ферментов образуются аминокислоты, которые всасываются в кишечнике, либо диффузно, либо путем активного транспорта.
3.9.Гниение белков в толстом кишечнике. Образование, всасывание в кровь и обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
Гниение белков в кишечнике: под влиянием микрофлоры нижнего отдела кишечника некоторые аминокислоты могут подвергаться превращениям до аминов, жирных кислот, спиртов, фенолов, сероводорода и др.
Общее направление этих реакций:
При декарбоксилировании аминокислот возможно образование соответствующих нередко ядовитых аминов.
При дезаминировании возникают насыщенные и ненасыщенные кислоты, кетокислоты, оксикислоты.
Путресцин образуется при декарбоксилировании орнитина, а кадаверин – из лизина. Они относятся к группе трупных ядов. Выводятся из организма через почки с мочой почти в неизменном виде. Выделение путресцина и кадаверина с мочой наблюдается при холере, дизентерии и т.д.
Фенол и крезол образуются из тирозина. После всасывания они обезвреживаются в печени. Происходит это либо за счет связывания с Н2SО4, либо с глюкуроновой кислотой. В результате образуются парные серные-, фенол- или крезолглюкуроновые кислоты. Они называются еще эфиро-серными кислотами и являются постоянными составными частями мочи. Серная кислота присоединяется в виде активной формы, формируя фосфоаденин фосфосульфат (ФАФС), глюкуроновая кислота – уридиндифосфат глюкуроновой кислоты (УДФГК).
Индол и скатол образуется при декарбоксилировании из триптофана. Они обусловливают специфический запах кала, являются ядовитыми веществами и обезвреживаются в печени. Индол связывается в виде эфирсерной кислоты калиевая соль этой кислоты получила название животного индикана, который выводится с мочой и по его количеству судят не только о скорости процесса гниения, но и о функциональном состоянии печени.
Пути использования аминокислот после всасывания:
1.
Синтез специфических белков тканей, плазмы крови, ферментов, гормонов.
2.
Синтез углеводов (глюконеогенез).
3.
Синтез липидов.
4.
Синтез гистамина, серотонина, креатина, порфиринов, холина, адреналина, пуриновых, пиримидиновых нуклеотидов.
5.
Синтез мочевины.
6.
Оставшиеся неиспользованные аминокислоты подвергаются распаду с выделением энергии (10-15%).
Общие пути распада аминокислот:
Декарбоксилирование;
Трансаминирование;
Дезаминирование;
4.9.Трансаминирование аминокислот. Роль трансаминаз(аланинтрансаминаза,аспартаттрансаминаза),кофермента-пиридоксальфосфата. Биологическое значение реакций трансаминирования. Определение трансаминаз в сыворотке крови в диагностике инфаркта миокарда, заболеваниях печени.
Трансаминирование – процесс переноса аминогруппы с α-аминокислоты на кетокислоту при участии ферментов трансаминаз (В6 – фосфопиридоксаль). Этому процессу подвергаются все аминокислоты, кроме лизина, треонина и пролина.

Реакцию трансаминирования катализируют высокоактивные аминотрансферазы: аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ), которые обладают субстратной специфичностью.
АЛТ и АСТ – органоспецифические ферменты, в норме в крови их активнрсть равна 5-40 ЕД/л, т.е. активность трансаминаз сравнительно низкая. При заболеваниях, сопровождающихся деструкцией (некрозом) клеток, происходит выход ферментов в кровь и повышение их активности. Определение активности АЛТ и АСТ имеет большое диагностическое значение. Для дифференциальной диагностики заболеваний печени и сердца определяют соотношение активности АСТ/АЛТ в сыворотке крови – «коэффициент де Ритиса», который в норме составляет 1,33±0,42.
При гепатитах активность АЛТ увеличивается в 6-8 раз по сравнению с нормой, а АСТ – в2-4 раза. «Коэффициент де Ритиса» уменьшается примерно до 0,6. Особенно важное значение для диагностики имеет повышение активности АЛТ при безжелтушных формах вирусного гепатита. У детей при гепатитах активность АЛТ возрастает еще в дожелтушный период развития болезни. Однако, при церрозе печени «Коэффициент де Ритиса» приближается к 1,0, что свидетельствует о некрозе клеток, при котором в кровь выходят обе фракции (цитоплазматическая и митохондриальная).
При инфаркте миокарда активность АСТ увеличивается в 8-10 раз, а АЛТ – в 1,5 -2,0 раза. Значение «Коэффициента де Ритиса» резко возрастает. Инфекционные и токсические миокардиты характеризуются повышением АСТ, это же самое наблюдается при операциях на сердце.
При стенокардии, пороках сердца, инфаркте легкого активность аминотрансфераз в крови не возрастает.
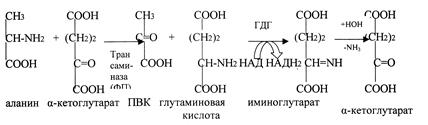
5.9.Окислительное дезаминирование аминокислот; глутаматдегидрогеназа. Непрямое дезаминирование аминокислот(связь с трансаминированием). Дезаминирование – процесс потери аминокислотой аминогруппы. В организме подвергается этому процессу только глутаминовая кислота, т.к. в организме активен фермент глутаматдегидрогеназа (ГДГ). Фермент ГДГ активен в митохондриях клеток всех органов, кроме мышечной ткани.
1. Окислительное дезаминирование.
NН
СООН – СН2 – СН2 – С – СООН
НООС–СН2- СН2 - СН – СООН
NН2
О
ГДГ +НОН СООН-СН2-СН2-С-СООН
г 

 лутаминовая кислота иминоглутарат NН3 + -
лутаминовая кислота иминоглутарат NН3 + -
α-кетоглутаровая кислота
 НАД
НАД
НАДН2
Остальные аминокислоты подвергаются непрямому дезаминированию.
2. Непрямое дезаминирование – это процесс дезаминирования путем трансаминирования.
Основные источники аммиака в детском организме. Роль глутамина в обезвреживании и транспорте аммиака. Судьба аммиака в организме. Биосинтез мочевины(орнитиновый цикл). Нарушение синтеза и выведения мочевины. Гипераммониемия.
Аммиак в организме образуется в результате дезаминирования аминокислот, биогенных аминов и нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение). Концентрация аммиака в крови в норме – 0,4-0,7мг/л. Это токсичное соединение, поэтому аммиак не накапливается, а вступает в реакцию с глутаминовой или аспарагиновой кислотами с образованием индифферентной транспортной формы – глутамина или аспарагина.
+NН3
Н  ООС-(СН2)2-СН-СООН Н 2NОС-(СН2)2-СН-СООН
ООС-(СН2)2-СН-СООН Н 2NОС-(СН2)2-СН-СООН


NН2 АТФ NН2
-Н 2О
глутаминовая кислота глутамин
+NН3
 НООС-СН2-СН-СООН Н2NОС-СН2-СН-СООН
НООС-СН2-СН-СООН Н2NОС-СН2-СН-СООН

 АТФ
АТФ
NН2 -Н 2О
NН2
аспарагиновая кислота аспарагин
В почках глутамин под влиянием глутаминазы расщепляется с образованием аммиака, идущего на нейтрализацию кислых соединений с образованием аммонийных солей. Этот процесс является одним из механизмов регуляции кислотно-щелочного равновесия в организме и сохранения важнейших катионов (Na+, K+) для поддержания осмотического давления. Глутамин – основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров, белков, глюкозы. Также источниками образования аммиака служат процессы:
дезаминирования биогенных аминов;
распад пиримидиновых оснований (урацил, тимин, цитозин);
дезаминирования аминокислот;
дезаминирования пуриновых оснований (гуанина и аденина).
Пути использования аммиака в организме:
1.
Синтез аминокислот из соответствующих кетокислот:
АТФ
 СН3-С-СООН + NН3 СН3-СН-СООН
СН3-С-СООН + NН3 СН3-СН-СООН



О NН2
ПВК аланин
2.
Синтез аммонийных солей в почках.
3.
Синтез пуриновых и пиримидиновых нуклеотидов.
4.
Синтез мочевины – основной путь обезвреживания аммиака.
ГИПЕРАММОНИЕМИЯ.
Повышение содержания аммиака в крови до 6000мкмоль/л (норма-60мкмоль/л) оказывает токсическое действие на организм.
Причины:
1.
генетический дефект ферментов орнитинового цикла в печени;
2.
вторичное поражение печени в результате цирроза, гепатита и др.
Симптомы: тошнота, повторяющаяся рвота, потеря сознания, отек мозга, отставание умственного развития. Все симптомы гипераммониемии – проявление действия аммиака на ЦНС.
Для диагностики производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активность ферментов печени.
Еще в прошлом веке русские ученые М.В. Ненцкий и С.С. Салазкин показали, что в печени происходит образование мочевины из углекислого газа и аммиака.
Кребс и Гензеляйт установили, что синтез мочевины представляет собой циклический процесс, в котором ключевым соединением, замыкающим цикл, является орнитин. Кохен и Ратнер выяснили, что начальной реакцией этого цикла является синтез карбамоилфосфата.
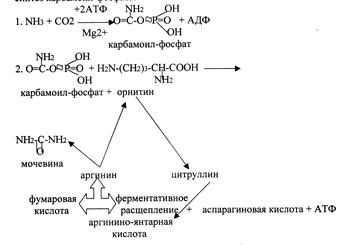
В печени аммиак связывается с СО2 с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы. Затем под действием орнитин-карбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на орнитин и образуется цитруллин. В следующей реакции аргининосукцинатсинтетаза связывает его с аспартатом и образуется аргининоянтарная кислота. Аспартат – источник второго атома азота мочевины. Далее происходит расщепление аргининоянтарной кислоты на аргинин и фумарат (идет в ЦТК). Аргинин гидролизуется под действием аргиназы на орнитин и мочевину. Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции происходят в митохондриях гепатоцитов. Затем цитруллин транспортируется в цитозоль, где и осуществляются дальнейшие превращения.
Орнитиновый цикл в печени выполняет 2 функции:
1. превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных
продуктов - аммиака;
2. синтез аргинина и пополнение его в организме.
Отмечается, что у детей первых месяцев жизни функция печени развита недостаточно, что проявляется в том, что у ребенка количество аммиака по сравнению с взрослым человеком увеличено в 2-2,5 раза. У новорожденных – 20-30% общего азота падает на азот мочевины.
Мочевина – безвредное для организма соединение. Главным местом ее образования в организме является печень, где есть ферменты мочевинообразования. В головном мозге имеются все ферменты синтеза мочевины, кроме карбамоилфосфатазы, поэтому в нем мочевина не образуется. Мочевина – основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. В норме экскрекция мочевины – 25-30 г/сут. При повышении количества потребляемых с пищей белков увеличивается выделение мочевины.
7.9. Обмен фенилаланина и тирозина. Врожденные нарушения обмена аминокислот. Фенилкетонурия, алкаптонурия, альбинизм причины проявления, их профилактика. Декарбоксилирование аминокислот. Биогенные амины: гистамин, серотонин, γ-аминомасляная кислота. Образование, функции. Инактивация биогенных аминов.
Причиной нарушений в обмене отдельных аминокислот служит полное или частичное выключение определенной ферментативной активности. При этом врожденном дефекте идет накопление большого количества промежуточных или побочных продуктов, оказывающих токсическое действие на организм, особенно на ЦНС. Вот почему, прежде всего, поражаются дети раннего возраста с последующим нарушением психической деятельности.
Фенилкетонурия – это наследственное заболевание, связанное с отсутствием фермента фенилаланингидроксилазы, в связи с чем фенилаланин п<



 4.8. Схема распада фосфолипидов мембран. Образование эйкозаноидов из арахидоновой кислоты: простагландинов, лейкотриенов, тромбоксанов, простациклинов. Роль в норме и патологии (атеросклероз, бронхиальная астма, ревматоидный артрит).
4.8. Схема распада фосфолипидов мембран. Образование эйкозаноидов из арахидоновой кислоты: простагландинов, лейкотриенов, тромбоксанов, простациклинов. Роль в норме и патологии (атеросклероз, бронхиальная астма, ревматоидный артрит).



 8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. процессов. Ожирение, причины.
8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. процессов. Ожирение, причины.
 1.9. Белки, биологическая роль. Нормы белка в питании для детского организма. Азотистый баланс, коэффициент изнашивания, физиологический минимум. Заменимые и незаменимые аминокислоты. Биологическая ценность белков. Белковая недостаточность. Квашиоркор..
1.9. Белки, биологическая роль. Нормы белка в питании для детского организма. Азотистый баланс, коэффициент изнашивания, физиологический минимум. Заменимые и незаменимые аминокислоты. Биологическая ценность белков. Белковая недостаточность. Квашиоркор..


 лутаминовая кислота иминоглутарат NН3 + -
лутаминовая кислота иминоглутарат NН3 + - НАД
НАД
 ООС-(СН2)2-СН-СООН Н 2NОС-(СН2)2-СН-СООН
ООС-(СН2)2-СН-СООН Н 2NОС-(СН2)2-СН-СООН НООС-СН2-СН-СООН Н2NОС-СН2-СН-СООН
НООС-СН2-СН-СООН Н2NОС-СН2-СН-СООН
 СН3-С-СООН + NН3 СН3-СН-СООН
СН3-С-СООН + NН3 СН3-СН-СООН


