

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
Топ:
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Интересное:
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
СОДЕРЖАНИЕ
| ВВЕДЕНИЕ......................................................................................................... | 3 |
| ОСНОВНАЯ ЧАСТЬ......................................................................................... | 5 |
| Основные понятия о кристаллах............................................................ | 5 |
| Основные свойства кристаллических веществ..................................... | 7 |
| Группы кристаллов.................................................................................. | 8 |
| Кристаллизация........................................................................................ | 9 |
| Пути образования кристаллов................................................................ | 10 |
| Механизм роста кристаллов................................................................... | 11 |
| Применение кристаллов.......................................................................... | 13 |
| Методы выращивания кристаллов в домашних условиях................... | 14 |
| Выращивание кристаллов медного купороса....................................... | 15 |
| ЗАКЛЮЧЕНИЕ.................................................................................................. | 17 |
| СПИСОК ИПОЛЬЗОВАННЫХ ИСТОЧНИКОВ........................................... | 18 |
| ПРИЛОЖЕНИЯ ………………………………………………………………. | 19 |
ВВЕДЕНИЕ
Каждый человек в своей жизни хотя бы один раз любовался красивым блеском кристаллов. Кристаллы окружают нас повсюду. Кто не рассматривал песчинки на речном берегу или не любовался снежинками? И морозные узоры на стеклах окон и иней, украшающий зимой голые ветки деревьев. В земле иногда находят камни такой формы, как будто их кто-то тщательно выпиливал, шлифовал, полировал. Они завораживают своими правильными формами, большим разнообразием расцветок. Трудно поверить, что такие многогранники образовались сами без помощи человека. Вот эти-то камни с природной, то есть не сделанной руками человека, правильной, многогранной формой и называются кристаллами.
|
|
Многие кристаллы идеально чисты и прозрачны, как вода. Слово «кристалл» происходит от греческого «крюсталлос», то есть «лед». Полагали, что лед, находясь длительное время в горах, на сильном морозе, окаменевает и теряет способность таять [1].
Кристаллы, как и живые существа, могут зарождаться, расти, стареть и разрушаться.
Выращивание кристаллов в наше время очень интересная и актуальная тема, потому что искусственные кристаллы широко применяются в разных областях нашей жизни – медицина, радиотехника и машиностроение, ювелирная промышленность. А выращивание кристаллов в домашних условиях может стать интересным и увлекательным занятием.
Поэтому целью работы стало изучение способов выращивания кристаллов в домашних условиях.
Задачи проекта:
- выяснить основные свойства кристаллических веществ;
- познакомиться с условиями образования и способами выращивания кристаллов;
- вырастить кристалл медного купороса в домашних условиях.
Гипотеза: Кристаллизация в природе – длительный процесс, чистые кристаллы, без включений – редкость. В лабораторных условиях можно вырастить кристаллы некоторых веществ за сравнительно короткое время.
Объект исследования: кристаллы медного купороса.
Предмет исследования: процесс кристаллизации вещества в растворе.
Методы исследования:
1. Изучение литературы и других источников информации.
2. Эксперимент.
3. Анализ результатов.
Практическая значимость проекта: Данную работу можно использовать как источник дополнительной информации при изучении тем «Типы кристаллических решеток» и «Агрегатные состояния вещества. Твердые вещества». Кроме того, рекомендациями, разработанными в ходе выполнения проекта, могут воспользоваться все желающие вырастить кристалл в домашних условиях.
Описание работы. Работа состоит из двух частей. В теоретической части собрана краткая информация о кристаллах. В практической части описан процесс выращивания кристалла в домашних условиях и представлена фотография выращенных кристаллов медного купороса.
|
|
ОСНОВНАЯ ЧАСТЬ
Основные понятия о кристаллах
Кристаллами называют твердые тела, образованные в виде геометрически правильных многогранников. Все известные кристаллы по форме можно разделить на шесть групп (рисунок 1).
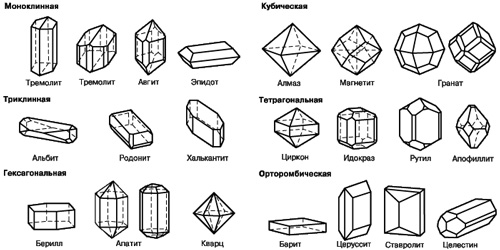
Рисунок 1 – Формы кристаллов
Главной особенностью кристалла считали его прозрачность, поэтому позднее так стали называть все прозрачные твердые тела. Сейчас словом «кристалл» называют все твердые тела с упорядоченной внутренней структурой, которая часто проявляется в виде правильной геометрической формы тела [2].
Слово «кристалл» звучит почти одинаково во всех языках. Много веков назад среди снегов в Альпах, на территории Швейцарии, нашли красивые, совершенно бесцветные кристаллы, очень напоминающие чистый лед. Древние натуралисты так их и назвали – «кристаллос», по-гречески – «лед»; это слово происходит от греческого «криос» – «мороз». Полагали, что лед, находясь длительное время в горах, на сильном морозе, окаменевает и теряет способность таять. Один из самых авторитетных античных философов Аристотель писал, что «кристалл рождается из воды, когда она полностью утрачивает теплоту» [4].
Элементами ограничения кристаллов являются:
1) грани (плоскости);
2) ребра (линии пересечения граней);
3) вершины (точки пересечения ребер).
Размеры кристаллов весьма разнообразны – от микроскопически мелких до очень крупных и даже гигантских. Геометрически правильная форма кристалла обусловлена его внутренним строением. Исследования кристаллических веществ при помощи рентгеновских лучей показывают, что
элементарные частицы (молекулы, атомы, ионы) любого кристаллического вещества закономерно располагаются в пространстве. Во всех кристаллических структурах можно выделить множество одинаковых атомов, расположенных наподобие узлов пространственной решетки [1].
Пространственная решетка представляет собой систему точек, расположенных в вершинах, равных параллельно ориентированных и смежных по целым граням параллелепипедов без промежутков, заполняющих пространство [3].
На рисунке 2 показано строение пространственной решетки хлорида натрия.
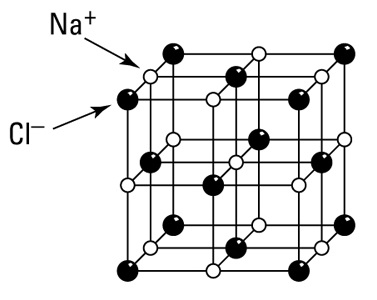
Рисунок 2 – Кристаллическая решетка хлорида натрия
|
|
Группы кристаллов
Множество всех кристаллов можно классифицировать на несколько типов, используя тот или иной критерий.
Во-первых, по форме кристаллы следует разделить на две большие группы: идеальные и реальные.
Идеальные кристаллы – это математическая абстракция, используемая учеными для описания свойств настоящих кристаллов. Характерными признаками идеального кристалла являются гладкие грани, строгий дальний порядок, определенная симметрия кристаллической решетки и прочие характерные для кристалла параметры [5].
Реальные кристаллы – это те кристаллы, с которыми мы сталкиваемся в реальной жизни. Они имеют различные примеси, которые могут понижать симметрию кристаллической решетки, шероховатые грани, могут иметь неправильную форму, дефекты оптических свойств (если кристалл прозрачный).
По происхождению кристаллы делятся на природные (естественные) и искусственные (выращенные человеком).
Природные кристаллы вырастают в недрах нашей планеты в естественных для роста условиях.
Искусственные кристаллывыращиваются в лабораториях или в домашних условиях. Например, кристаллы медного купороса можно с легкостью вырастить дома.
Кристаллы также можно разделить по эстетико-экономическому критерию на два вида – драгоценные и не драгоценные.
Драгоценные кристаллы (камни) – минералы, обладающие двумя основными характеристиками «драгоценности»: красота и редкость. Названия многих вам известны: алмаз, аметист, рубин, сапфир, изумруд, топаз и т.д. [5]
Все кристаллы по характеру превалирующей связи подразделяют на молекулярные, атомные, металлические, ионные. В таблице 1 представлена характеристика веществ с различными типами кристаллических решеток.
Таблица 1 – Типы кристаллических решеток
| Тип кристаллической решетки | Частицы в узлах | Тип химической связи между частицами | Физические свойства | Примеры |
| Молекулярная | Молекулы | Ковалентная: полярная и неполярная | - легкоплавкие; - некоторые растворяются в воде; - обладают запахом. | Инертные газы, галогены, СО2, Н2О |
| Атомная | Атомы | Ковалентная: полярная и неполярная | - тугоплавкие; - твердые; - нерастворимые в воде; - не проводит электрический ток. | Углерод (алмаз, графит), оксид кремния (SiО2) |
| Металлическая | Атомы, положительно заряженные ионы металлов | Металлическая | - металлический блеск; - высокие тепло- и электропроводность; - пластичны | Металлы и сплавы |
| Ионная | Положительно и отрицательно заряженные ионы (катионы и анионы) | Ионная | - тугоплавкие; - растворяются в воде; - расплав и раствор проводит электрический ток; - не имеют запаха. | Хлорид натрия NaCI, медный купорос CuSO4.5H2O |
Кристаллизация
|
|
Кристаллизация – процесс образования кристаллов из газов, растворов, расплавов или стёкол. Кристаллизацией называют также образование кристаллов с данной структурой из кристаллов иной структуры (полиморфныепревращения) или процесс перехода из жидкого состояния в твёрдое кристаллическое.
Процесс кристаллизации начинается только после охлаждения жидкости к определённой температуре. Во время кристаллизации температура не меняется. Кристаллизация начинается при достижении некоторого предельного условия, например, охлаждения жидкости или пересыщения, когда практически мгновенно возникает множество мелких кристалликов – центровкристаллизации. Кристаллики растут, присоединяя атомы или молекулы из жидкости. Рост граней кристалла происходит послойно, края незавершённых атомных слоев (ступени) при росте движутся вдоль грани.
Пути образования кристаллов
Кристаллы могут образовываться путём:
1) кристаллизации из расплавов;
2) кристаллизации из растворов;
3) кристаллизации из газообразного состояния (возгонка);
4) кристаллизации из твердого состояния.
Кристаллизация из расплавов происходит при охлаждении до точки его затвердевания. Примером кристаллизации из расплавов в природе служат огромные массивы горных пород, которые образовались в результате застывания магмы.
Кристаллизация из растворовхарактеризуется тем, что растворитель отдает избыток растворенного в нем вещества. Такой вид кристаллизации достаточно часто наблюдается в природе. Примером может служить образование мощных отложений солей на дне озер.
Выпадение кристаллов может происходить только из пересыщенных растворов, что можно добиться следующим образом:
1) испарением или выпариванием растворителя;
2) введением в растворы веществ, которые понижают растворимость получаемых кристаллов;
3) изменением температуры;
4) изменением давления.
В природе процессы кристаллизации из растворов широко распространены. Наглядным примером являются мощные залежи каменной соли. Искусственную кристаллизацию применяют на химических предприятиях и проводят в исследовательских лабораториях.
|
|
При кристаллизации из газообразного состояния (возгонка)кристаллы образуются непосредственно из пара и газа, минуя жидкую форму. Такой способ кристаллизации вызван либо резким снижением температуры, либо резким повышением давления. Именно из паров возникают снежинки и морозные узоры на стеклах. Возникновение природных кристаллов серы и других веществ, связанных с газообразными выделениями вулканического происхождения, происходит так же возгонкой.
В промышленности методом возгонки получают кристаллический магний, корунд (SiC), йод, нафталин и другие вещества.
Возможна кристаллизация из твердого состояния. Примером служат закристаллизованные стекла. В результате продолжительного нагревания и некоторых степеней деформации возможны более крупнокристаллические и даже монокристаллические образования.
В природе такие явления могут происходить на границе двух пород. Именно под давлением и при высокой температуре известняк переходит в мрамор, т.е. в более крупнозернистую породу [1].
Механизм роста кристаллов
Одним из основных условий зарождения и роста кристаллов является пересыщение растворов, другим условием – переохлаждение. Зарождение кристаллов может быть самопроизвольным или вынужденным.
Во втором случае необходима затравка, т.е. введение мельчайших кристалликов кристаллизуемого вещества. Так же возможно введение других по строению близких к нему частиц других твердых веществ.
На зарождение кристалликов также влияют следующие факторы:
1) характер стенок сосуда (геометрическая форма, наличие неровностей – трещинок, каналов), в котором происходит кристаллизация;
2) электрические и магнитные поля, способствующие кристаллизации;
3) ионизирующее излучение (γ-излучение радия), приводящее к увеличению числа центров кристаллизации;
4) ультразвук, значительно ускоряющий процесс кристаллизации;
5) число предшествующих опыту операций – «обработок» [3].
Под обработкой понимается использование ранее выращенных из раствора кристаллов, которые растворяют в новой порции растворителя, а затем из полученного раствора вновь выращивают кристаллы и т.д. Скорость зарождения кристаллов снижается при увеличении числа предшествующих операций.
Наблюдая рост кристаллов, можно выявить ряд характерных явлений. В первую очередь следует отметить, что наблюдается передвижение граней растущих кристаллов по направлению от центра кристаллизации. Кристаллы
растут за счет отложения новых слоев веществ. В результате это каждая грань растущего кристалла перемещается параллельно самой себе в направлении нормали (перпендикуляра), проведенной к грани из точки зарождения.
Величина нормального к ее плоскости отрезка, на который данная грань передвигается в единицу времени, называется скоростью нарастания некоторой грани.
Вследствие движения граней параллельно самим себе углы между двумя любыми гранями растущего кристалла остаются постоянными(закон постоянства двухгранных углов).
Следовательно, скорость роста различных граней неодинакова, нередко некоторые грани кристалла увеличиваются в размерах, другие же постепенно уменьшаются и в конце концов исчезают.
Применение кристаллов
Применения кристаллов в науке и технике так многочисленны и разнообразны, что их трудно перечислить, ограничимся несколькими примерами. Самый твердый и самый редкий из природных минералов – алмаз. Алмазными пилами распиливают камни. Алмаз используется при бурении горных пород. В граверных инструментах, делительных машинах, аппаратах для испытания твердости, сверлах для камня и металла вставлены алмазные острия.
На искусственных рубинах работает часовая промышленность.
Кристаллы применяют в лазерах (оптических квантовых генераторах). В глазной хирургии применяется чаще всего неодиновые лазеры и лазеры на рубине. В наземных системах ближнего радиуса действия часто используются инжекционные лазеры на арсениде галлия. Появились и новые лазерные кристаллы: флюорит, гранаты, арсенид галлия и др.
Сапфир прозрачен, поэтому из него делают пластины для оптических приборов. Основная масса кристаллов сапфира идет в полупроводниковую промышленность.
Одна из разновидностей кварца – горный хрусталь. Из него делают линзы, призмы и другие детали оптических приборов.
В технике также нашел своё применение поликристаллический материал поляроид. Поляроидные пленки применяются в очках.
Кристаллы используются также для усиления волн СВЧ-диапазона и в лазерах для усиления световых волн. Они применяются в радиоприемниках и радиопередатчиках, в головках звукоснимателей и в гидролокаторах. [6]
Памятка
В домашних условиях
| Вам понадобится: - медный купорос – 200г; - обычная кипяченая или дистиллированная вода – 300мл; - салфетка; - стеклянный стакан или банка; - бесцветный лак для ногтей; - резиновые перчатки. | 
|
Этапы работы:
В воду, нагретую примерно до 80 градусов, по ложке добавляем медный купорос. Раствор постоянно помешиваем, чтобы порошок полностью растворился. Если медный купорос перестал растворяться и оседает на дне, значит раствор готов. Ждем, пока раствор остынет до комнатной температуры, и началось выпадение мелких кристалликов.
Отфильтровываем раствор и выбираем самый крупный и правильный по форме кристалл.
Опускаем кристалл в раствор, накрываем стакан салфеткой и оставляем в неподвижном состоянии.
Следим, чтобы растущий кристалл был всегда покрыт слоем насыщенного раствора, а стенки, дно и сам кристалл не обрастали новыми маленькими кристаллами.

| Когда кристалл достигнет нужного размера, извлекаем его из раствора, просушиваем и покрываем прозрачным лаком для ногтей. Он защитит кристалл от разрушения при хранении и придаст ему дополнительный блеск. |
СОДЕРЖАНИЕ
| ВВЕДЕНИЕ......................................................................................................... | 3 |
| ОСНОВНАЯ ЧАСТЬ......................................................................................... | 5 |
| Основные понятия о кристаллах............................................................ | 5 |
| Основные свойства кристаллических веществ..................................... | 7 |
| Группы кристаллов.................................................................................. | 8 |
| Кристаллизация........................................................................................ | 9 |
| Пути образования кристаллов................................................................ | 10 |
| Механизм роста кристаллов................................................................... | 11 |
| Применение кристаллов.......................................................................... | 13 |
| Методы выращивания кристаллов в домашних условиях................... | 14 |
| Выращивание кристаллов медного купороса....................................... | 15 |
| ЗАКЛЮЧЕНИЕ.................................................................................................. | 17 |
| СПИСОК ИПОЛЬЗОВАННЫХ ИСТОЧНИКОВ........................................... | 18 |
| ПРИЛОЖЕНИЯ ………………………………………………………………. | 19 |
ВВЕДЕНИЕ
Каждый человек в своей жизни хотя бы один раз любовался красивым блеском кристаллов. Кристаллы окружают нас повсюду. Кто не рассматривал песчинки на речном берегу или не любовался снежинками? И морозные узоры на стеклах окон и иней, украшающий зимой голые ветки деревьев. В земле иногда находят камни такой формы, как будто их кто-то тщательно выпиливал, шлифовал, полировал. Они завораживают своими правильными формами, большим разнообразием расцветок. Трудно поверить, что такие многогранники образовались сами без помощи человека. Вот эти-то камни с природной, то есть не сделанной руками человека, правильной, многогранной формой и называются кристаллами.
Многие кристаллы идеально чисты и прозрачны, как вода. Слово «кристалл» происходит от греческого «крюсталлос», то есть «лед». Полагали, что лед, находясь длительное время в горах, на сильном морозе, окаменевает и теряет способность таять [1].
Кристаллы, как и живые существа, могут зарождаться, расти, стареть и разрушаться.
Выращивание кристаллов в наше время очень интересная и актуальная тема, потому что искусственные кристаллы широко применяются в разных областях нашей жизни – медицина, радиотехника и машиностроение, ювелирная промышленность. А выращивание кристаллов в домашних условиях может стать интересным и увлекательным занятием.
Поэтому целью работы стало изучение способов выращивания кристаллов в домашних условиях.
Задачи проекта:
- выяснить основные свойства кристаллических веществ;
- познакомиться с условиями образования и способами выращивания кристаллов;
- вырастить кристалл медного купороса в домашних условиях.
Гипотеза: Кристаллизация в природе – длительный процесс, чистые кристаллы, без включений – редкость. В лабораторных условиях можно вырастить кристаллы некоторых веществ за сравнительно короткое время.
Объект исследования: кристаллы медного купороса.
Предмет исследования: процесс кристаллизации вещества в растворе.
Методы исследования:
1. Изучение литературы и других источников информации.
2. Эксперимент.
3. Анализ результатов.
Практическая значимость проекта: Данную работу можно использовать как источник дополнительной информации при изучении тем «Типы кристаллических решеток» и «Агрегатные состояния вещества. Твердые вещества». Кроме того, рекомендациями, разработанными в ходе выполнения проекта, могут воспользоваться все желающие вырастить кристалл в домашних условиях.
Описание работы. Работа состоит из двух частей. В теоретической части собрана краткая информация о кристаллах. В практической части описан процесс выращивания кристалла в домашних условиях и представлена фотография выращенных кристаллов медного купороса.
ОСНОВНАЯ ЧАСТЬ
Основные понятия о кристаллах
Кристаллами называют твердые тела, образованные в виде геометрически правильных многогранников. Все известные кристаллы по форме можно разделить на шесть групп (рисунок 1).

Рисунок 1 – Формы кристаллов
Главной особенностью кристалла считали его прозрачность, поэтому позднее так стали называть все прозрачные твердые тела. Сейчас словом «кристалл» называют все твердые тела с упорядоченной внутренней структурой, которая часто проявляется в виде правильной геометрической формы тела [2].
Слово «кристалл» звучит почти одинаково во всех языках. Много веков назад среди снегов в Альпах, на территории Швейцарии, нашли красивые, совершенно бесцветные кристаллы, очень напоминающие чистый лед. Древние натуралисты так их и назвали – «кристаллос», по-гречески – «лед»; это слово происходит от греческого «криос» – «мороз». Полагали, что лед, находясь длительное время в горах, на сильном морозе, окаменевает и теряет способность таять. Один из самых авторитетных античных философов Аристотель писал, что «кристалл рождается из воды, когда она полностью утрачивает теплоту» [4].
Элементами ограничения кристаллов являются:
1) грани (плоскости);
2) ребра (линии пересечения граней);
3) вершины (точки пересечения ребер).
Размеры кристаллов весьма разнообразны – от микроскопически мелких до очень крупных и даже гигантских. Геометрически правильная форма кристалла обусловлена его внутренним строением. Исследования кристаллических веществ при помощи рентгеновских лучей показывают, что
элементарные частицы (молекулы, атомы, ионы) любого кристаллического вещества закономерно располагаются в пространстве. Во всех кристаллических структурах можно выделить множество одинаковых атомов, расположенных наподобие узлов пространственной решетки [1].
Пространственная решетка представляет собой систему точек, расположенных в вершинах, равных параллельно ориентированных и смежных по целым граням параллелепипедов без промежутков, заполняющих пространство [3].
На рисунке 2 показано строение пространственной решетки хлорида натрия.

Рисунок 2 – Кристаллическая решетка хлорида натрия
Основные свойства кристаллических веществ
Внутреннее строение кристаллов обуславливает ряд характерных свойств в кристаллических веществах. Важнейшими из них являются: однородность, анизотропность, способность самоограняться, постоянная температура плавления).
Однородность означает, что свойства кристалла (цвет, удельный вес, твердость, теплопроводность, электропроводность и др.) одинаковы во всех его точках. В кристалле могут встречаться атомы разных элементов по свойствам, отличающихся друг от друга.
Следует отметить, что реальные кристаллические вещества очень часто содержат постоянные примеси и включения, искажающие их кристаллические решетки, поэтому абсолютной однородности в реальных кристаллах часто не бывает.
Основной признак однородного кристаллического тела – неодинаковость его физических свойств по различным направлениям: расширения, теплопроводности, электропроводности, механической прочности и др. Это свойство кристаллов называют анизотропией. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинам, гораздо труднее.
Способность самоограняться заключается в способности кристаллических веществ образовывать правильные многогранники, т.е. это свойство кристаллов образовывать грани при свободном росте в соответствующей среде. Так, например, если изменить форму кристалла каменной соли (NaCl) и поместить его в пересыщенный раствор, то через некоторое время данный кристалл примет форму куба. Необходимо отметить, что способность самоограняться характерна только для кристаллических веществ.
Каждое кристаллическое вещество имеет постоянную точку плавления, в не диапазон температур. Если нагревать кристаллическое тело, то температура его будет повышаться до определенного предела. При дальнейшем нагревании вещество начнет плавиться, при этом температура некоторое время останется постоянной. Это то время, когда все тепло расходуется на разрушение кристаллической решетки [5].
Группы кристаллов
Множество всех кристаллов можно классифицировать на несколько типов, используя тот или иной критерий.
Во-первых, по форме кристаллы следует разделить на две большие группы: идеальные и реальные.
Идеальные кристаллы – это математическая абстракция, используемая учеными для описания свойств настоящих кристаллов. Характерными признаками идеального кристалла являются гладкие грани, строгий дальний порядок, определенная симметрия кристаллической решетки и прочие характерные для кристалла параметры [5].
Реальные кристаллы – это те кристаллы, с которыми мы сталкиваемся в реальной жизни. Они имеют различные примеси, которые могут понижать симметрию кристаллической решетки, шероховатые грани, могут иметь неправильную форму, дефекты оптических свойств (если кристалл прозрачный).
По происхождению кристаллы делятся на природные (естественные) и искусственные (выращенные человеком).
Природные кристаллы вырастают в недрах нашей планеты в естественных для роста условиях.
Искусственные кристаллывыращиваются в лабораториях или в домашних условиях. Например, кристаллы медного купороса можно с легкостью вырастить дома.
Кристаллы также можно разделить по эстетико-экономическому критерию на два вида – драгоценные и не драгоценные.
Драгоценные кристаллы (камни) – минералы, обладающие двумя основными характеристиками «драгоценности»: красота и редкость. Названия многих вам известны: алмаз, аметист, рубин, сапфир, изумруд, топаз и т.д. [5]
Все кристаллы по характеру превалирующей связи подразделяют на молекулярные, атомные, металлические, ионные. В таблице 1 представлена характеристика веществ с различными типами кристаллических решеток.
Таблица 1 – Типы кристаллических решеток
| Тип кристаллической решетки | Частицы в узлах | Тип химической связи между частицами | Физические свойства | Примеры |
| Молекулярная | Молекулы | Ковалентная: полярная и неполярная | - легкоплавкие; - некоторые растворяются в воде; - обладают запахом. | Инертные газы, галогены, СО2, Н2О |
| Атомная | Атомы | Ковалентная: полярная и неполярная | - тугоплавкие; - твердые; - нерастворимые в воде; - не проводит электрический ток. | Углерод (алмаз, графит), оксид кремния (SiО2) |
| Металлическая | Атомы, положительно заряженные ионы металлов | Металлическая | - металлический блеск; - высокие тепло- и электропроводность; - пластичны | Металлы и сплавы |
| Ионная | Положительно и отрицательно заряженные ионы (катионы и анионы) | Ионная | - тугоплавкие; - растворяются в воде; - расплав и раствор проводит электрический ток; - не имеют запаха. | Хлорид натрия NaCI, медный купорос CuSO4.5H2O |
Кристаллизация
Кристаллизация – процесс образования кристаллов из газов, растворов, расплавов или стёкол. Кристаллизацией называют также образование кристаллов с данной структурой из кристаллов иной структуры (полиморфныепревращения) или процесс перехода из жидкого состояния в твёрдое кристаллическое.
Процесс кристаллизации начинается только после охлаждения жидкости к определённой температуре. Во время кристаллизации температура не меняется. Кристаллизация начинается при достижении некоторого предельного условия, например, охлаждения жидкости или пересыщения, когда практически мгновенно возникает множество мелких кристалликов – центровкристаллизации. Кристаллики растут, присоединяя атомы или молекулы из жидкости. Рост граней кристалла происходит послойно, края незавершённых атомных слоев (ступени) при росте движутся вдоль грани.
Пути образования кристаллов
Кристаллы могут образовываться путём:
1) кристаллизации из расплавов;
2) кристаллизации из растворов;
3) кристаллизации из газообразного состояния (возгонка);
4) кристаллизации из твердого состояния.
Кристаллизация из расплавов происходит при охлаждении до точки его затвердевания. Примером кристаллизации из расплавов в природе служат огромные массивы горных пород, которые образовались в результате застывания магмы.
Кристаллизация из растворовхарактеризуется тем, что растворитель отдает избыток растворенного в нем вещества. Такой вид кристаллизации достаточно часто наблюдается в природе. Примером может служить образование мощных отложений солей на дне озер.
Выпадение кристаллов может происходить только из пересыщенных растворов, что можно добиться следующим образом:
1) испарением или выпариванием растворителя;
2) введением в растворы веществ, которые понижают растворимость получаемых кристаллов;
3) изменением температуры;
4) изменением давления.
В природе процессы кристаллизации из растворов широко распространены. Наглядным примером являются мощные залежи каменной соли. Искусственную кристаллизацию применяют на химических предприятиях и проводят в исследовательских лабораториях.
При кристаллизации из газообразного состояния (возгонка)кристаллы образуются непосредственно из пара и газа, минуя жидкую форму. Такой способ кристаллизации вызван либо резким снижением температуры, либо резким повышением давления. Именно из паров возникают снежинки и морозные узоры на стеклах. Возникновение природных кристаллов серы и других веществ, связанных с газообразными выделениями вулканического происхождения, происходит так же возгонкой.
В промышленности методом возгонки получают кристаллический магний, корунд (SiC), йод, нафталин и другие вещества.
Возможна кристаллизация из твердого состояния. Примером служат закристаллизованные стекла. В результате продолжительного нагревания и некоторых степеней деформации возможны более крупнокристаллические и даже монокристаллические образования.
В природе такие явления могут происходить на границе двух пород. Именно под давлением и при высокой температуре известняк переходит в мрамор, т.е. в более крупнозернистую породу [1].
Механизм роста кристаллов
Одним из основных условий зарождения и роста кристаллов является пересыщение растворов, другим условием – переохлаждение. Зарождение кристаллов может быть самопроизвольным или вынужденным.
Во втором случае необходима затравка, т.е. введение мельчайших кристалликов кристаллизуемого вещества. Так же возможно введение других по строению близких к нему частиц других твердых веществ.
На зарождение кристалликов также влияют следующие факторы:
1) характер стенок сосуда (геометрическая форма, наличие неровностей – трещинок, каналов), в котором происходит кристаллизация;
2) электрические и магнитные поля, способствующие кристаллизации;
3) ионизирующее излучение (γ-излучение радия), приводящее к увеличению числа центров кристаллизации;
4) ультразвук, значительно ускоряющий процесс кристаллизации;
5) число предшествующих опыту операций – «обработок» [3].
Под обработкой понимается использование ранее выращенных из раствора кристаллов, которые растворяют в новой порции растворителя, а затем из полученного раствора вновь выращивают кристаллы и т.д. Скорость зарождения кристаллов снижается при увеличении числа предшествующих операций.
Наблюдая рост кристаллов, можно выявить ряд характерных явлений. В первую очередь следует отметить, что наблюдается передвижение граней растущих кристаллов по направлению от центра кристаллизации. Кристаллы
растут за счет отложения новых слоев веществ. В результате это каждая грань растущего кристалла перемещается параллельно самой себе в направлении нормали (перпендикуляра), проведенной к грани из точки зарождения.
Величина нормального к ее плоскости отрезка, на который данная грань передвигается в единицу времени, называется скоростью нарастания некоторой грани.
Вследствие движения граней параллельно самим себе углы между двумя любыми гранями растущего кристалла остаются постоянными(закон постоянства двухгранных углов).
Следовательно, скорость роста различных граней неодинакова, нередко некоторые грани кристалла увеличиваются в размерах, другие же постепенно уменьшаются и в конце концов исчезают.
Применение кристаллов
Применения кристаллов в науке и технике так многочисленны и разнообразны, что их трудно перечислить, ограничимся несколькими примерами. Самый твердый и самый редкий из природных минералов – алмаз. Алмазными пилами распиливают камни. Алмаз используется при бурении горных пород. В граверных инструментах, делительных машинах, аппаратах для испытания твердости, сверлах для камня и металла вставлены алмазные острия.
На искусственных рубинах работает часовая промышленность.
Кристаллы применяют в лазерах (оптических квантовых генераторах). В глазной хирургии применяется чаще всего неодиновые лазеры и лазеры на рубине. В наземных системах ближнего радиуса действия часто используются инжекционные лазеры на арсениде галлия. Появились и новые лазерные кристаллы: флюорит, гранаты, арсенид галлия и др.
Сапфир прозрачен, поэтому из него делают пластины для оптических приборов. Основная масса кристаллов сапфира идет в полупроводниковую промышленность.
Одна из разновидностей кварца – горный хрусталь. Из него делают линзы, призмы и другие детали оптических приборов.
В технике также нашел своё применение поликристаллический материал поляроид. Поляроидные пленки применяются в очках.
Кристаллы используются также для усиления волн СВЧ-диапазона и в лазерах для усиления
|
|
|

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!