Введение
апоптоз смерть старение патологический
Апоптоз - физиологическая смерть клетки, представляющая собой своеобразную генетически запрограммированную самоликвидацию. Термин «апоптоз» в переводе с греческого означает «опадающий». Авторы термина дали такое название процессу запрограммированной смерти клеток потому, что именно с ним связано осеннее опадание увядших листьев. Кроме того, само название характеризует процесс как физиологический, постепенный и абсолютно безболезненный. У животных в качестве наиболее яркого примера апоптоза, как правило, приводят исчезновение хвоста у лягушки во время метаморфозы из головастика во взрослую особь. По мере взросления лягушонка хвост полностью исчезает, поскольку его клетки подвергаются постепенному апоптозу - запрограммированной смерти, и поглощению деструктированных элементов другими клетками. Явление генетически запрограммированной гибели клеток встречается у всех эукариотов (организмов, клетки которых имеют ядро). Прокариоты же (бактерии) имеют своеобразный аналог апоптоза. Можно сказать, что данный феномен характерен для всего живого, за исключением таких особых доклеточных форм жизни, как вирусы. Апоптозу могут подвергаться как отдельные клетки (как правило, дефектные), так и целые конгломераты. Последнее особенно характерно для эмбриогенеза. К примеру, опыты исследователей доказали, что благодаря апоптозу во время эмбриогенеза исчезают перепонки между пальцами на лапках у цыплят. Ученые утверждают, что у человека такие врожденные аномалии, как сросшиеся пальцы на руках и ногах, также возникают вследствие нарушения нормального апоптоза на ранних стадиях эмбриогенеза.
История открытия
Изучение механизмов и значения генетически программируемой клеточной смерти началось еще в шестидесятых годах прошлого века. Ученых заинтересовал тот факт, что клеточный состав большинства органов на протяжении жизни организма практически одинаков, а вот жизненный цикл различных типов клеток значительно отличается. При этом происходит постоянная замена многих клеток. Таким образом, относительное постоянство клеточного состава всех организмов поддерживается динамическим равновесием двух противоположных процессов - клеточной пролиферации (деление и рост) и физиологического отмирания отживших клеток. Авторство термина принадлежит британским ученым - Дж. Керру, Э. Уайли и А. Керри, которые впервые выдвинули и обосновали концепцию о принципиальном различии физиологической смерти клеток (апоптоз), и их патологической гибели (некроз). В 2002 году ученые из кембриджской лаборатории, биологи С. Бреннер, Дж. Салстон и Р. Хорвиц, получили Нобелевскую Премию по физиологии и медицине за раскрытие основных механизмов генетической регуляции развития органов и исследования программируемой клеточной смерти. Сегодня теории апоптоза посвящены десятки тысяч научных работ, раскрывающие основные механизмы его развития на физиологическом, генетическом и биохимическом уровнях. Ведется активный поиск его регуляторов. Особенно большой интерес представляют исследования, дающие возможность практического применения регуляции апоптоза при лечении онкологических, аутоиммунных и нейродистрофических заболеваний. В организме среднестатистического взрослого человека в результате апоптоза погибает ежедневно порядка 50-70 миллиардов клеток. Для среднестатистического ребёнка в возрасте от 8 до 14 лет число клеток, погибших путём апоптоза, составляет порядка 20-30 миллиардов в день. Суммарная масса клеток, которые на протяжении 1 года жизни подвергаются разрушению, эквивалентна массе тела человека. При этом восполнение утраченных клеток обеспечивается за счёт пролиферации - увеличения клеточной популяции путём деления.
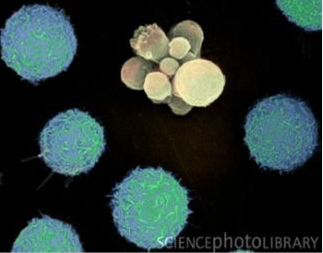
Апоптоз человеческого лейкоцита
Механизм
Механизм развития апоптоза на сегодняшний день до конца не изучен. Доказано, что процесс может индуцироваться малыми концентрациями большинства веществ, вызывающих некроз. Однако в большинстве случаев генетически запрограммированная гибель клеток происходит при поступлении сигналов от молекул - клеточных регуляторов. В биохимическом механизме апоптоза выделяют 4 основных компонента: 1) CysAsp-протеазы илм каспазы; 2) так называемые «рецепторы серти» на поверхности клетки; 3) митохондрии и выходящий из них цитохром с и 4) специальные про-и антиапоптозные белки. Такие вторичные мессенджеры, как Са2+, активные формы кислорода (АФК) и окись азота (NO), также играют важную роль в апоптозе.
Каспазы (семейство CysAsp-протеаз) выполняют центральную роль в запуске апоптоза. У млекопитающих семейство каспаз состоит из 14 белков, постоянно синтезируемых практически во всех клетках в виде проферментов, активирующихся при апоптозе. Они принимают участие в развитии воспалительных процессов, а также, наряду с эффекторными каспазами, в пролиферации Т-лимфоцитов, терминальной дифференцировке эпителиальных клеток хрусталика и кератиноцитов.
Так называемые «рецепторы смерти». У млекопитающих апоптоз часто начинается с активации так называемых «индуцирующих смерть сигнальных комплексов» на плазматической мембране. Эти комплексы образуются при взаимодействии определенных внеклеточных лигандов - например, Fas или TNF (tumor necrosis factor) с белками семейства рецепторов фактора некроза опухолей (TNFR) на клеточной мембране, называемых «рецепторами смерти». При связывании лигандов они активируют каспазу-8, образуя «индуцирующий смерть сигнальный комплекс», содержащий «рецептор смерти», адаптеры TRADD (TNFR1-associated protein with death domain) или FADD (Fasassoccated protein with death domain) и профермент каспазы-8.
Митохондриям принадлежит центральная роль в осуществлении апоптоза у млекопитающих. Сигналы от рецепторов смерти или от поврежденных участков клетки сходятся на них, вызывая повышение проницаемости обеих мембран, снижение мембранного потенциала (∆Ψm) и высвобождение белков апоптоза - апоптоз-индуцирующего фактора (AIF), SMAC (second mitochondria derived activator of caspases) и некоторых прокаспаз - из межмембранного пространства.
Наряду со специфически апоптозными белками, в цитоплазму выходит цитохром c. Там он связывается с Apaf-1 (apoptotic protease activating factor-1) и формирует так называемый апоптосомный комплекс, инициирующий активацию каспазного каскада. С помощью Smac и Omi/HtrA2 (Omi stress regulated endopeptidase/high temperature requirement protein A2) цитохром с запускает Apaf-1 зависимую активацию каспазы-9. Каспаза-9 активирует каспазы-3 и -7 (рисунок); те в свою очередь расщепляют различные белки, приводя к появлению биохимических и морфологических признаков аоптоза.
Фазы апоптоза

Стадии апоптоза
Различают три физиологические фазы апоптоза:
1. Сигнальная (активация специализированных рецепторов).
Инициация апоптоза может происходить посредством внешних (внеклеточных) или внутриклеточных факторов. Например, в результате гипоксии, гипероксии, субнекротического поражения химическими или физическими агентами, перекрёстного связывания соответствующих рецепторов, нарушения сигналов клеточного цикла, удаления факторов роста и метаболизма и т.д. Несмотря на разнообразие инициирующих факторов, выделяются два основных пути передачи сигнала апоптоза: рецептор - зависимый (внешний) сигнальный путь с участием рецепторов гибели клетки и митохондриальный(собственный) путь.
Роль белка р53
В нормальных клетках белок p53, как правило, находится в неактивной, латентной форме. Активация p53 происходит в ответ на повреждения ДНК, вызванные ультрафиолетовым или гамма-излучением, гиперэкспрессией онкогенов, вирусной инфекцией, оксидативным стрессом, гипо- и гипертермией и др. Активированный p53 координирует процесс репарации ДНК, а также регулирует транскрипцию ряда генов-активаторов апоптоза в случае необратимых повреждений ДНК или нарушений регуляции клеточного цикла. К тому же имеются указания на то, что p53 принимает участие в запуске апоптоза путём стимуляции рецепторов смерти, путём взаимодействия с промотором апоптоза - Bax, путём активации p53-зависимого модулятора апоптоза PUMA (англ. p53 upregulated modulator of apoptosis), который блокирует действие Bcl-2. Повышение уровня p53 в ответ на повреждения ДНК вызывает апоптоз, например, в клетках кожи, в тимоцитах, в клетках кишечного эпителия.
Заключение
В генетическом аппарате каждой клетки многоклеточного организма имеется специальная программа, которая при определенных обстоятельствах может привести клетку к гибели. При нормальном развитии эта программа направлена на удаление избыточно образовавшихся клеток - «безработных», а также клеток - «пенсионеров», переставших заниматься общественно полезным трудом. Другая важная функция клеточной гибели - удаление клеток - «инвалидов» и клеток «диссидентов» с серьезными нарушениями структуры или функции генетического аппарата. В частности, апоптоз - один из основных механизмов самопрофилактики онкологических заболеваний
Система программируемой клеточной смерти - существенный фактор иммунитета, поскольку гибель зараженной клетки может предотвратить распространение инфекции по организму. Другое дело, что некоторые инфекционные агенты выработали специальные меры для предотвращения преждевременной гибели зараженных клеток. Нарушения системы программируемой гибели клетки - причина серьезной патологии. Ослабление способности к апоптозу может вести к развитию злокачественных опухолей. Некоторые заболевания, в частности дегенеративные повреждения нервной системы, - результат избыточного апоптоза.
Воздействие на программу клеточной гибели - перспективное направление лекарственного лечения. Так, одна из важных задач противораковой терапии - стимуляция апоптозной системы. В других случаях задача врача, наоборот, предотвратить вредное для организма клеточное самоубийство. Таким образом, какие-то компоненты каждой клетки по праву могли бы нести микроскопическое изображение черепа со скрещенными костями. Однако следует признать, что наличие такого смертельного механизма - обстоятельство не только необходимое, но в конечном итоге крайне благоприятное. Без системы программируемой клеточной гибели мы с вами не могли бы появиться на свет такими, какими мы рождаемся. И поддержание порядка в наших организмах в течение дальнейшей жизни в значительной степени обеспечивается именно способностью наших клеток к программируемой смерти.
Список использованной литературы
1. А.В. Гордеева, Ю.А. Лабас, Р.А Звягильская: «АПОПТОЗ ОДНОКЛЕТОЧНЫХ ОРГАНИЗМОВ: МЕХАНИЗМЫ И ЭВОЛЮЦИЯ» Обзор. Институт биохимии им. А.Н. Баха РАН, Москва, 2004 год.
2. Анисимов В.Н.: «Молекулярные и физиологические механизмы старения» в 2 Т., СПб, 2008, 2-ое издание дополненное и переработанное.
. В.И. Агол: «Генетически запрограммированная смерть клетки», Московский Государственный университет им. М.В. Ломоносова, Соровский образовательный журнал №6, 2006 год.
. Бра М. Митохондрии в программированной гибели клетки: различные механизмы гибели / М. Бра, Б. Квинан, С.А. Сузин // Биохимия. 2005. - Т.70. - №2.
. Лушников Е.Ф. Гибель клетки (апоптоз) / Е.Ф. Лушников, А.Ю. Абросимов. М.: Медицина, 2001. - 192 с.
. http://www.tiensmed.ru/news/apoptoz-c9t.html
. http://humbio.ru/humbio/apon/000079c2.htm
. http://immunology-allergy.org/
9. http://pathologi.com/index.php? option=com_content&view=article&id=197:2010-09-11-09-54-44&catid=36:2010-09-10-15-43-45&Itemid=57
10. http://lektsii.net/1-59720.html
. http://tsitologiya.cytspb.rssi.ru/49_5/shirokova.pdf
Введение
апоптоз смерть старение патологический
Апоптоз - физиологическая смерть клетки, представляющая собой своеобразную генетически запрограммированную самоликвидацию. Термин «апоптоз» в переводе с греческого означает «опадающий». Авторы термина дали такое название процессу запрограммированной смерти клеток потому, что именно с ним связано осеннее опадание увядших листьев. Кроме того, само название характеризует процесс как физиологический, постепенный и абсолютно безболезненный. У животных в качестве наиболее яркого примера апоптоза, как правило, приводят исчезновение хвоста у лягушки во время метаморфозы из головастика во взрослую особь. По мере взросления лягушонка хвост полностью исчезает, поскольку его клетки подвергаются постепенному апоптозу - запрограммированной смерти, и поглощению деструктированных элементов другими клетками. Явление генетически запрограммированной гибели клеток встречается у всех эукариотов (организмов, клетки которых имеют ядро). Прокариоты же (бактерии) имеют своеобразный аналог апоптоза. Можно сказать, что данный феномен характерен для всего живого, за исключением таких особых доклеточных форм жизни, как вирусы. Апоптозу могут подвергаться как отдельные клетки (как правило, дефектные), так и целые конгломераты. Последнее особенно характерно для эмбриогенеза. К примеру, опыты исследователей доказали, что благодаря апоптозу во время эмбриогенеза исчезают перепонки между пальцами на лапках у цыплят. Ученые утверждают, что у человека такие врожденные аномалии, как сросшиеся пальцы на руках и ногах, также возникают вследствие нарушения нормального апоптоза на ранних стадиях эмбриогенеза.
История открытия
Изучение механизмов и значения генетически программируемой клеточной смерти началось еще в шестидесятых годах прошлого века. Ученых заинтересовал тот факт, что клеточный состав большинства органов на протяжении жизни организма практически одинаков, а вот жизненный цикл различных типов клеток значительно отличается. При этом происходит постоянная замена многих клеток. Таким образом, относительное постоянство клеточного состава всех организмов поддерживается динамическим равновесием двух противоположных процессов - клеточной пролиферации (деление и рост) и физиологического отмирания отживших клеток. Авторство термина принадлежит британским ученым - Дж. Керру, Э. Уайли и А. Керри, которые впервые выдвинули и обосновали концепцию о принципиальном различии физиологической смерти клеток (апоптоз), и их патологической гибели (некроз). В 2002 году ученые из кембриджской лаборатории, биологи С. Бреннер, Дж. Салстон и Р. Хорвиц, получили Нобелевскую Премию по физиологии и медицине за раскрытие основных механизмов генетической регуляции развития органов и исследования программируемой клеточной смерти. Сегодня теории апоптоза посвящены десятки тысяч научных работ, раскрывающие основные механизмы его развития на физиологическом, генетическом и биохимическом уровнях. Ведется активный поиск его регуляторов. Особенно большой интерес представляют исследования, дающие возможность практического применения регуляции апоптоза при лечении онкологических, аутоиммунных и нейродистрофических заболеваний. В организме среднестатистического взрослого человека в результате апоптоза погибает ежедневно порядка 50-70 миллиардов клеток. Для среднестатистического ребёнка в возрасте от 8 до 14 лет число клеток, погибших путём апоптоза, составляет порядка 20-30 миллиардов в день. Суммарная масса клеток, которые на протяжении 1 года жизни подвергаются разрушению, эквивалентна массе тела человека. При этом восполнение утраченных клеток обеспечивается за счёт пролиферации - увеличения клеточной популяции путём деления.

Апоптоз человеческого лейкоцита
Механизм
Механизм развития апоптоза на сегодняшний день до конца не изучен. Доказано, что процесс может индуцироваться малыми концентрациями большинства веществ, вызывающих некроз. Однако в большинстве случаев генетически запрограммированная гибель клеток происходит при поступлении сигналов от молекул - клеточных регуляторов. В биохимическом механизме апоптоза выделяют 4 основных компонента: 1) CysAsp-протеазы илм каспазы; 2) так называемые «рецепторы серти» на поверхности клетки; 3) митохондрии и выходящий из них цитохром с и 4) специальные про-и антиапоптозные белки. Такие вторичные мессенджеры, как Са2+, активные формы кислорода (АФК) и окись азота (NO), также играют важную роль в апоптозе.
Каспазы (семейство CysAsp-протеаз) выполняют центральную роль в запуске апоптоза. У млекопитающих семейство каспаз состоит из 14 белков, постоянно синтезируемых практически во всех клетках в виде проферментов, активирующихся при апоптозе. Они принимают участие в развитии воспалительных процессов, а также, наряду с эффекторными каспазами, в пролиферации Т-лимфоцитов, терминальной дифференцировке эпителиальных клеток хрусталика и кератиноцитов.
Так называемые «рецепторы смерти». У млекопитающих апоптоз часто начинается с активации так называемых «индуцирующих смерть сигнальных комплексов» на плазматической мембране. Эти комплексы образуются при взаимодействии определенных внеклеточных лигандов - например, Fas или TNF (tumor necrosis factor) с белками семейства рецепторов фактора некроза опухолей (TNFR) на клеточной мембране, называемых «рецепторами смерти». При связывании лигандов они активируют каспазу-8, образуя «индуцирующий смерть сигнальный комплекс», содержащий «рецептор смерти», адаптеры TRADD (TNFR1-associated protein with death domain) или FADD (Fasassoccated protein with death domain) и профермент каспазы-8.
Митохондриям принадлежит центральная роль в осуществлении апоптоза у млекопитающих. Сигналы от рецепторов смерти или от поврежденных участков клетки сходятся на них, вызывая повышение проницаемости обеих мембран, снижение мембранного потенциала (∆Ψm) и высвобождение белков апоптоза - апоптоз-индуцирующего фактора (AIF), SMAC (second mitochondria derived activator of caspases) и некоторых прокаспаз - из межмембранного пространства.
Наряду со специфически апоптозными белками, в цитоплазму выходит цитохром c. Там он связывается с Apaf-1 (apoptotic protease activating factor-1) и формирует так называемый апоптосомный комплекс, инициирующий активацию каспазного каскада. С помощью Smac и Omi/HtrA2 (Omi stress regulated endopeptidase/high temperature requirement protein A2) цитохром с запускает Apaf-1 зависимую активацию каспазы-9. Каспаза-9 активирует каспазы-3 и -7 (рисунок); те в свою очередь расщепляют различные белки, приводя к появлению биохимических и морфологических признаков аоптоза.
Фазы апоптоза

Стадии апоптоза
Различают три физиологические фазы апоптоза:
1. Сигнальная (активация специализированных рецепторов).
Инициация апоптоза может происходить посредством внешних (внеклеточных) или внутриклеточных факторов. Например, в результате гипоксии, гипероксии, субнекротического поражения химическими или физическими агентами, перекрёстного связывания соответствующих рецепторов, нарушения сигналов клеточного цикла, удаления факторов роста и метаболизма и т.д. Несмотря на разнообразие инициирующих факторов, выделяются два основных пути передачи сигнала апоптоза: рецептор - зависимый (внешний) сигнальный путь с участием рецепторов гибели клетки и митохондриальный(собственный) путь.
Рецептор-зависимый сигнальный путь
Процесс апоптоза часто (например, у млекопитающих) начинается с взаимодействия специфических внеклеточных лигандов с рецепторами клеточной гибели, экспрессированными на поверхности клеточной мембраны. Рецепторы, воспринимающие сигнал апоптоза, относятся к суперсемейству TNF-рецепторов (англ. tumor necrosis factor receptor или кратко TNFR - «рецептор фактора некроза опухолей»). Наиболее изученными рецепторами смерти, для которых описана и определена роль в апоптозе, являются CD95 (также известный как Fas или APO-1) и TNFR1 (также называемый p55 или CD120a). К дополнительным относятся CARI, DR3 (англ. death receptor 3 - «рецептор смерти 3»), DR4 и DR5.
Все рецепторы смерти представляют собой трансмембранные белки, характеризующиеся наличием общей последовательности из 80 аминокислот в цитоплазматическом домене. Данная последовательность называется доменомсмерти (англ. death domain или кратко DD) и является необходимой для трансдукции сигнала апоптоза. Внеклеточные участки рецепторов смерти взаимодействуют с тримерами лигандов (CD95L, TNF, Apo3L, Apo2L и т.п.). Тримеры лигандов в результате взаимодействия тримеризуют рецепторы смерти (то есть «сшивают» 3 молекулы рецептора). Активированный таким образом рецептор взаимодействует с соответствующим внутриклеточным адаптером (или адаптерами). Для рецептора CD95 (Fas/APO-1) адаптером является FADD (от англ. Fas-associated DD-protein - «белок, взаимодействующий с доменом смерти Fas-рецептора»). Для рецепторов TNFR1 и DR3 адаптером является TRADD (от англ. TNFR1-associated DD-protein - «белок, взаимодействующий с доменом смерти TNFR1-рецептора»).
Адаптер, ассоциированный с рецептором смерти, вступает во взаимодействие с эффекторами - пока ещё неактивными предшественниками протеаз из семейства инициирующих каспаз - с прокаспазами. В результате цепочки взаимодействия «лиганд-рецептор-адаптер-эффектор» формируются агрегаты, в которых происходит активация каспаз. Данные агрегаты именуются апоптосомами, апоптозными шаперонами или сигнальными комплексами, индуцирующими смерть (от англ. DISC - death-inducing signaling complex - «сигнальный комплекс, индуцирующий смерть»). Примером апоптосомы может служить комплекс FasL-Fas-FADD-прокаспаза-8, в котором активируется каспаза-8.
Рецепторы смерти, адаптеры и эффекторы взаимодействуют между собой сходными по структуре доменами: DD, DED, CARD. DD (от англ. death domain - «домен смерти») участвует во взаимодействии рецептора Fas с адаптером FADD и во взаимодействии рецепторов TNFR1 или DR3 с адаптером TRADD. Посредством домена DED (от англ. death-effector domain - «домен эффектора смерти») осуществляется взаимодействие адаптера FADD с прокаспазами −8 и −10. Домен CARD (от англ. caspase activation and recruitment domain - «домен активации и рекрутирования каспазы») участвует во взаимодействии адаптера RAIDD с прокаспазой-2.
Посредством рецепторов смерти могут быть активированы три инициирующие каспазы: −2; −8 и −10. Активированные инициирующие каспазы далее участвуют в активации эффекторных каспаз.








