В.И. Вершинин, Т.В. Антонова, С.В. Усова
П Р А К Т И К У М
ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Часть 1
У ч е б н о е п о с о б и е
Издание ОмГУ Омск 1998
УДК 543.42
В.И. Вершинин, Т.В. Антонова, С.В. Усова. Практикум по аналитической химии: В 2 ч.: Учебное пособие. Ч. 1. Омск: Омский госуниверситет, 1998. 176 с.
Пособие включает описания лабораторных работ по курсу аналитической химии (раздел «Химические методы анализа») и методические рекомендации по их выполнению. Приведены теоретические сведения, необходимые для самостоятельной работы студентов, подготовки к практическим занятиям и семинарам. Даны примеры расчета химических равновесий, используемых в анализе, а также расчетные задачи, в том числе нетрадиционные. В приложения входит справочный материал (константы равновесий, статистические таблицы и т.п.). Пособие соответствует государственному стандарту специальности 011000 и типовой программе курса. Перечень лабораторных работ и практических занятий составлен на основе учебного плана ОмГУ для студентов-химиков дневной формы обучения.
Печатается в соответствии с решением Ученого Совета химического факультета ОмГУ от 24.02.98.
ISBN 5-7779-0120-4 © Омский госуниверситет, 1998
Введение для преподавателей
Лабораторный практикум по аналитической химии выполняется всеми студентами специальности 011000 - Химия, а также (в меньшем объеме) студентами некоторых других специальностей. Как правило, в университетах этот предмет изучают студенты второго курса в течение двух семестров. Так, в ОмГУ студенты-химики очной формы обучения еженедельно в течение двух четырехчасовых занятий выполняют лабораторные работы, решают расчетные задачи, участвуют в семинарах и других формах учебного процесса. Для них необходима постоянно обновляемая методическая литература. Однако в отличие от «классических» учебников [1-3], которые сохранили методическую ценность, но уже не соответствуют современному уровню аналитической химии как науки, новейшие учебники по этой дисциплине (например, [4-7]) не содержат описаний лабораторных работ и методических указаний к ним. Специальные пособия к лабораторному практикуму издавались в нашей стране лишь отдельными вузами, причем давно и малыми тиражами. Опыт преподавания аналитической химии показал, что значительно удобнее использовать единое пособие вместо десятка несогласованных между собой задачников, практикумов, справочников и т.п. Кроме описания лабораторных работ, контрольных вопросов к ним, методических рекомендаций по выполнению работ и оформлению отчетов, в данной книге содержатся расчетные задачи и примеры решений. Приведены справочные таблицы, дополняющие известный справочник Ю.Ю.Лурье [8].
Предлагаем некоторые теоретические сведения, которые, на наш взгляд, необходимы для подготовки к практическим (расчетным) занятиям, но недостаточно четко изложены в наиболее распространенных отечественных учебниках по аналитической химии. Однако настоящее пособие не охватывает всей программы университетского курса аналитической химии и не может заменить учебник или конспект лекций. В частности, в нем нами не рассмотрен расчет кривых титрования, поскольку этот материал подробно освещен в учебниках, а также в недавно вышедшем пособии [9].
В практикуме приведены примеры расчета некоторых равновесий с помощью компьютерных программ, созданных в ОмГУ [10] и успешно используемых в ряде вузов; они могут быть переданы заинтересованным кафедрам.
В пособие не включены учебный план практикума и вопросы к коллоквиумам, поскольку они специфичны для каждого вуза. Соответствующие материалы для студентов ОмГУ изданы в 1997 г. [11]. Первая часть пособия, посвященная химическим методам анализа, должна использоваться в осеннем семестре, вторая часть будет посвящена инструментальным методам анализа, разделению и концентрированию микропримесей, методам идентификации веществ - т.е. материалу весеннего семестра. Все материалы переработаны в 1997-1998 гг. в соответствии с требованиями государственного стандарта и нового учебного плана ОмГУ, а также с учетом наших исследований по методике преподавания химических дисциплин в вузах.
Отбирая и перерабатывая известные лабораторные работы для этого практикума и составляя новые работы, мы руководствовались следующим:
а) принципиальные основы и химизм метода должны быть достаточно просты и очевидны, а необязательные частности нежелательны (отвлекают студента). Поэтому в качестве объектов анализа во всех работах предлагаются модельные растворы и сухие смеси солей, но не реальные материалы природного или технического происхождения, анализ которых потребовал бы длительной и многостадийной пробоподготовки. Такие материалы, с нашей точки зрения, должны стать учебными объектами в ходе изучения будущим аналитиком соответствующих спецкурсов и выполнения спецпрактикумов;
б) принципы и возможности методов анализа можно демонстрировать на ограниченном числе объектов определения. Сопоставление точности (трудоемкости, длительности, селективности и т.п.) методик особенно наглядно при сопоставлении различных методик определения одного вещества. Поэтому мы часто предлагаем студентам определять одни и те же компоненты в нескольких лабораторных работах (например, железо в работах по гравиметрии, комплексонометрии, перманганатометрии, хроматометрии и спектрофотометрии);
в) появление в заводских и других лабораториях сложных и полностью автоматизированных аналитических приборов зачастую приводит к падению требовательности при формировании системы специфических умений и навыков (например, взвешивания, фильтрования, титрования, оценивания погрешностей и т.п.). Мы не согласны с этим, и наша позиция отражена в отборе классических методик, на которых студент может наилучшим образом освоить технику работы в лаборатории. За исключением компьютеров, практикум не рассчитан на использование автоматизированных приборов[1], которые для начинающего являются лишь «черными ящиками»;
г) лабораторный практикум и расчетные занятия должны ставить перед студентом проблемные ситуации (например, выбор условий анализа), из которых он может самостоятельно выйти только с помощью ранее усвоенных теоретических знаний, тем самым закрепляя и проверяя их. Поэтому при описании лабораторных работ в ряде случаев сознательно не указывается, с каким индикатором провести титрование или на какой длине волны строить градуировочный график, а предлагается сделать выбор самому (вплоть до самостоятельной разработки методики) и обосновать его в отчете. Выбор реагентов или условий анализа на основании известных теоретических положений и справочных данных является основным содержанием нетрадиционных расчетных задач, приведенных в настоящем пособии. Принципы конструирования таких задач и рекомендации по использованию их в учебном процессе по аналитической химии рассмотрены нами ранее [12]. Аналогичный подход к отбору содержания и формулировкам задач по общей химии использован О.С. Зайцевым [13]. Естественно, наша позиция по отбору объектов анализа для студенческого практикума, объектов определения и методик анализа разделяется не всеми специалистами в данной области и не может считаться единственно правильной.
Надеемся, что учебное пособие будет полезно не только студентам ОмГУ, но и преподавателям и студентам других вузов. Будем рады получить их замечания и предложения, направленные на улучшение этой книги и методики преподавания аналитической химии в целом. Сделать это можно с помощью электронной почты: e-mail [email protected].
В подготовке рукописи к изданию большое значение имела техническая помощь ряда сотрудников и студентов ОмГУ. Авторы благодарны специалистам различных вузов за ценные советы, в том числе кандидатам наук Э.М. Анфингеру, И.В. Власовой, И.А. Никифоровой, И.И. Медведовской, Е.А. Петрук. Выражаем глубокую признательность рецензенту - зав.кафедрой аналитической химии Воронежской государственной технологической академии, заслуженному деятелю науки и техники РФ, докт. хим. наук, проф. Я.И. Коренману за сделанные рекомендации и замечания.
Правила взвешивания
на двухчашечных демпферных аналитических весах [2]
Меры предосторожности
1. Аналитические весы - очень тонкий, сложный и дорогой прибор. Работайте осторожно и поодиночке. В весовой нежелательны разговоры, резкие движения, не должно быть яркого освещения. Категорически запрещается сдвигать весы с места.
2. Работайте на весах, постоянно закрепленных за вами; берегите их, не пытайтесь чинить или настраивать весы самостоятельно. Все взвешивания, относящиеся к одному анализу, выполняются на одних и тех же весах (весы и соответствующие им наборы гирек пронумерованы).
3. Запрещается взвешивать грузы с массой больше 100 г, горячие или очень холодные, громоздкие или грязные предметы. Тигли с температурой, отличной от комнатной, предварительно выдерживают в эксикаторе не менее 20 минут. Брать навеску можно только в бюксе, стакане, ложке или на часовом стекле. Запрещается брать навеску на бумаге или кальке, а тем более прямо на чашке весов.
4. Обычная погрешность определения массы на аналитических весах - 0,0002 г. Взвешивания, не требующие большой точности, на аналитических весах не производятся.
5. Взвешивание концентрированных кислот, щелочей и других агрессивных веществ опасно, поскольку попадание их на поверхность чашки выводит весы из строя. Бюкс с агрессивным материалом взвешивают в закрытом виде, вместе с крышкой. Если необходимо добавлять сыпучие материалы или жидкости в бюкс, а также отбирать избыток взвешиваемого материала из него, то это делают специальным шпателем вне весов!
6. Нагружать или разгружать чашки и даже касаться аналитических весов можно только после их арретирования, т.е. тогда, когда чашки не висят на качающемся коромысле, а стоят на специальных опорах. Открывать арретир (поднимать чашки) поворотом соответствующей ручки и вновь арретировать весы следует медленно и осторожно.
Устройство весов и подготовка к взвешиванию
7. До начала взвешивания проверьте, включен ли прибор в сеть, не осталась ли случайно (с прошлого взвешивания) какая-либо нагрузка на чашках, не упали ли со своих мест миллиграммовые кольца. Откройте арретир и проверьте: «стрелка» - (т.е. тень на светящейся шкале вейтографа) должна быть отчетливо видна. После нескольких колебаний она должна установиться на нулевом делении в центре шкалы. При небольшом отклонении стрелки от нуля можно сместить саму шкалу поворотом ручки на передней панели. Если это не удается или стрелка плохо видна, обратитесь к лаборанту. Когда весы арретированы (выключены), шкала не светится.
8. Принцип работы данных весов заключается в уравнивании масс на обоих чашках, при этом любые предметы помещают в центр левой чашки, а граммовые гирьки - в центр правой. Миллиграммовые кольца выставляют также справа: причем кольца массой в сотни миллиграммов (0,1 г, 0,2 г и т.д.) нагружают с помощью внешнего лимба с соответствующими делениями, а кольца массой в десятки миллиграммов - с помощью внутреннего. Вращайте лимбы плавно, без усилий.
9. При взвешиваниях стрелку не надо выводить на ноль, достаточно, чтобы она оставалась в пределах шкалы. Отклонение стрелки показывает миллиграммы (крупные деления шкалы с 0 до 10) и десятые доли миллиграмма, которые отсчитывают по мелким делениям шкалы. При взвешивании показания по шкале следует добавлять к массе выставленных гирек и колец, если стрелка уходит влево, и вычитать, если стрелка уходит вправо. Например, предмет уравновешен гирьками в 5 г и 1 г, кольцами внешнего лимба на 700 мг, кольцами внутреннего лимба на 30 мг, а стрелка ушла влево и стоит ровно на шестом большом делении. Масса этого предмета = 6,7360 г.
10. До работы проверьте чувствительность весов: для этого установите с помощью внутреннего лимба нагрузку в 10 мг (на коромысло должно опуститься одно из колец), откройте арретир и проверьте: стрелка должна уйти влево и остановиться на делении «10» шкалы. Допустимо, чтобы при такой проверке стрелка оказалась в пределах от 9 до 11, в противном случае обратитесь к лаборанту.
Взвешивание
11. Следует заранее взвесить пустую тару (или другой взвешиваемый предмет) на технических весах (с точностью до 0,1 г), это ускорит анализ в целом.
12. При закрытом арретире предмет с неизвестной массой поставьте на левую чашку, гирьки и кольца в соответствии с результатами предварительного взвешивания на технических весах - на правую, затем закройте дверцы весов. Взвешивать при открытых дверцах нельзя. Гирьки следует брать пинцетом, придерживая его ножки как можно ближе к гирьке.
13. Откройте арретир. Если стрелка совсем уходит за границы шкалы - закройте арретир и измените нагрузку справа с помощью лимба. Эту операцию повторяют до тех пор, пока стрелка не останется в пределах шкалы.
14. Сразу же после подсчета массы запишите результаты в лабораторный журнал. Запись на листочках, фильтрах и т.п. не допускается!
15. После окончания взвешивания установите гирьки на свои места в ящике и снимите кольца, выставив оба лимба на ноль. Закройте дверцы, выключите весы. После работы сдайте ящик с разновесом лаборанту.
Оформление отчетов по лабораторным работам
1. Все отчеты по лабораторным работам должны находиться в одном лабораторном журнале. Помещать туда же конспекты лекций, решения задач и т.п. не рекомендуется. Журнал должен быть подписан (фамилия, группа, уч.год). Вести журнал следует очень аккуратно. Черновые записи можно делать в этом же журнале (в конце тетради), а не на отдельных листах.
2. Первые две страницы оставьте для регистрации сдачи коллоквиумов, расчетных заданий, выполнения лабораторных работ и контрольных задач. Выполнение каждой лабораторной работы (с указанием даты выполнения) и получение правильного ответа по контрольной задаче должны быть подтверждены подписью лаборанта; оценки по коллоквиумам и расчетным заданиям на эту же страницу заносит преподаватель.
3. Оформляя отчет о любой работе, следует:
а) указать дату выполнения работы, ее порядковый номер и название;
б) записать цель работы и перечислить основные разделы (части). Если вы получили индивидуальное задание, запишите его. Если работа состоит из нескольких частей (А,Б...), то каждая часть оформляется отдельно, и делаются общие выводы;
в) привести все химические реакции - как основные, так и возможные побочные. Выписать формулы, по которым надо будет рассчитывать результаты анализа;
г) привести заранее сделанные расчеты, обосновывающие методику анализа. Например, в случае гравиметрического анализа следует рассчитать рекомендуемую массу навески, рН осаждения, величину потерь при промывании. В работах по объемному анализу следует обосновать выбор индикатора и т.д. Такие «домашниезадания» в настоящем пособии выделены курсивом.
д) кратко описать ход анализа с обязательным обоснованием операций. Однако полностью переписывать методические указания или соответствующие страницы учебника не следует! Если в методических указаниях по данной работе содержались вопросы, в вашем отчете должны быть ответы на каждый из них;
е) привести все технические результаты (данные по взвешиваниям на аналитических весах, результаты параллельных титрований и т.д.). Такие записи удобно вести, заранее подготовив таблицу, в которую на занятии останется только вписать цифры. Технические результаты записываются с учетом погрешности измерений, в частности цены деления;
ж) дать расчет результатов анализа. При этом полученные результаты не забывайте округлять с учетом количества значащих цифр в исходных данных. Результат расчета не может быть точнее исходных данных (результатов измерений)!
з) если проводились параллельные опыты, включить в отчет статистическую обработку данных традиционным методом. Результат анализа приведите в виде доверительного интервала, рассчитанного для надежности 0,95; оцените также величину Sr.
и) если вам станет известно истинное содержание определяемого компонента в вашей пробе, рассчитать относительную погрешность и указать ее возможные причины;
к) записать собственные выводы по работе. В них может содержаться оценка точности, трудоемкости, возможной области применения соответствующей методики, сравнение разных методик или разных методов анализа.
4. При проверке отчета преподаватель не только контролирует точность и полноту записей в лабораторном журнале, но и, как правило, задает дополнительные вопросы по выполненным вами операциям и расчетам, по сделанным выводам; предлагает объяснить химизм процессов и т.п. Поэтому перед собеседованием требуется повторить необходимый теоретический материал.
5. ЛАБОРАТОРНЫЕ РАБОТЫ ПО ХИМИЧЕСКИМ МЕТОДАМ АНАЛИЗА
При разной кислотности
| Среда
| Окраска индикатора
|
| Сильнокислая
| Желтая
|
| Слабокислая
| Зеленая
|
| Нейтральная
| Зеленовато-синяя
|
| Слабощелочная
| Синяя
|
| Сильнощелочная
| Фиолетовая
|
До начала выполнения любого анализа следует нейтрализовать растворитель (точнее: примеси в нем), пользуясь тем же индикатором, с которым собираются проводить основное титрование. Только после этого можно вносить в растворитель навеску анализируемого материала, титровать ее и т.д.
Веществом, по которому проводят стандартизацию титранта, является безводный карбонат натрия. Это соединение негигроскопично, хорошо перекристаллизуется, имеет строго постоянный состав, легко растворяется в безводной СН3СООН. Обычно употребляют реагент марки х.ч., в случае необходимости его дополнительно сушат. При стандартизации титранта по карбонату натрия происходят реакции:
Na2CO3 + 2 CH3COOH = 2 CH3COO- + 2Na+ + H2O + CO2
HClO4 + CH3COOH = CH3COOH2+ + ClO4-
CH3COOH2+ + CH3COO- = 2 CH3COOH
2Na+ + ClO4- = 2 NaClO4
Cуммарно: Na2CO3 + 2 HClO4 = H2O + CO2 + 2 NaClO4
А. Стандартизация раствора НСlO4 в СН3СООН
1. В чистый и сухой стакан на 100 мл налейте 30 - 40 мл ледяной уксусной кислоты, добавьте 4 - 5 капель индикатора и под тягой осторожно вводите из бюретки заранее приготовленный раствор НСlО4 в том же растворителе по каплям до перехода окраски индикатора из фиолетовой в зеленовато-синюю, сравнивая окраску со шкалой-свидетелем. Нейтрализованный таким образом растворитель используется и в последующих частях работы. Выпишите характеристики этого растворителя из таблицы в приложении 2 и сравните с аналогичными характеристиками воды.
2. В две совершенно чистые и сухие колбы для титрования объемом 50 - 100 мл возьмите навески карбоната натрия х.ч. примерно по 100 мг с точностью до 0,1 мг. Каждую навеску залейте 10 - 15 мл приготовленного растворителя, содержащего индикатор. Слегка подогрейте растворы под тягой до растворения навески, но ни в коем случае не кипятите.
3. Из бюретки на 25 мл с хорошо пришлифованным краном под тягой осторожно оттитруйте пробы раствором НСlО4 в ледяной уксусной кислоте (примерно 0,1 н.). До перехода окраски в чисто синюю можно титровать быстро, а после - по каплям, до зеленовато - синего оттенка.
4. Нормальную концентрацию титранта рассчитайте по каждому титрованию отдельно и усредните. При расчете учтите, что эквивалент карбоната натрия должен быть равным половине молярной массы, так как молекула Na2CO3 при взаимодействии с растворителем образует два ацетат-иона, которые затем реагируют с двумя протонами.
5. Оттитрованные пробы не выливайте. Их можно использовать как нейтрализованный растворитель при выполнении следующих частей работы. Если же они явно перетитрованы (чисто зеленая окраска), то избыток хлорной кислоты можно нейтрализовать несколькими каплями воды.
ИОДОМЕТРИЯ
К практическим занятиям
Практическое занятие № 1
Готовясь к данному практическому занятию, проработайте материал по учебникам [1, с.58-61; 3, с.30-31; 9, с.3-8 и др.]. Обратите внимание на приведенные ниже примеры типовых расчетов и вопросы для самоконтроля.
Теоретические сведения
Оценка абсолютной погрешности. Любая методика анализа включает получение исходных данных - массы пробы, объема титранта, силы тока, интенсивности излучения и т.п., по которым в дальнейшем будет рассчитываться результат анализа. Исходные данные должны быть записаны в лабораторный журнал с учетом погрешности соответствующих измерений. Принято записывать результат измерения так, чтобы предпоследняя цифра не вызывала сомнений, а последняя - соответствовала абсолютной погрешности данного измерения. Так, если объем титранта записан в виде 24 мл, то это означает, что измерение объема проведено с погрешностью 1 мл; если же пользовались более точными приборами, с погрешностью измерения порядка 0,1 мл, то запись должна быть сделана в виде 24,0 мл. Как же оценить абсолютную погрешность измерения (взвешивания, измерения объема и т.п.)? По определению, абсолютная погрешность (Dх) равна разности между результатом измерения (х) и истинным значением измеряемой величины (m):
DХ= Х - m. (1)
Для того, чтобы рассчитать DХ по формуле (1), надо знать m - истинное значение измеряемой величины, а оно, как правило, неизвестно. Для оценки можно применить другой прибор или другую методику измерений, для которых погрешность измерений пренебрежимо мала. Результат, полученный с помощью таких «образцовых» или «эталонных» средств измерения, считают истинным значением этой величины. Если же эталонных способов измерения в нашем распоряжении нет, для приблизительной оценки DХ используют следующие приемы:
а) измеряют другой образец (c точно известным значением m), считая, что абсолютные погрешности измерений для обоих образцов будут одинаковыми;
б) проводят несколько повторных измерений исследуемого объекта. Абсолютная погрешность не может быть намного меньше расхождения между параллельно полученными результатами. Так, если на одних и тех же весах одна и та же масса оказалась при повторных взвешиваниях: 0,6547 г; 0,6608 г; 0,6531 г; 0,6472 г, то с учетом разброса результатов следует считать, что абсолютная погрешность этих весов является величиной порядка 0,01 г, а не 0,0001 г, как должно быть для аналитических весов. Отметим, что оценка абсолютной погрешности измерений по их воспроизводимости дает заниженное значение DХ, не включающее систематическую составляющую этой погрешности; не исключено, что при сравнении с эталоном абсолютная погрешность весов оказалась бы еще большей, например 0,10 г;
в) самый простой и распространенный в практике способ оценки DХ- по цене деления измерительного прибора. Так, отмеряя 250 мл раствора с помощью цилиндра, у которого деления нанесены через 10 мл, мы можем ошибиться даже на 10 мл, а следовательно, должны записать объем как 0,25 л или 2,5·102 мл, но не «250 мл»! Оценка DХ по цене деления дает нижний предел абсолютной погрешности, поскольку не учитываются ни воспроизводимость измерений, ни их систематическая ошибка.
Относительная погрешность и значащие цифры. Относительная погрешность представляет собой отношение абсолютной погрешности к самому результату измерения или расчета. Обычно она выражается в процентах:
DХотн= 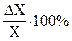 (2)
(2)
Если результат измерения записан верно (см. примеры 1-2), то для оценки DХотн берут отношение единицы последнего разряда к самому записанному числу. Запись «50 г» указывает на измерение массы с относительной погрешностью 2 %, а масса «49,978 г» записана (измерена) с относительной погрешностью 0,002 %. Из этого примера видно, что чем больше значащих цифр в записанном результате измерения, тем ниже относительная погрешность и, следовательно, тем точнее данные. Поэтому для приблизительной и быстрой оценки точности данных достаточно подсчитать число значащих цифр. Разумеется, все сопоставляемые величины должны быть записаны правильно, т.е. с учетом абсолютной погрешности измерений. Нельзя ни прибавлять лишние значащие цифры, ни терять точность измерений при необоснованных округлениях.
Значащими называют все цифры, кроме 0, а также 0, если он стоит после других значащих цифр. Не путайте значащие цифры с десятичными знаками (цифрами после запятой); при подсчете количества значащих цифр в числе положение запятой не имеет значения. Так, в числе 0,0020 две значащие цифры и четыре десятичных знака, а в числе 200 - три значащих цифры и нет десятичных знаков. При подобных подсчетах не учитываются цифры в степенных множителях, например, в числе 6,023·1023 четыре значащих цифры (в предэкспоненциальной части).
Сопоставляя результаты измерений по числу значащих цифр, можно находить более точные и менее точные данные даже в том случае, когда сопоставляются совершенно разнородные величины, например, объемы, массы и значения силы тока (см. пример 3).
По числу значащих цифр можно и прямо оценивать относительную погрешность: одна значащая цифра указывает, что соответствующая величина измерена или рассчитана с относительной погрешностью от 10 до 100 %; две значащие цифры указывают на относительную погрешность от 1 до 10 %; три - от 0,1 до 1 % и т.д.
Примеры решения типовых задач
1. Из бюретки на 25 мл с ценой деления 0,1 мл отмерили ровно восемь миллилитров раствора. Как правильно записать отмеренный объем: 8 мл; 8,0 мл; 8,00 мл? Как записать тот же объем, если для отмеривания раствора использовали цилиндр с ценой деления 1 мл?
Решение. Запись 8,00 мл, указывающая на абсолютную погрешность порядка 0,01 мл, совершенно неправильна. Так как цена деления бюретки равна 0,1 мл, абсолютная погрешность не может быть меньше. Если считать, что абсолютная погрешность соответствует цене деления, то правильный ответ при измерении объема бюреткой - 8,0 мл. При записи результата как «8 мл» мы, скорее всего, зря потеряем точность измерения, подобное округление не рекомендуется. А вот при измерении того же объема цилиндром эта запись будет совершенно верной.
2. С помощью той же бюретки, что и в предыдущем примере, ведут титрование, надеясь определить концентрацию некоторого вещества с относительной погрешностью в 0,01 %. Возможно ли это?
Решение. Будем считать, что абсолютная погрешность соответствует цене деления бюретки - 0,1 мл. Если будет израсходован весь объем бюретки (25,0 мл), то относительная погрешность окажется равной 0,4%; измерить же объем раствора точнее, т.е. с относительной погрешностью 0,1% (а тем более 0,01%!) при использовании данной бюретки нельзя. Нам не удастся снизить относительную погрешность до требуемой величины и в том случае, если мы будем с помощью этой бюретки отмерять объемы, большие 25 мл, поскольку повторное заполнение бюретки приведет к соответствующему увеличению абсолютной погрешности.
Поскольку нельзя измерить с требуемой точностью объем титранта, не удастся добиться и желаемой точности определения концентрации. Дело в том, что концентрацию находят, умножая объем титранта на другие величины, а при умножении величин относительные погрешности складываются; т.е. относительная погрешность произведения не может быть меньше погрешности сомножителя.
3. Расставьте несколько величин в порядке возрастания точности их измерения: 0,002 м3; 920; 2100; 8100г; 2,10 мл; 2100,0; 2,0·105 мин.
Решение. Поскольку величины имеют разную размерность, а некоторые из них безразмерны, то мы можем сравнивать их только по относительной погрешности, считая, что все величины записаны правильно. Вместо расчета относительной погрешности можно просто подсчитать число значащих цифр. Для большей наглядности составим таблицу.
| Результат
измерения
| Абсолютная
погрешность
| Относительная
погрешность, %
| Число значащих цифр
|
| 0,002 м3
| ³0,001 м3
| ³50
| 1
|
| 920
| ³10
| ³1
| 2
|
| 2100
| ³1
| ³0,05
| 4
|
| 8100 г
| ³1 г
| ³0,01
| 4
|
| 2,10 мл
| ³0,01 мл
| ³0,5
| 3
|
| 2100,0
| ³0,1
| ³0,005
| 5
|
| 2,0·105 мин
| ³0,1·105 мин
| ³0,5
| 2
|
Следовательно, ряд должен быть составлен так: 0,002 м3; 2,0·105 мин; 920; 2,10 мл; 2100; 8100 г; 2100,0.
4. Масса анализируемого вещества определена на технических весах, она равна 25,6 г, а затем отобрали и взвесили на аналитических весах часть этой пробы: 0,2665 г. Вычислить оставшуюся массу пробы.
Решение. С точки зрения арифметики результат вычисления равен 25,3335 г. В этом случае получится, что точность наших знаний о массе пробы резко повысилась за счет арифметической операции, а это невозможно. Правильный результат - 25,3 г - получается путем округления. Тот же результат получится, если от 25,6 г отнять заранее округленную до десятых долей грамма массу отобранной части пробы, т.е. 0,3 г. В результате вычитания десятичных знаков столько же, сколько их в исходных данных, т.е. примерно та же абсолютная погрешность.
5. Масса тигля до прокаливания - 20,6473 г, после - 20,6420 г. Какова масса потерь при прокаливании, с какой относительной погрешностью она определена?
Решение. Масса потерь равна 20,6473 г - 20,6420 г = 0,0053 г, т.е. 5,3 мг. Относительная погрешность результата - около 2%, она гораздо больше, чем у исходных масс, хотя абсолютная погрешность примерно та же - 0,0001 г. Обратите внимание на этот пример: при сложении и вычитании число значащих цифр в результате может уменьшаться (или увеличиваться) по сравнению с исходными данными.
6. Масса жидкости 28,34 г, ее объем- 8,4 мл. Рассчитать плотность.
Решение. Для того чтобы найти плотность, надо разделить массу на объем. В результате деления надо оставить только две значащих цифры, как и в менее точном измерении объема. Отсюда 28,34 г: 8,4 мл = 3,4 г/мл. Нельзя просто переписывать результат, полученный на шкале микрокалькулятора, округление до необходимого количества значащих цифр обязательно!
7. Концентрация ионов водорода в растворе равна 2 М. Чему равен рН этого раствора (без учета коэффициентов активности)?
Решение. Так как рН =- lg[H+], а [Н+]=2, то следует взять логарифм этого числа. По микрокалькулятору он равен 0,30102999, по четырехзначным таблицам - 0,3010, по логарифмической линейке - 0,30. С учетом вышеизложенного правила lg2 надо округлить до одной значащей цифры, следовательно, рН = -0,3.
8. В справочнике указано значение константы ионизации (кислотной константы) синильной кислоты 5,0· 10-10, чему равен ее показатель?
Решение. По калькулятору логарифм вышеуказанного числа равен -9,3010299; следовательно, показатель равен 9,3010299. Округляем, оставляя две цифры в мантиссе (после запятой): рК = 9,30.
Пользуясь четырехзначными таблицами логарифмов, можно найти показатель несколько иначе: рК = m - lg n = 10 - lg 5,0 (10 - 0,70 = 9, 30. В последнем действии число 10 известно совершенно точно, число значащих цифр или десятичных знаков в подобных величинах вообще не учитывают!
Независимо от способа логарифмирования, в показателе константы после запятой (в мантиссе) оставляют столько значащих цифр, сколько их было в самой константе. Не следует считать, что рКа синильной кислоты составляет 9,3; отбрасывать ноль во втором знаке после запятой было бы грубой потерей точности.
9. Оцените погрешность, с которой в справочнике [8] указано значение константы устойчивости комплексного соединения бария с 8-оксихинолином.
Решение. В справочнике дана не константа, а ее логарифм, равный 2,07. Так как в мантиссе логарифма имелось две значащих цифры, столько же их будет в самой константе. Это соответствует диапазону относительной погрешности от 1 до 10 %.
Можно провести и более точный расчет. По калькулятору сама константа (антилогарифм) равна 117,48976. Но так как в мантиссе логарифма имелось две значащих цифры, значение константы также округляем до двух значащих цифр, тогда К = 1,2· 102. Относительная погрешность этой величины равна единице последнего разряда, деленной на само число (0,1/1,2), что составляет около 8 %.
Контрольные вопросы
1. Что такое абсолютная погрешность, относительная погрешность, в каких единицах они выражаются? Какие цифры называют значащими и как подсчитать их количество в некотором записанном числе - результате измерения?
2. С какой абсолютной и относительной погрешностью вы проводите обычно измерение объема раствора: а) с помощью мерной колбы на 200 мл; б) пипеткой на 5 мл, в) цилиндром на 1 литр? Насколько точно измерение массы анализируемой пробы на аналитических и на технических весах?
3. С какой относительной погрешностью вы знаете массу своего тела и свой рост? Какими факторами, по вашему мнению, определяется абсолютная погрешность этих данных: ценой деления измерительного прибора, его систематической погрешностью, случайными погрешностями в процессе измерения, изменением во времени самих измеряемых величин?
4. Обычно чем больше исходных данных приходится учитывать аналитику при расчете результата анализа, тем при прочих равных условиях хуже точность анализа. Почему?
5. C какой относительной погрешностью, судя по числу значащих цифр, известны молярные массы веществ? Учитывать ли их погрешность при расчете результатов анализа?
6. Сформулируйте известные вам по школьному курсу математики правила округления.
7. Запишите результат деления 1 на 300 с разной точностью – с одной, двумя и т.д. (до шести) значащими цифрами. Используйте запись вида m·10-n.
8. В таблице констант устойчивости комплексных соединений [8, с.328] для комплексов калия и кальция с этидендиаминтетрауксусной кислотой даны значения логарифмов констант, равные соответственно 0,96 и 10,59. Какая константа измерена с большей точностью? Ответ обоснуйте.
6.2. РАСЧЕТ ГЕТЕРОГЕННОГО РАВНОВЕСИЯ “ОСАДОК - РАСТВОР”
Практическое занятие № 2
Теоретические сведения
Расчет растворимости. Растворимость осадка АmВn, распадающегося на ионы
S = m+n 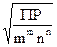 , (3)
, (3) 
где S - молярная концентрация вещества АmВn в насыщенном растворе; ПР - константа, называемая произведением растворимости (термодинамическая, концентрационная или условная, смотря по тому, для каких условий производится расчет). Избыток А или В извне не вводится, в противном случае формула (3) не подходит.
Растворимость осадка тем больше, чем больше ПР. Это положение строго выполняется для осадков с однотипной формулой, но может нарушаться при сравнении осадков различного типа, например АВ и АВ2. Для бинарного осадка АВ растворимость S равна 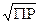 .
.
Произведение растворимости, как и другие константы, может выражаться через активности (ПРт), равновесные концентрации определенных ионов (ПРс) или через общие концентрации (суммарно для в



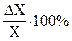 (2)
(2)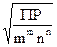 , (3)
, (3) 
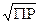 .
.


