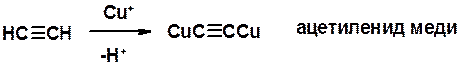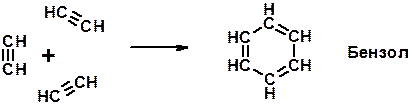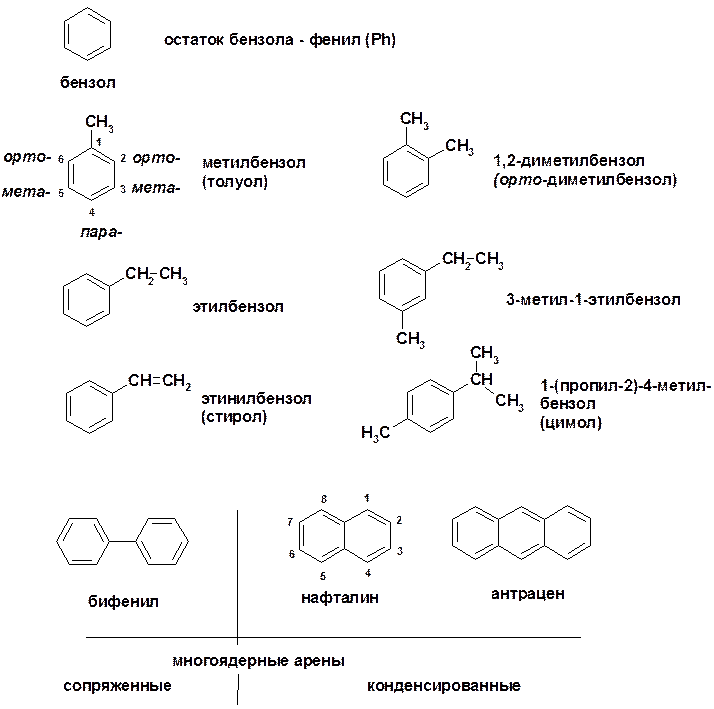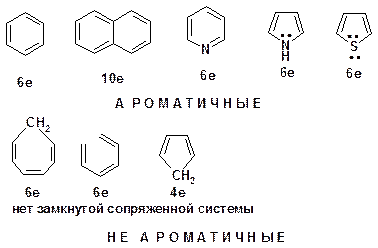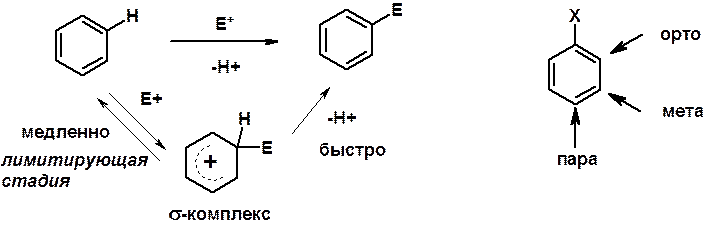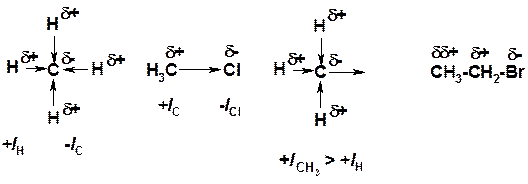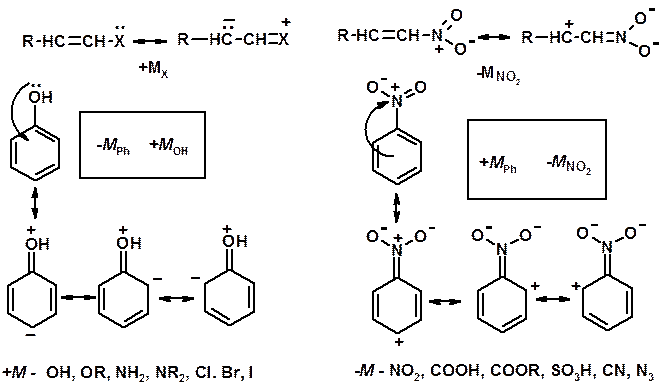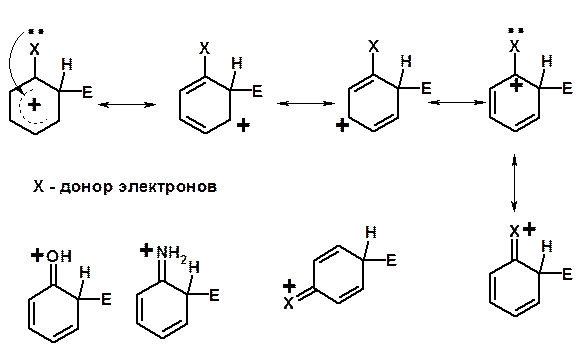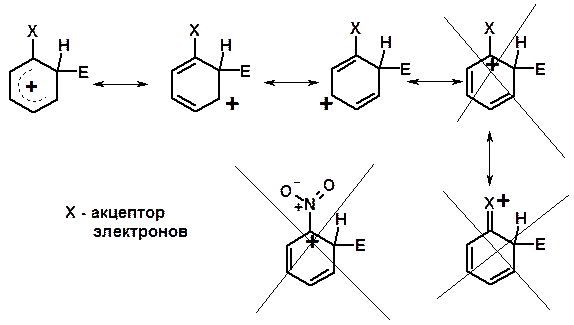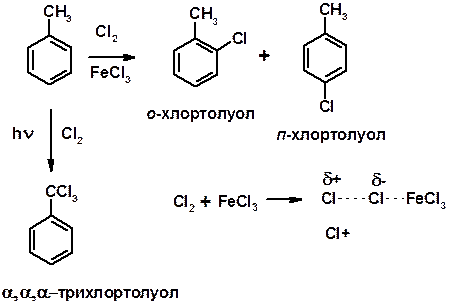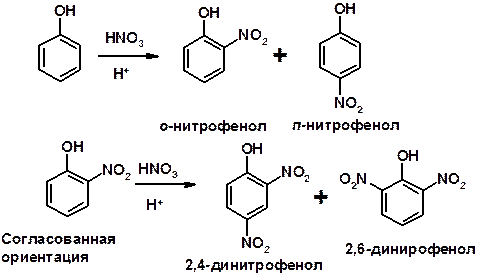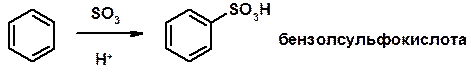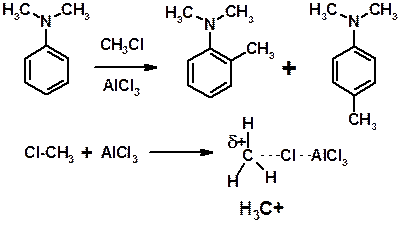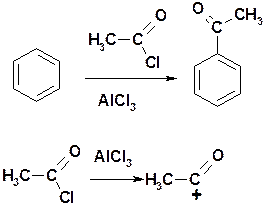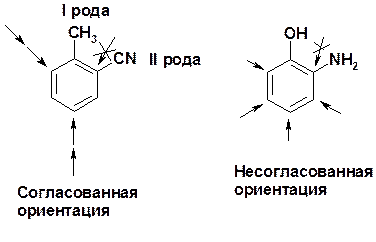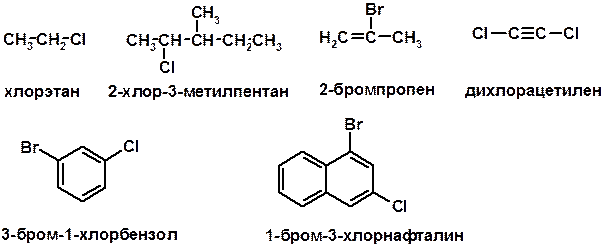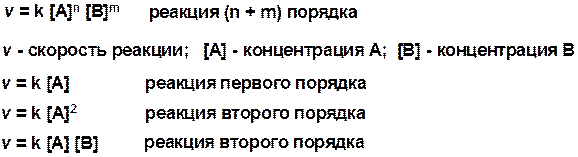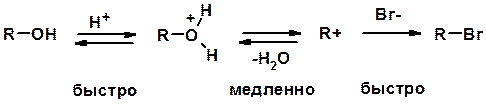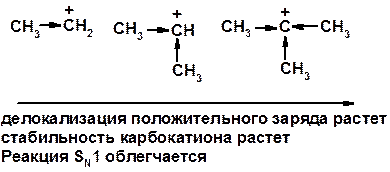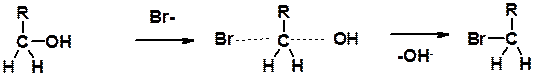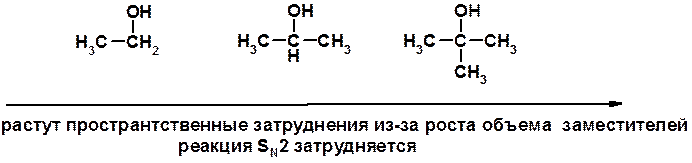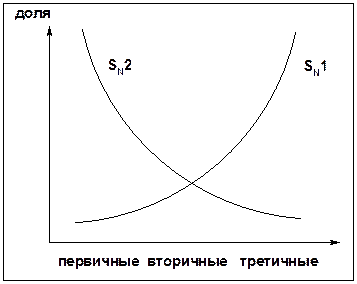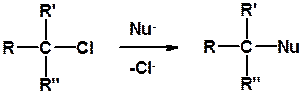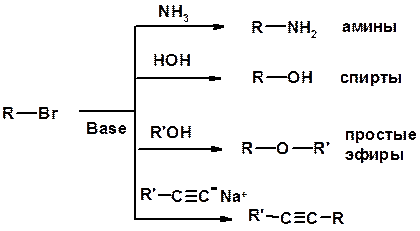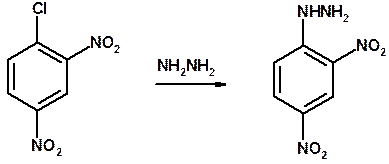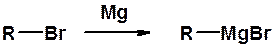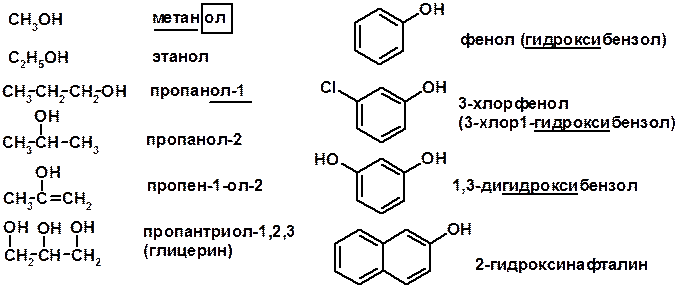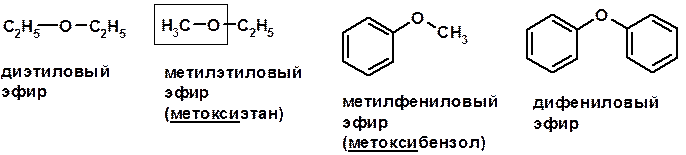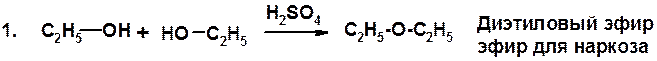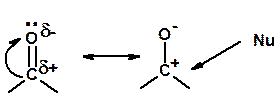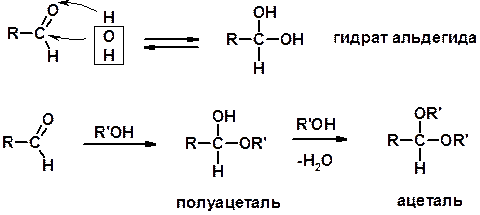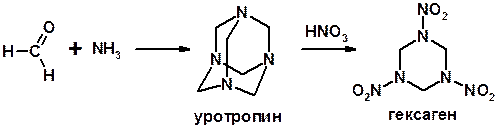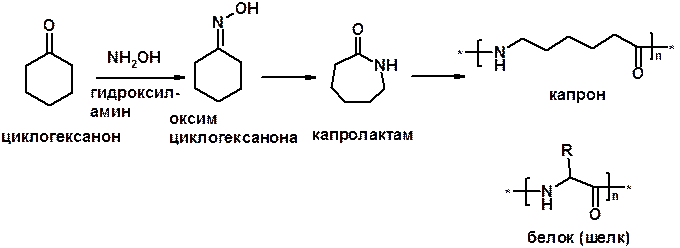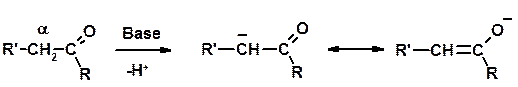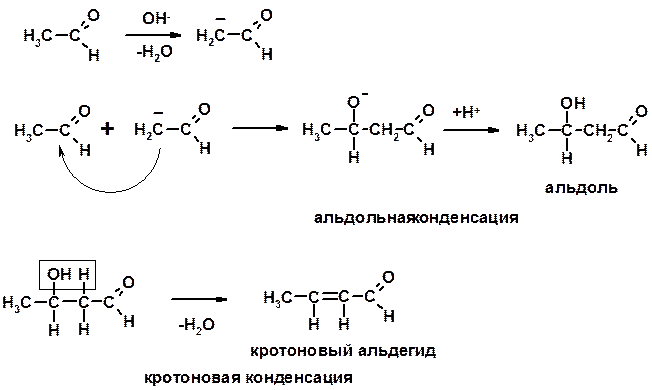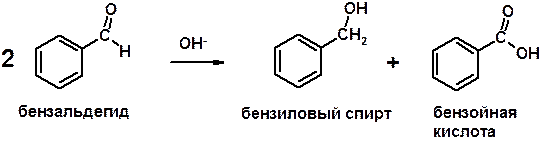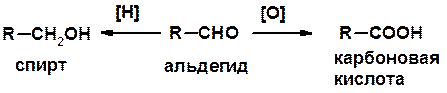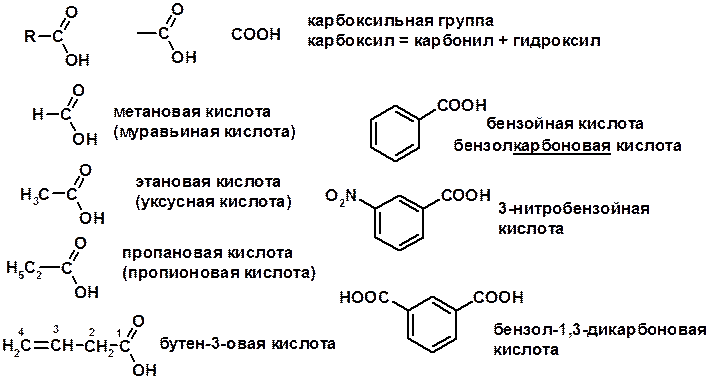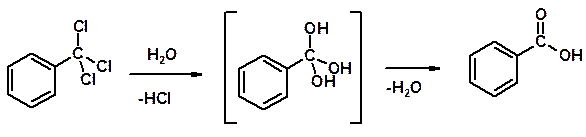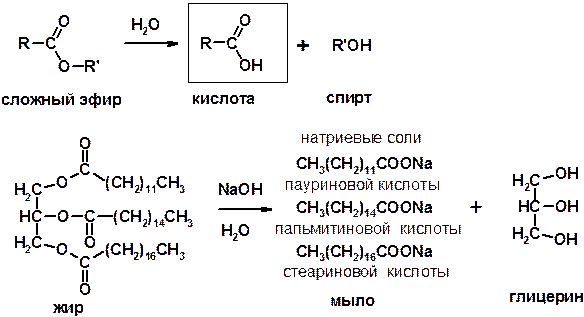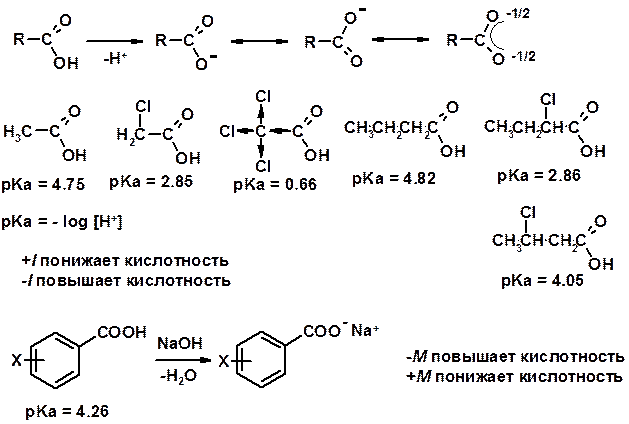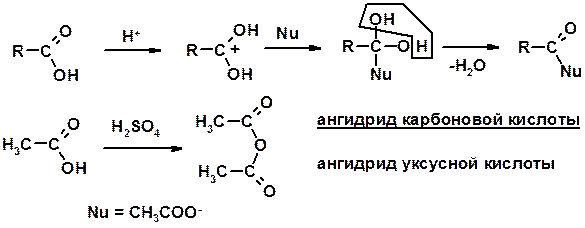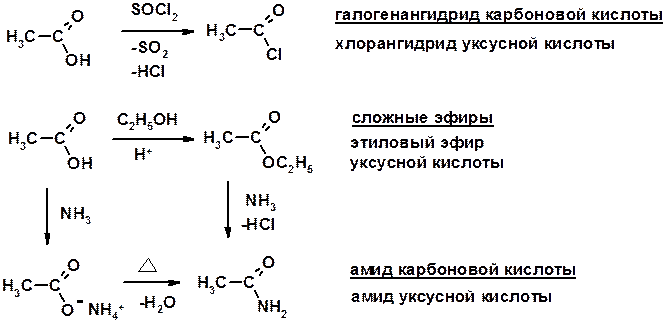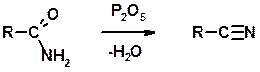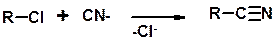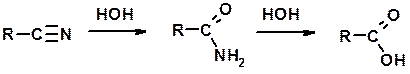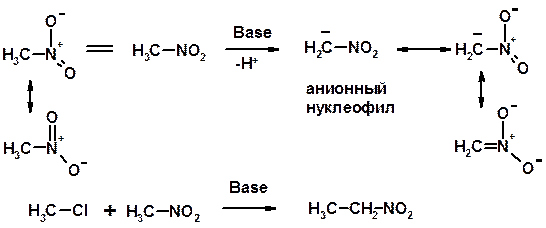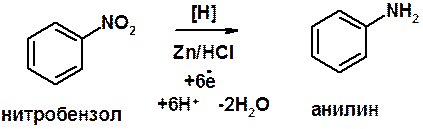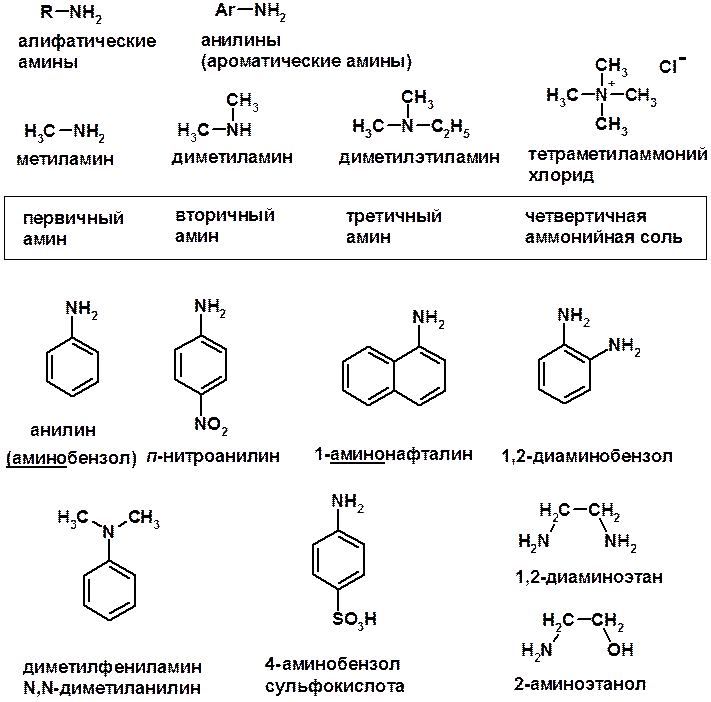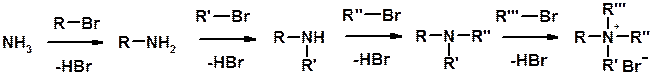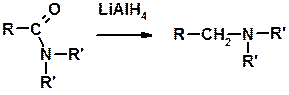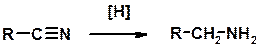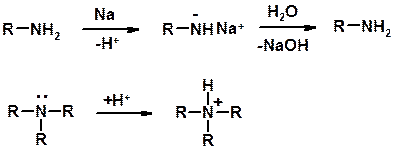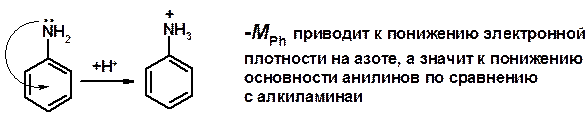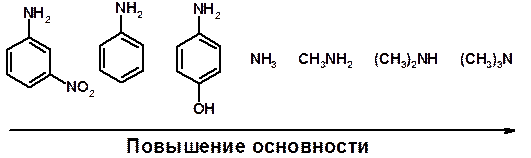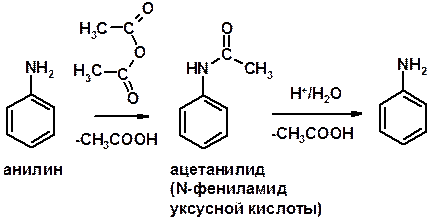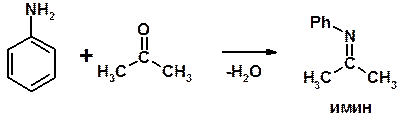Механизм реакции
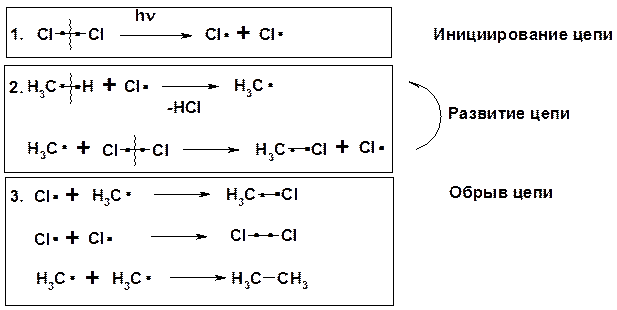
Сульфохлорирование
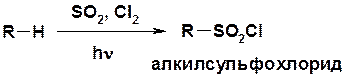
Cульфоокисление
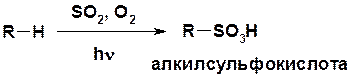
Нитрование
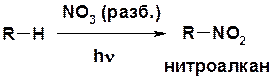
Горение
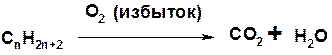
Управляемое окисление
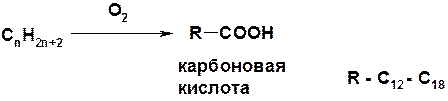
Циклоалканы
CnH 2 n
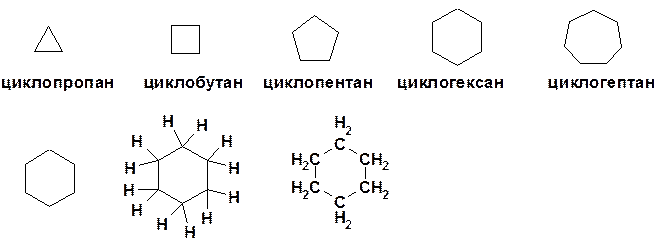
Получение
Внутримолекулярная реакция Вюрца
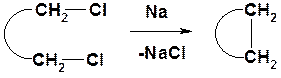

Хим. свойства см. алканы
Реакции присоединения (для напряженных циклов С3-С4)
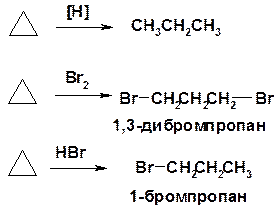
АЛКЕНЫ
С n H 2 n ненасыщенные углеводороды с двойной связью
Номенклатура -
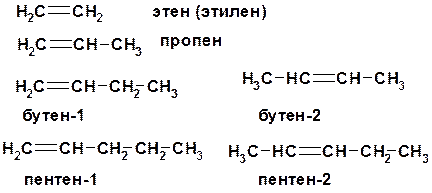
Двойная связь
sp 2 -гибридизация
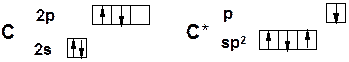
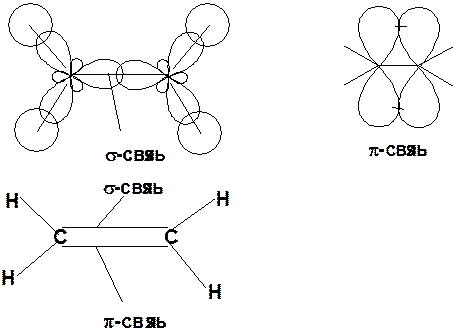
Пространственная изомерия относительно двойной связи
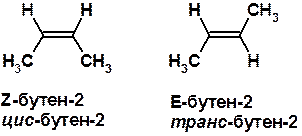
Способы получения
Дегидратация спиртов
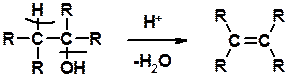
Дегидрогалагениерование галогеналканов
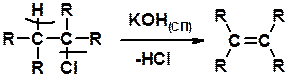
Дегалагениерование 1,2-дигалогеналканов
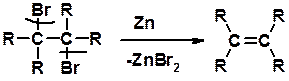
Дегидрирование алканов
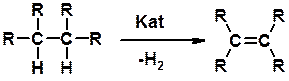
Химические свойства
Реакция присоединения
Гидрирование
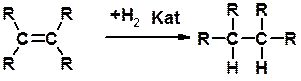
Присоединение галогеноводорода
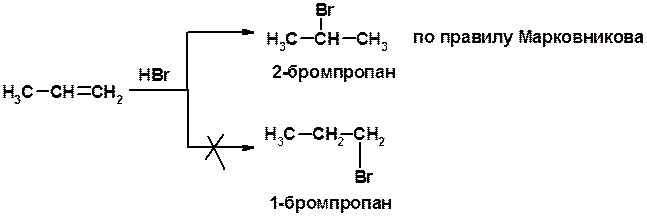
Гидратация
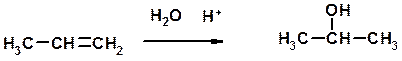
4. Окисление KMnO4
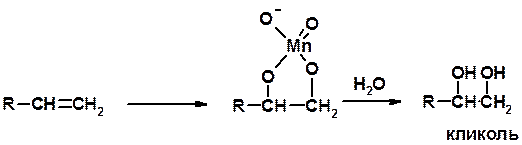
Озонолиз
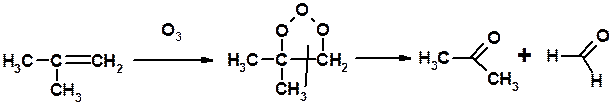
Алкадиены
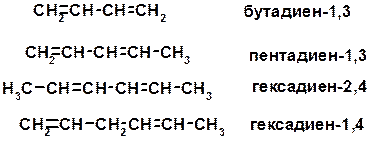
Классификация диенов
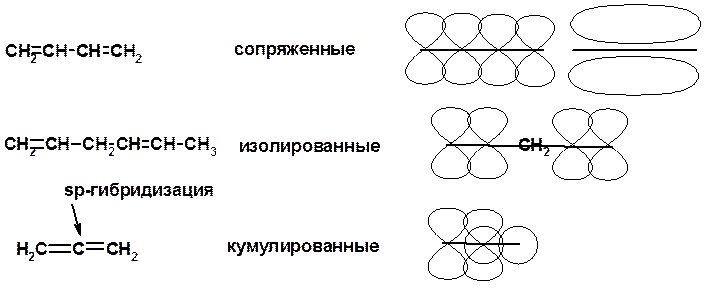
Особенности хим. свойства сопряженных диенов, по сравнению с алкенами
Присоединение
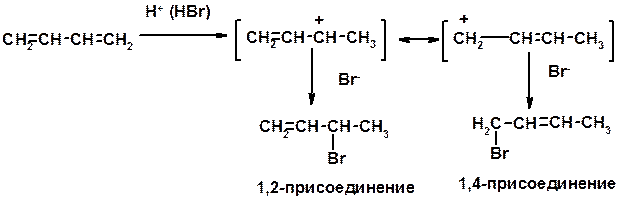
Диеновый синтез (реакция Дильса-Альдера)
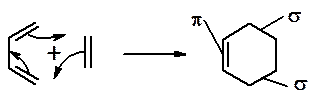 Из 3 -связей образуется новые 1 - и 2 s -связи
Из 3 -связей образуется новые 1 - и 2 s -связи
АЛКИНЫ
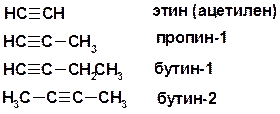
Sp -гибридизация углерода при тройной связи
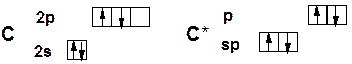
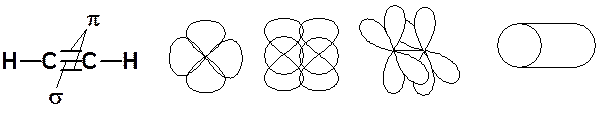
Методы получения
1. 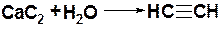
Дегидрогалогенирование 1,1- и 1,2-дигалогеналканов
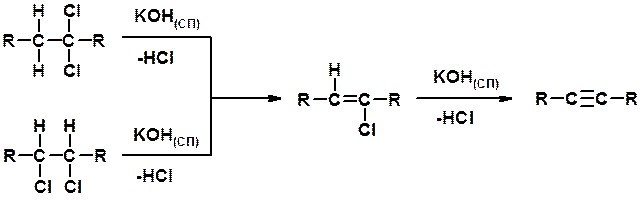
Химические свойства
Гидрирование
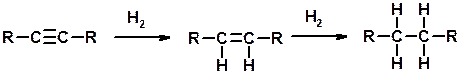
Галогенирование
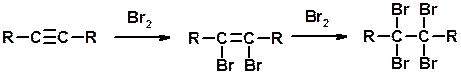
3. Гидрогалогенирование
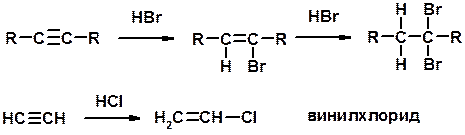
Винилирование
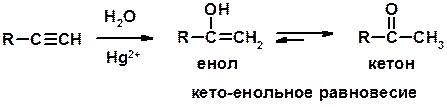
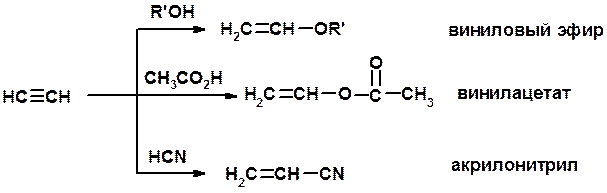
5. Кислотность алкинов с концевой тройной связью
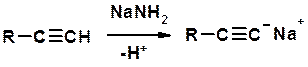 Соли алкинов – ацетилениды
Соли алкинов – ацетилениды
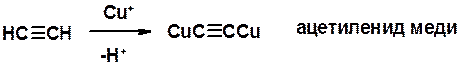
6. Циклизация
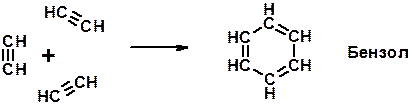
Ароматические углеводороды (арены)

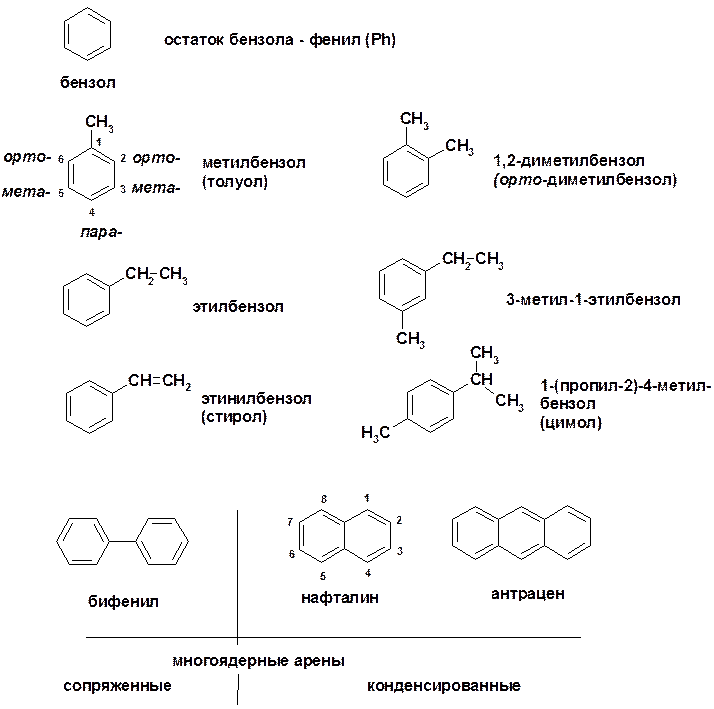
Углерод в ароматическом ядре – sp 2 -гибридизован
Принцип ароматичности – принцип Хюккеля
1) Замкнутая циклическая система сопряженных -электронов
2) Количество -электронов – 4 n +2 (n = 0, 1, 2...)
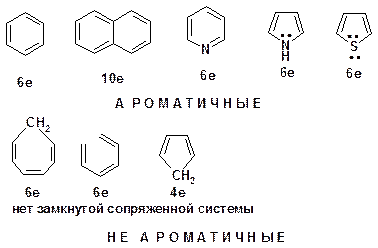
Химические свойства
Электрофилы (Е+) – акцепторы электронной плотности
E+ = R+ (H3C+) – карбокатионы, NO2+, Br+, SO3, и др.
Нуклеофилы (Nu-) – доноры электронной плотности
Nu- = R- (H3C-) – карбанион, ОН-, RO-, NH2-, Br-, HOH, RNH2 и др.
Электрофильное ароматическое замещение SEAr
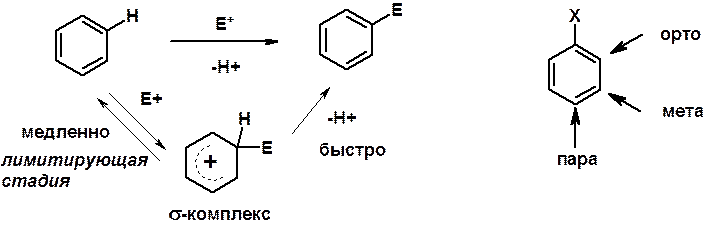
Влияние заместителей в бензольном кольце на реакцию SEAr
Электронные эффекты заместителей
Индуктивный эффект (I – эффект) – изменение распределения электронной плотности в молекуле из=за разницы электроотрицательности атомов.
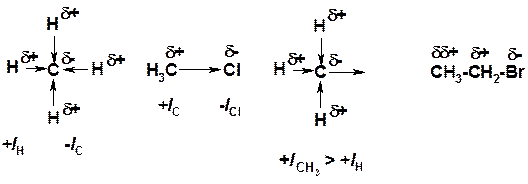
Мезомерный эффект (М – эффект) – возникает в сопряженных системах (заместитель связан с sp 2 - или sp -гибридизованным углеродом)
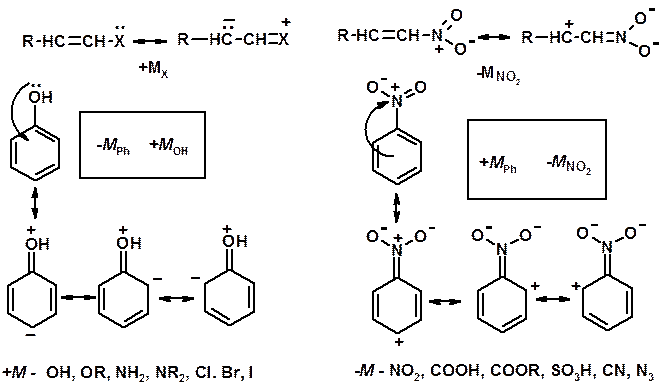
Заместители I рода – направляют реакцию в орто - и пара -положение
СН3 (R), OH, OR, NH 2, NR 2 (ускоряют реакцию), Cl, Br, I (замедляют)
+ I или + М - I, но + M
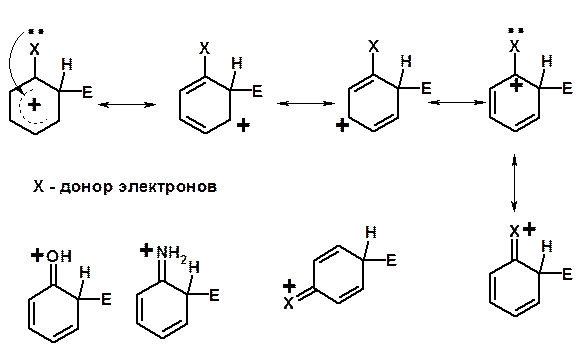
Заместители I I рода – направляют реакцию в мета -положение и замедляют реакцию
NO2, NO, СООН, COOR, SO3H, CN, N3, C С l3
- M и/или - I
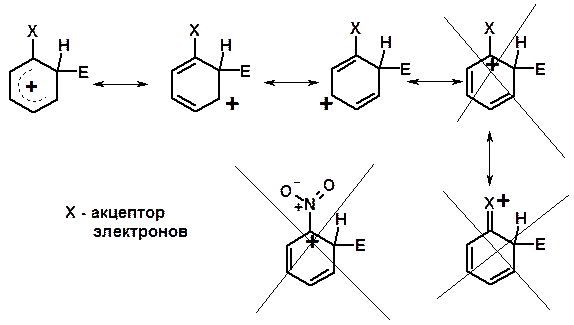
Хлорирование
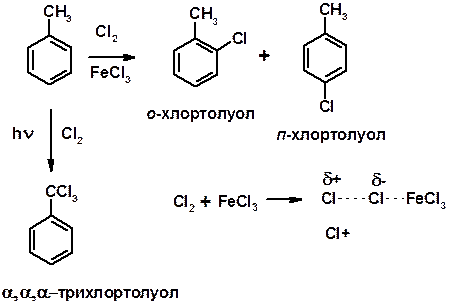
Нитрование
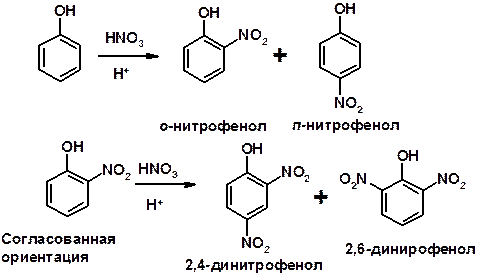
3. Сульфирование
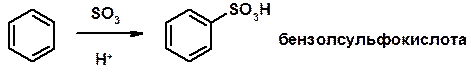
Алкилирование по Фриделю-Крафтсу
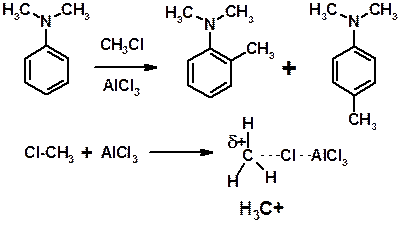
Ацилирование по Фриделю-Крафтсу
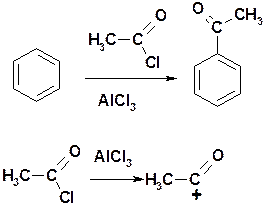
Согласованная ориентация
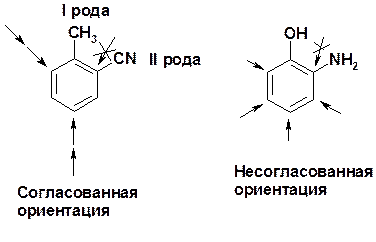
ГАЛОГЕНУГЛЕВОДОРОДЫ (Hal = F, Сl, Br, I)
Способы получения
1. Галогенирование алканов (см. алканы)
2. Гидрогалогенирование алкенов и алкинов (см. алкены, алкины)
3. Присоединение галогенов к алкенам и алкинам (см. алкены, алкины)
4. Реакции спиртов с галогеноводородами

Два основных механизма реакции нуклеофильного замещения:
Уравнение скорости реакции: A + B ® C
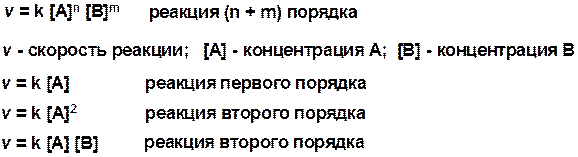
SN1 v = k [R-OH]
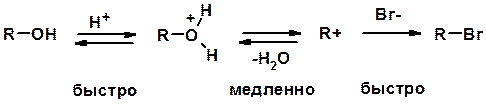
Лимитирующая стадия – образование карбокатиона, значит протекание всей реакции зависит от стабильности самого карбокатиона

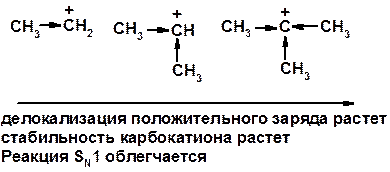
SN2 v = k [R-OH] [Hal-]
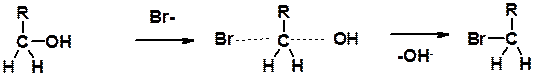
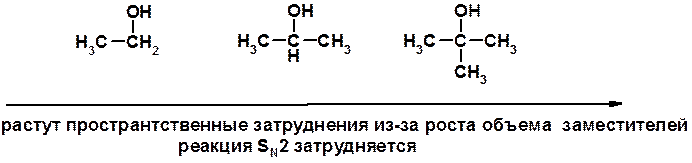
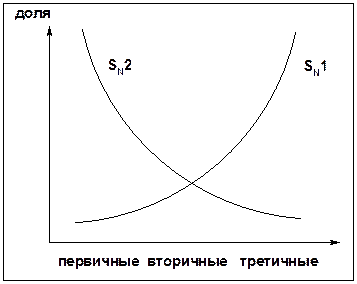
Химические свойства
1. Отщепление галогеноводорода (см. получение алкенов и алкинов)
2. Реакция Вюрца (см. получение алканов)
3. Нуклеофильное замещение галогена (для алифатических галогенуглеводородов)
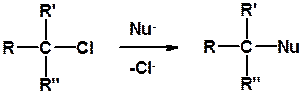
Реакцию можно рассматривать как введение остатка алифатического углеводорода (алкила) в другую молекулу – реакция алкилирования, а галогенуглеводород – алкилирующий агент
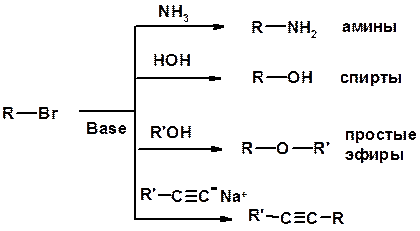
4. Ароматическое нуклеофильное замещение - возможно только для активированных сильными акцепторами (нитро-группа) аренов
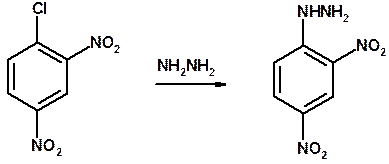
5. Получение магнийорганических соединений (реактивов Гриньяра)
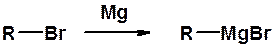
СПИРТЫ и ФЕНОЛЫ
(ОН – гидроксил или гидрокси-группа)
(приставка для обозначения гидроксила – гидрокси, суффикс – ол)
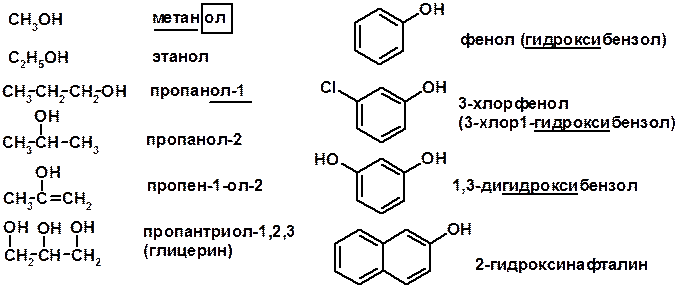
Методы получения
Получение спиртов
Получение фенолов
Химические свойства
Простые эфиры
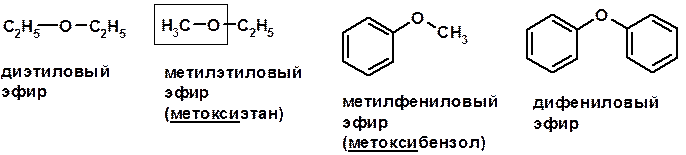
Методы получения
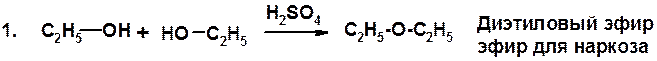
Методы получения
Химические свойства
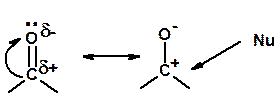
1. Реакции с водой и спиртами
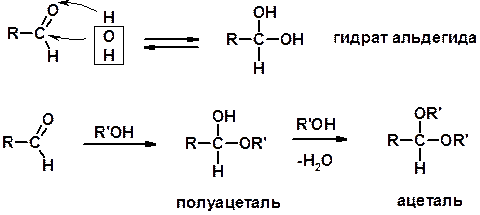
Реакции с аммиаком
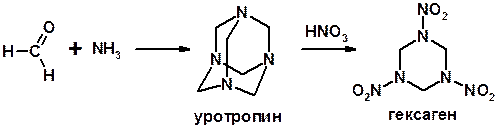
3. Реакции с аминами и их производными (присоединение-отщепление)

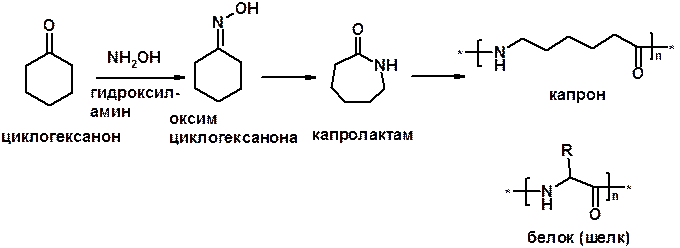
4. Конденсации
СН-кислотность – карбонильные соединения способны отдавать протон от -углеродного атома
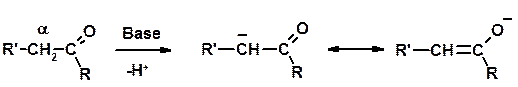
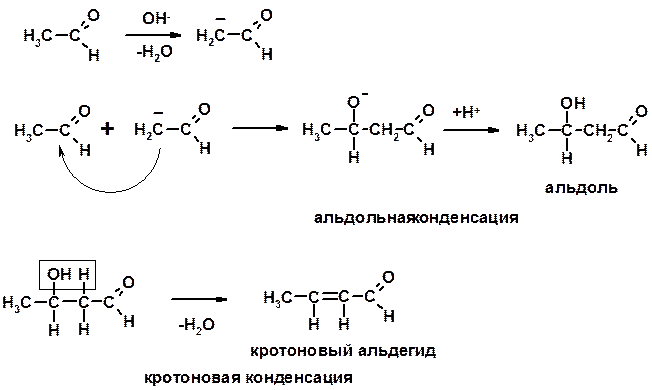
Если нет протона в -положении, то происходит реакция Каниццарро
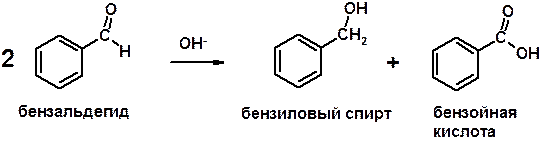
5. Окислительно-восстановительные реакции
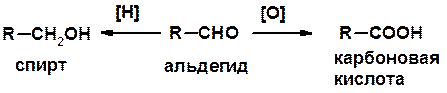
Карбоновые кислоты
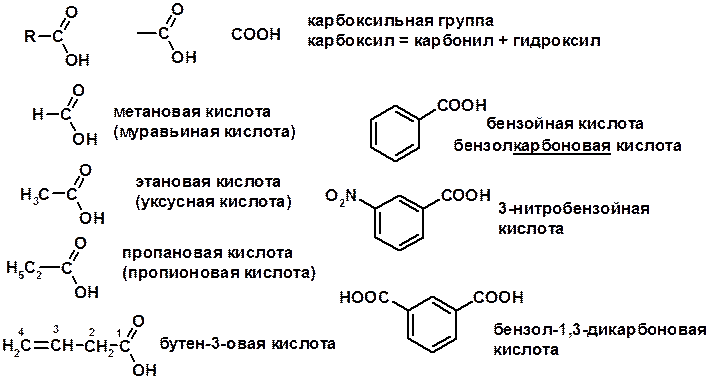
Методы получения
1. Окисление первичных спиртов и альдегидов
2. Гидролиз трихлорметильных производных аренов
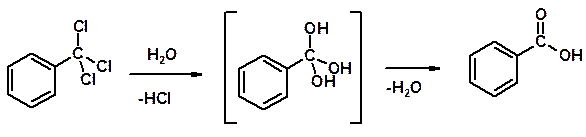
3. Гидролиз сложных эфиров (омыление)
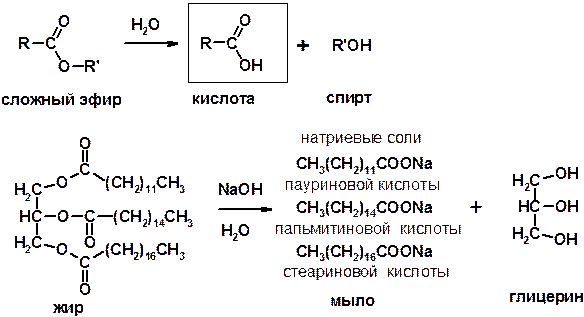
Химические свойства
Карбоновых кислот
1. Кислотность (образуют соли в реакциях даже со слабыми основаниями)
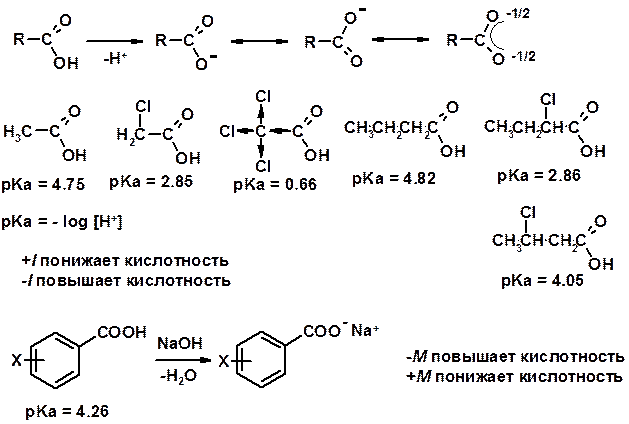
2. Реакции с нуклеофилами

Углерод карбоксильной группы малоактивен по отношению к нуклеофилам (по сравнению с карбонильной группой) из-за + М гидроксила, для активации карбоновых кислот применяют протонирование, вносящее положительный заряд
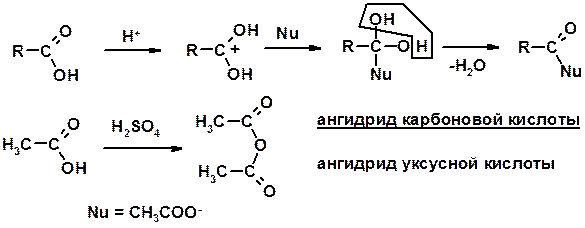
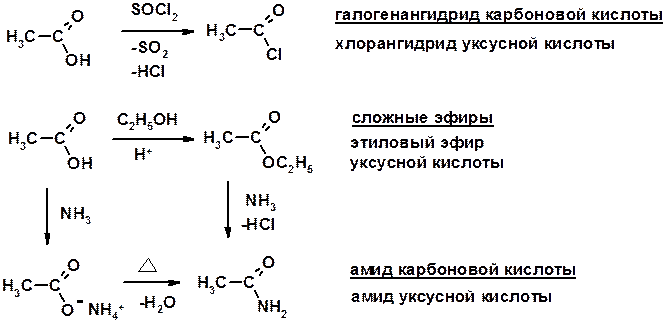
Получение
Дегидратация амидов
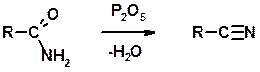
Цианирование галогеналканов
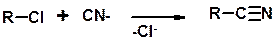
Гидролиз нитрилов
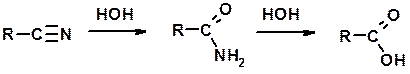
Хим. свойства
СН-кислотность нитроалканов
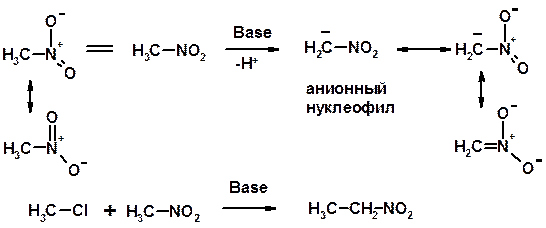
Восстановление нитроаренов
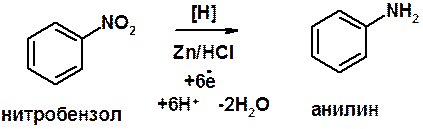
Амины
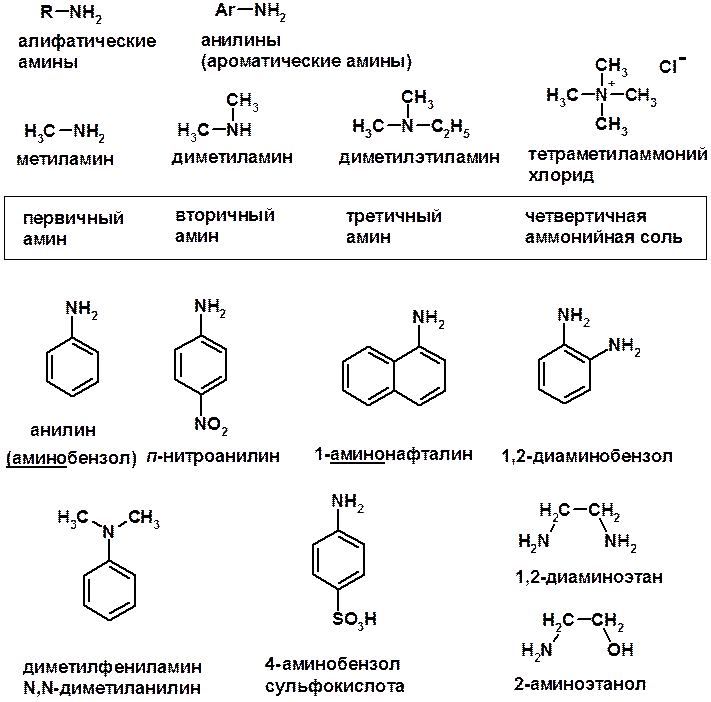
Методы получения
Алкилирование аммиака
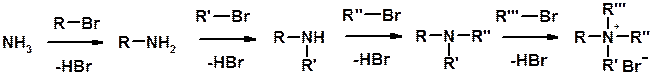
Восстановление амидов
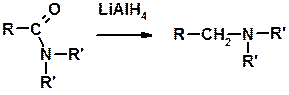
Восстановление нитрилов
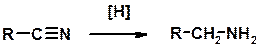
Кислотно-основные сойства
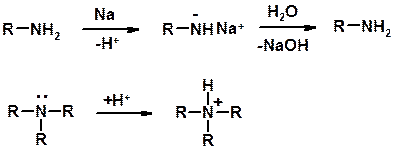
ü Основность – способность принимать протон или отдавать пару электронов
ü Основность амина тем выше, чем выше электронная плотность на азоте.
ü Донорные заместители у азота повышают электронную плотность на азоте, а значит повышают основность амина.
ü Акцепторные заместители у азота понижают электронную плотность на азоте, а значит понижают основность амина.
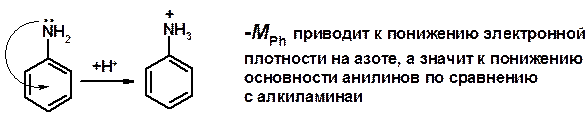
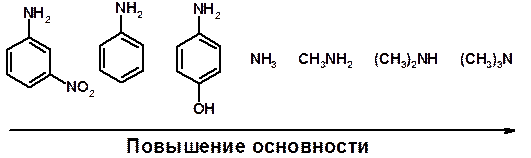
Ацилирование
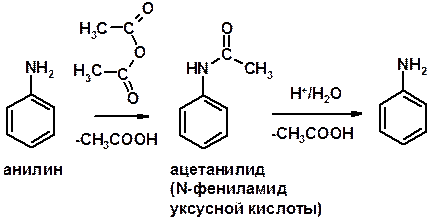
4. Реакции с карбонильными соединеиями (образование иминов)
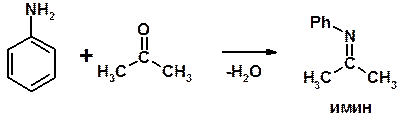
Механизм реакции
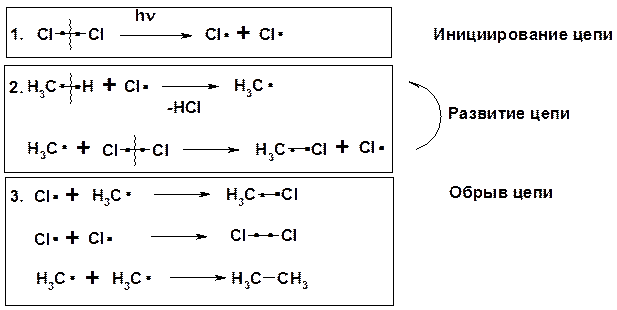
Сульфохлорирование
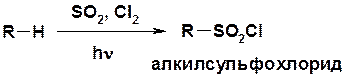
Cульфоокисление
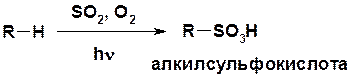
Нитрование
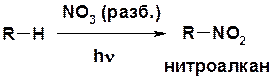
Горение
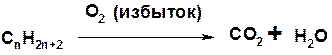
Управляемое окисление
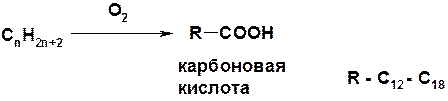
Циклоалканы
CnH 2 n
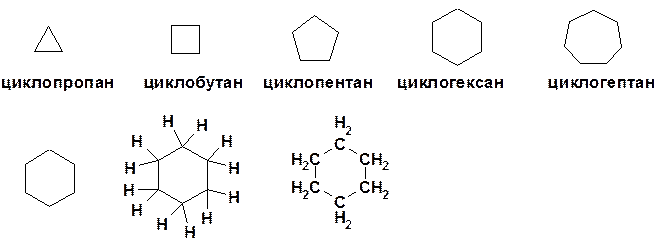
Получение
Внутримолекулярная реакция Вюрца
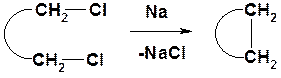

Хим. свойства см. алканы
Реакции присоединения (для напряженных циклов С3-С4)
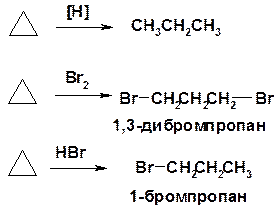
АЛКЕНЫ
С n H 2 n ненасыщенные углеводороды с двойной связью
Номенклатура -
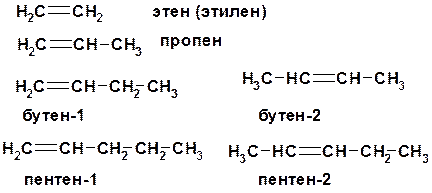
Двойная связь
sp 2 -гибридизация
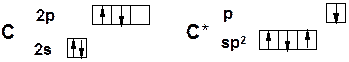
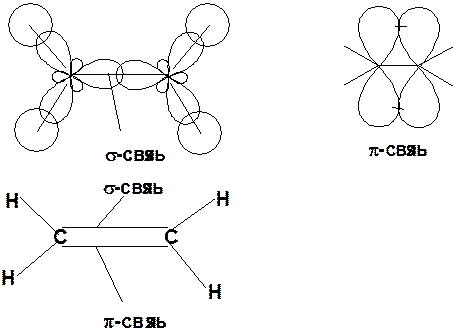
Пространственная изомерия относительно двойной связи
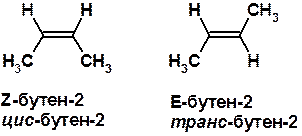
Способы получения
Дегидратация спиртов
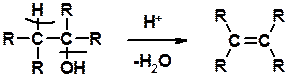



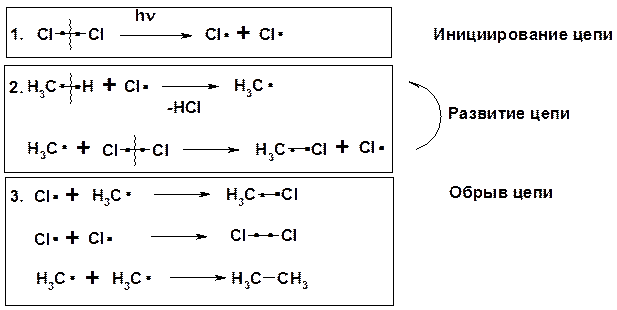
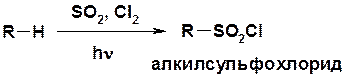
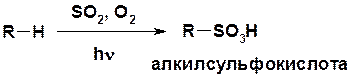
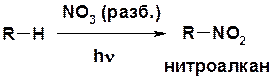
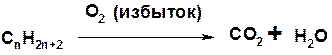
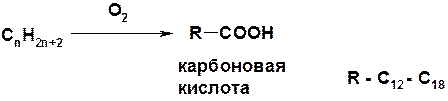
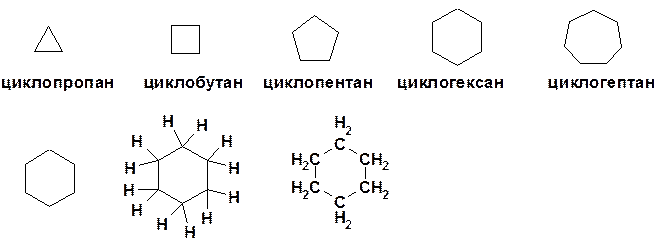
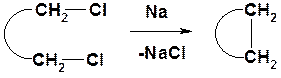

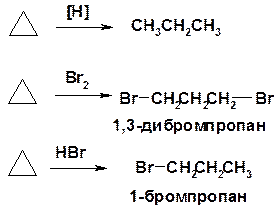
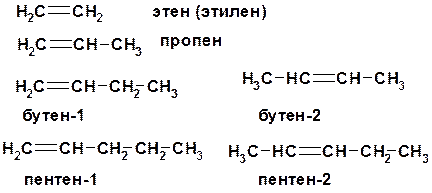
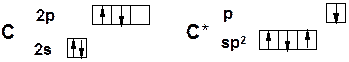
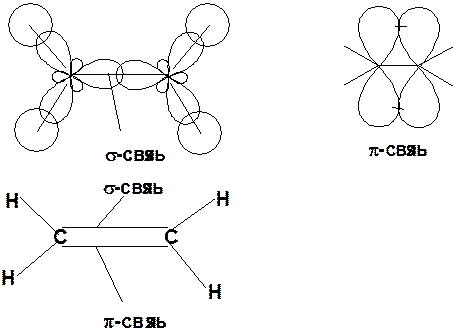
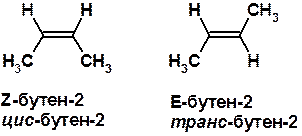
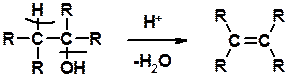
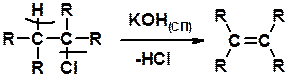
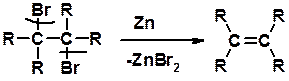
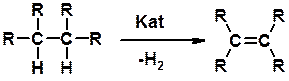
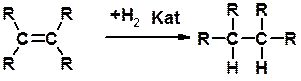
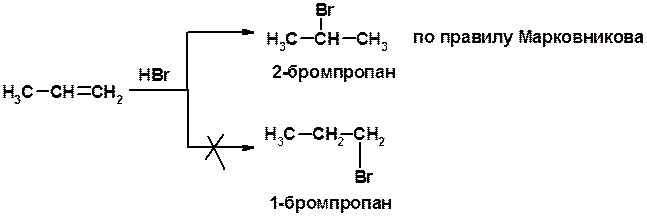
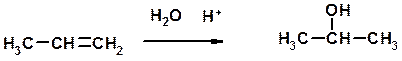
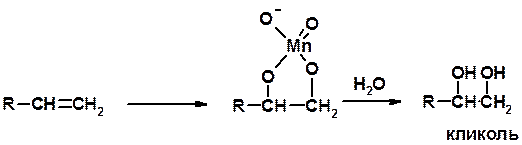
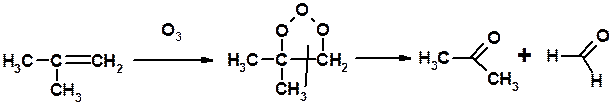
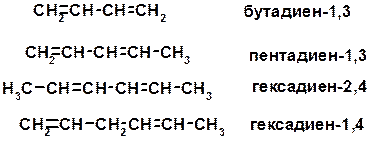
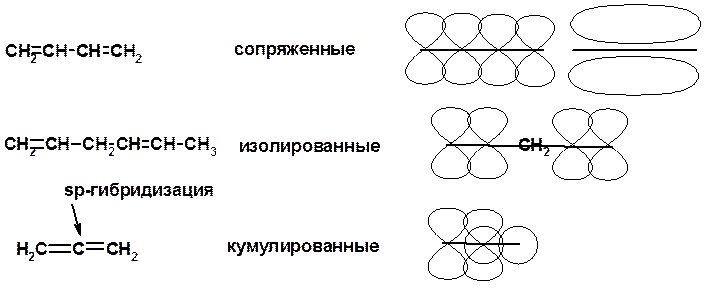
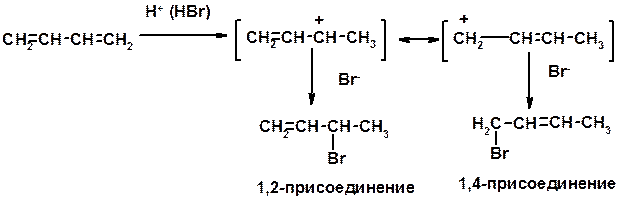
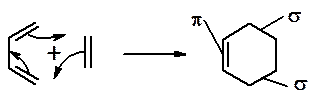 Из 3 -связей образуется новые 1 - и 2 s -связи
Из 3 -связей образуется новые 1 - и 2 s -связи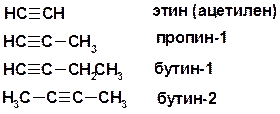
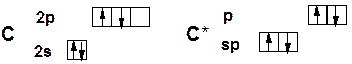

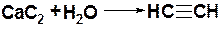
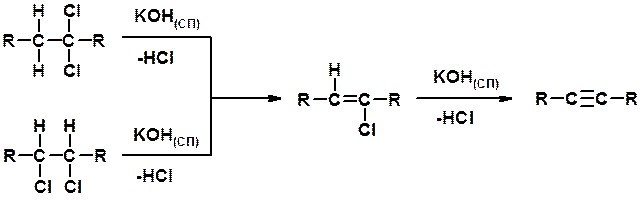
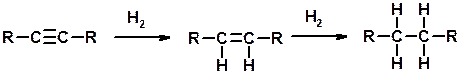
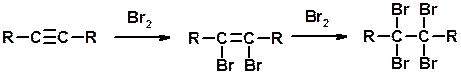
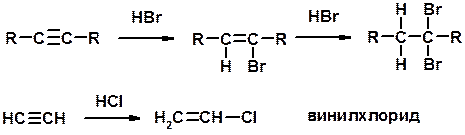
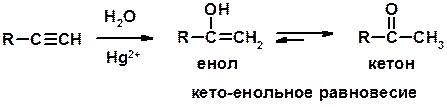
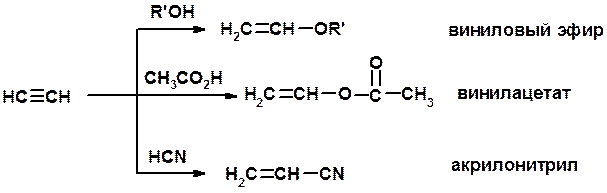
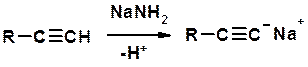 Соли алкинов – ацетилениды
Соли алкинов – ацетилениды