Медь. Химия меди и ее соединений
Медь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
· Способы получения
· Химические свойства
Оксид меди (I)
· Химические свойства
Гидроксид меди (II)
· Химические свойства
Соли меди
Медь

Положение в периодической системе химических элементов
Медь расположена в 1В группе (или в побочной подгруппе I группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии:
+29Cu 1s22s 2 2p 6 3s 2 3p 6 3d 10 4s 1 1s 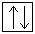 2s
2s  2p
2p 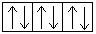
3s  3p
3p  4s
4s 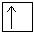 3d
3d 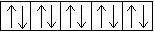
У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.

Температура плавления 1083,4оС, температура кипения 2567оС, плотность меди 8,92 г/см3.

Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3. Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн.
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
· Гидрометаллургический метод: растворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например, вытеснение меди из сульфата железом:
CuSO 4 + Fe = Cu + FeSO 4
· Пирометаллургический метод: получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O 2 = 2CuO + 2SO 2
2) восстановление меди из оксида, например, водородом:
CuO + H 2 = Cu + H 2 O
· Электролиз растворов солей меди:
2CuSO 4 + 2H 2 O → 2Cu + O 2 + 2H 2 SO 4
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами. При этом образуется голубой осадок гидроксида меди(II).
Например, сульфат меди (II) взаимодействует с гидроксидом натрия:
CuSO 4 + 2NaOH → Cu(OH) 2 + Na 2 SO 4

Соли меди (II) окрашивают пламя в зеленый цвет.

Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями, например, с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О 2 → 2Cu 2 О
2Cu + О 2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
1.3. Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
Cu + Cl 2 = CuCl 2
С u + Br 2 = CuBr 2
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N 2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
Cu + H 2 ≠
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O 2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2Cu + H 2 O + CO 2 + O 2 = (CuOH) 2 CO 3
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например, медь не реагирует с разбавленной серной кислотой:
Cu + H 2 SO 4 (разб.) ≠
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой. При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
Cu + 2H 2 SO 4(конц.) → CuSO 4 + SO 2 + 2H 2 O
2.4. Медь реагирует даже при обычных условиях с азотной кислотой.
С концентрированной азотной кислотой:
Cu + 4HNO 3(конц.) = Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O
С разбавленной азотной кислотой:
3Cu + 8HNO 3(разб.) = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O

Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей.
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO 3 ) 2 + Cu = Cu(NO 3 ) 2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO 2 = Cu 2 O + NO
2FeCl 3 + Cu = 2FeCl 2 + CuCl 2
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Гидроксид меди (II)
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
1. Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН) 2 + 2HBr = CuBr 2 + 2H 2 O
Cu(OН) 2 + 2HCl = CuCl 2 + 2H 2 O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
С u(OH) 2 + 4(NH 3 · H 2 O) = [Cu(NH 3 ) 4 ](OH) 2 + 4H 2 O
Cu(OH) 2 + 4NH 3 = [Cu(NH 3 ) 4 ](OH) 2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH) 2 + 2NaOH (конц.) = Na 2 [Cu(OH) 4 ]
4. При нагревании гидроксид меди (II) разлагается:
Сu(OH) 2 → CuO + H 2 O
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями.
Например, хлорид меди (I) окисляется концентрированной азотной кислотой:
CuCl + 3HNO 3(конц.) = Cu(NO 3 ) 2 + HCl + NO 2 + H 2 O
Также хлорид меди (I) реагирует с хлором:
2CuCl + Cl 2 = 2CuCl 2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O 2 + 4HCl = 4CuCl 2 + 2H 2 O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
2CuI + 4H 2 SO 4 + 2MnO 2 = 2CuSO 4 + 2MnSO 4 + I 2 + 4H 2 O
Иодид меди (I) реагирует с концентрированной серной кислотой:
4CuI + 5H 2 SO 4(конц.гор.) = 4CuSO 4 + I 2 + H 2 S + 4H 2 O
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Cu 2 S + 8HNO 3(конц.хол.) = 2Cu(NO 3 ) 2 + S + 4NO 2 + 4H 2 O
Cu 2 S + 12HNO 3(конц.гор.) = Cu(NO 3 ) 2 + CuSO 4 + 10NO 2 + 6H 2 O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl 2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH 3 + H 2 O → [Cu(NH 3 ) 2 ]OH + NH 4 Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например, соли меди (II) окисляют иодиды и сульфиты:
2CuCl 2 + 4KI = 2CuI + I 2 + 4HCl
2CuCl 2 + Na 2 SO 3 + 2NaOH = 2CuCl + Na 2 SO 4 + 2NaCl + H 2 O
Бромиды и иодиды меди (II) можно окислить перманганатом калия:
5CuBr 2 + 2KMnO 4 + 8H 2 SO 4 = 5CuSO 4 + K 2 SO 4 + 2MnSO 4 + 5Br 2 + 8H 2 O
Соли меди (II) также окисляют сульфиты:
2CuSO 4 + Na 2 SO 3 + 2H 2 O = Cu 2 O + Na 2 SO 4 + 2H 2 SO 4
Более активные металлы вытесняют медь из солей.
Например, сульфат меди (II) реагирует с железом:
CuSO 4 + Fe = FeSO 4 + Cu
Cu(NO 3 ) 2 + Fe = Fe(NO 3 ) 2 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой. При нагревании возможно образование сульфата меди (II):
CuS + 8HNO 3(конц.гор.) = CuSO 4 + 8NO 2 + 4H 2 O
Еще одна форма этой реакции:
CuS + 10HNO 3(конц.) = Cu(NO 3 ) 2 + H 2 SO 4 + 8NO 2 ↑ + 4H 2 O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O 2 2CuO + 2SO 2 ↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например, растворимые соли меди (II) реагируют с сульфидами:
CuBr 2 + Na 2 S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO 4 + 2NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
Электролиз раствора нитрата меди (II):
2Cu(NO 3 ) 2 + 2Н 2 О → 2Cu + O 2 + 4HNO 3
Некоторые соли меди при нагревании разлагаются, например, нитрат меди (II):
2Cu(NO 3 ) 2 → 2CuO + 4NO 2 + O 2
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
(CuOH) 2 CO 3 → 2CuO + CO 2 + H 2 O
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
CuCl 2 + 4NH 3 = [Cu(NH 3 ) 4 ]Cl 2
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO 4 + 2Na 2 CO 3 + H 2 O = (CuOH) 2 CO 3 ↓ + 2Na 2 SO 4 + CO 2
Медь. Химия меди и ее соединений
Медь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
· Способы получения
· Химические свойства
Оксид меди (I)
· Химические свойства
Гидроксид меди (II)
· Химические свойства
Соли меди
Медь





 2s
2s 
 3d
3d 








