Кровь, ее ф-ии. Основные физико-химические константы крови в норме и при патологии
Основные функции крови.
1. Транспортная (перенос различных веществ):
ØДыхательная (перенос кислорода от органов дыхания к тканям и СО2
в обратном направлении).
ØТрофическая или питательная (перенос питательных веществ от
пищеварительного тракта к клеткам организма и использование клетками
тканей и органов компонентов крови для пластических и энергетических
нужд)
ØЭкскреторная (перенос к органам выделения ненужных или вредных
для организма веществ: конечных продуктов обмена веществ, избытка
минеральных и органических веществ, образующихся в процессе обмена, или
поступивших с пищей).
2. Защитная:
Øсодержит факторы гуморального и клеточного иммунитета,
Øучаствует в регуляции агрегатного состояния крови (факторы
свертывания крови и фибринолиза).
3.Гомеостатическая (вместе с тканевой жидкостью и лимфой создает
внутреннюю среду организма и участвует в поддержании ее постоянства):
ØТерморегулирующая (кровь нагревается во внутренних органах, где
образуется много тепла и охлаждает эти органы, а охлаждается в
поверхностных слоях организма, согревая их).
ØПоддержание постоянства кислотно-основного состояния (за счет
буферных систем).
ØОбеспечение водно-солевого обмена между кровью и тканями.
ØКоррелятивная (регуляторная) — перенос физиологически активных
веществ, которые обеспечивают взаимосвязь между различными органами и тканями, в результате чего организм функционирует как единое целое.
Показатель Норма
Количество крови у взрослых 4,5–6 л (6–8 % массы тела)
Гематокрит (м) 0,42–0,52
(ж) 0,37–0,47
Кровь: депонированная 45–50 %
циркулирующая 50–55 %
Объем плазмы крови около 3 л
Состав плазмы крови:
вода 90–92 %
сухой остаток 8–10 %
общий белок 65–85 г/л
альбумины 35–55 г/л
глобулины 20–35 г/л
фибриноген 2–4 г/л
мочевина 2,5–8,3 ммоль/л
общий билирубин 3,4–20,5 мкмоль/л
глюкоза (цельная кровь) 3,30–5,55 ммоль/л
глюкоза (плазма, сыворотка) 3,30–6,10 ммоль/л
холестерин 3,0–6,2 ммоль/л
триглицериды 0,55–1,65 ммоль/л
неорганические вещества 0,9 %
Вязкость крови у взрослых 5
Относительная плотность (уд.вес) 1,050–1,060
рН крови: артериальной 7,40
венозной 7,35
Крайние пределы рН, совместимые с жизнью 7,0–7,8
Количество эритроцитов: (м) (4,5–5,1) ´л (тера на литр)
(ж) (3,7–4,7) ´л (тера на литр)
Количество гемоглобина (м) 130–160 г/л
(ж) 120–140 г/л
Цветовой показатель: взрослые 0,85–1,05
Осмотическая резистентность эритроцитов: Min 0,46–0,48 % р-р NaCI Max 0,32 –0,34 % р-р NaCI
СОЭ (м) 1–10 мм/ч
(ж) 2–15 мм/ч
новорожденные 1–2 мм/ч
Лейкоциты: количество у взрослых (4–9) ´л (гига на литр)
у новорожденных (15–20) ´л (гига на литр)
Лейкоцитарная формула (%):
Нейтрофилы:
миелоциты 0
метамиелоциты 0
палочкоядерные 1–6
сегментоядерные 47–72
Эозинофилы 0,5–5
Базофилы 0–1
Лимфоциты 19–37
Моноциты 2–11
Индекс регенерации (сдвиг влево) 0,05–0,1
Количество тромбоцитов (150–450) ´/л (гига на литр)
Время свертывания крови (по Ли-Уайту) 5–7 мин
Патология
При гипернатриемии синдром гипергидратацией организма. Гипонатриемия сопровождается дегидротацией. Гиперкалиемия наблюдается при ОПН, гипоальдостеронизме. При обратном (гипоальдостеронизме) состоянии возникает гипокалиемия, увеличивается выделение калия с мочой, и оно сочетается с задержкой натрия в организме. Гиперкальциемия наблюдается при опухолях костей, аденоме паращитовидных желез. Кальций в этих случаях метаболизируется из костей в плазму. Гипокальциемия наблюдается при паратиреозе, и сопровождается судорогами (тетания). Уровень Mg в плазме даже при его значительных потерях длительное время может оставаться стабильным, пополняясь из мышечного депо. Гипофосфатемия характерна для рахита.
ОПН и ХПН
Причины острой почечной недостаточности
Причиной развития острой почечной недостаточности может быть мочекаменная болезнь, шок, коллапс, опухолевые процессы простаты, мочевого пузыря и прямой кишки; сердечная недостаточность, атеросклероз, воздействие токсических веществ, гломерулонефрит, пиелонефрит, неконтролируемый прием нефротоксичных лекарственных средств.
Основные признаки ОПН: олигурия — анурия (суточное количество мочи меньше 400—500 мл), задержка в организме азотистых шлаков, нарушения водно-электролитного и кислотно-щелочного баланса, сердечно-сосудистой деятельности, малокровие и др. При ОПН изменения в почках в большинстве случаев обратимы и в течение 2 недель (реже 1—2 месяцев) диурез восстанавливается. Лечение направлено на устранение причины ОПН (шок, интоксикация и т. д.) и обменных нарушений. Для предотвращения и борьбы с уремией применяют гемодиализ или др. методы внепочечного очищения крови. Выздоровление с восстановлением работоспособности наступает через 3—12 месяцев.
Хроническая почечная недостаточность (ХПН) может быть следствием заболеваний почек (хронический диффузный гломерулонефрит, хронический пиелонефрит, амилоидоз почек и др.), динамических или механических нарушений проходимости мочевых путей (почечнокаменная болезнь, сужение уретры и т. д.), сердечно-сосудистых и коллагеновых болезней, эндокринных нарушений (например, сахарный диабет) и др. Сопровождается общей слабостью, нарушениями сна, зудом, диспепсией, анемией, высокой и стойкой гипертонией, электролитными нарушениями; в более поздней стадии — полиурией (которая сменяется олигурией), полиневритами, наконец азотемией, уремией. Лечение в начальной фазе состоит из лечения основного заболевания, приведшему к ХПН, и назначению нефропротективных препаратов (ингибиторов ренин-ангиотензин-превращающего фермента), коррекции артериального давления и липидного обмена, назначению малобелковой диеты (обязательно под контролем состояния питания) с ограничением натрия, симптоматической терапии. При присоединении характерных для ХПН нарушений минерального и гормонального обмена (гиперпаратиреоз), анемии — назначаются препараты для их коррекции. В терминальной фазе ХПН применяется заместительная почечная терапия — хронический гемодиализ, перитонеальный диализ, трансплантация почки.
Камни в почках
Наиболее распространенные типы почечных камней:
v кальциевые камни (смешанные оксалаты/фосфаты кальция, оксалаты кальция, фосфаты кальция) - по разным данным, составляющие 70- 80% из общего числа;
v фосфаты магния и аммония (струвитные камни) - 10-15%;
v ураты (камни мочевой кислоты) – 5-15%.
К более редким типам камней (1-2 %) относят цистиновые камни, связанные с наследственным нарушением метаболизма, сопровождающимся повышенным выделением с мочой цистина, и некоторые другие.
Условия формирования почечныхкамней.
•1.Высокая концентрация (близкая к критической) веществ, содержащих Са2+, фосфатов, уратов, цистеина, оксалатов.
•2.Наличие щелочной мочи.При бактериальной инфекции происходит сдвиг в щелочную сторону, чтоспособствует отложению камней.
•3. Отсутствие ингибиторов в кристаллообразовании.Интенсивность камнеобразования увеличивается в жарких странах. Для сдвига в кислую сторону используют лекарственные препараты.
На образование камней влияет резко выраженное концентрирование мочи в силу снижения потребления жидкости при нарушении питьевого режима. Все это может привести к образованию в почках камней оксалата кальция. Существует генетическая предрасположенность к развитию патологических условий, способствующих образованию кальциевых камней, но механизм не совсем понятен. Другие более редкие причины, в силу которых почки образуют кальциевые камни, включают в себя употребление чрезмерного количества витамина D или добавок кальция, чрезмерную активность паращитовидных желез, саркоидоз (состояние, вызывающее образование гранулем в организме), операции или хроническое воспаление кишечника.
19. Функции печени
Выделяют непищеварительные и пищеварительные функции печени.
Непищеварительные функции:
v синтез фибриногена, альбумина, иммуноглобулинов и других белков крови;
v синтез и депонирование гликогена;
v формирование липопротеинов для транспорта жиров;
v депонирование витаминов и микроэлементов;
v детоксикация продуктов метаболизма, лекарственных и других веществ;
v метаболизм гормонов: синтез сомагомединов, тромбопоэтина, 25(OH)D3 и др.;
v разрушение йодсодержащих тиреоидных гормонов, альдостерона и др.;
v депонирование крови;
v обмен пигментов (билирубина — продукта деградации гемоглобина при разрушении эритроцитов).
Пищеварительные функции печени обеспечиваются желчью, образующейся в печени.
Роль печени в пищеварении:
v Детоксикационная (расщепление физиологически активных соединений, продукция мочевой кислоты, мочевины из более токсических соединений), фагоцитоз купферовскими клетками
v Регуляция углеводного обмена (конверсия глюкозы в гликоген, гликогеногезис)
v Регуляция липидного метаболизма (синтез триглицеридов и холестерола, экскреция холестерола в желчь, образование кетоновых тел из жирных кислот)
v Синтез белков (альбумин, транспортные белки плазмы, фибриноген, протромбин и др.)
v Образование желчи
Зональность метаболических комплексов печени, основного органа поддержания химического гомеостаза, определяет различие в ферментном составе между гепатоцитами перивенозной (центральной) и перипортальной (периферической) зон ацинуса. Это связано с их неодинаковой потребностью в кислороде различных ферментных систем.
Так, наибольшая концентрация ферментов ЦТК, катаболизма амино- и жирных кислот, цикла мочевины, глюконеогенеза отмечена в перипортальной зоне, получающей более оксигенированную кровь. Поскольку компоненты реакций второй фазы биотрансформации локализованы в клетках этой зоны ацинуса, то они более защищены от действия токсических продуктов. В гепатоцитах перицентральной зоны более активен гликолиз и первая стадия биотрансформации ксенобиотиков.
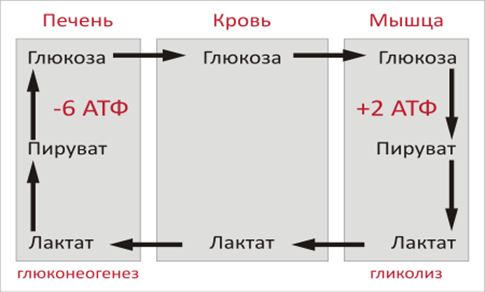
Цикл Кори

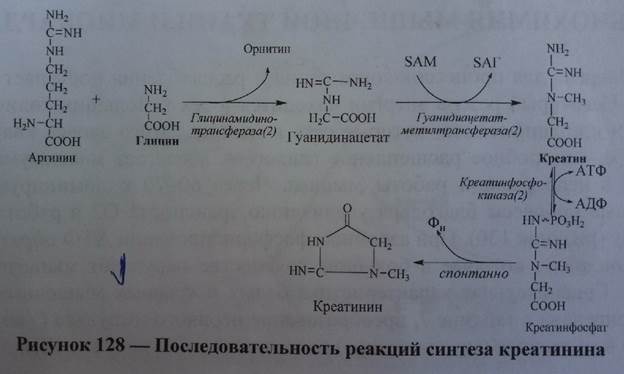
Характеристика белков мышечной ткани (актин G, F, миозин, актомиозин, тропомиозин, тропонины T, C, I и др.). Механизм электромеханического сопряжения (теория мышечного сокращения). Особенности сокращения гладкой мускулатуры.
Основными представителями мышечных белков являются актин и миозин,среди которых на долю миозина приходится 55%
Миозин имеет форму асимметричного гексамера.У молекулы этого белка имеется вытянутая часть,состоящая из 2 спиралей,накрученных одна на другую.Каждая спираль имеет на одном конце глобулярную головку.Гексамер включает одну пару тяжелых цепей и две пары легких цепей.
Тяжелая цепь: на С-конце - α-спираль, на N-конце - глобула. При соединении двух тяжелых цепей С-концевыми участками образуется суперспираль. Две легкие цепи входят в состав глобулы (головки). Стержневой участок суперспирали имеет 2 отдела, где спирали оголены - эти места открыты для действия протеолитических ферментов и имеют повышенную подвижность.
Свойства миозина.
В физиологических условиях (оптимальные pH, температура, концентрации солей) молекулы миозина спонтанно взаимодействуют между собой своими стержневыми участками ("конец в конец", "бок в бок") с помощью слабых нековалентных, а их головки выступают из толстой нити по правильной спирали
В головках миозина имеется два важных центра:
- первый катализирует гидролитическое расщепление АТФ, т.е. соответствует активному центру фермента;
- второй участок головки миозина обеспечивает во время мышечного сокращения связь толстых нитей с белком тонких нитей – актином.
Тонкие нити. В состав тонких нитей входят три белка: сократительный белок актин и регуляторные белки тропомиозин и тропонин.
Актин - небольшой глобулярный белок, его молекулярная масса - 42 кDа. G-актин представляет собой глобулу. В физиологических условиях его молекулы способны к спонтанной агрегации, образуя F-актин
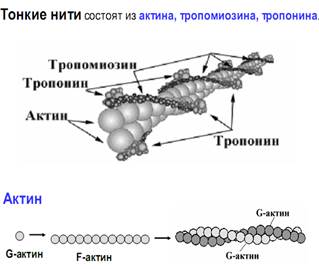
Основой тонкой нити является двойная спираль, состоящая из двух цепей F-актина (фибриллярного актина), содержащих около 300 молекул
G-актина (глобулярного актина), как бы две нити бус, закрученных в двойную спираль.
Регуляторный белок тонких нитей - тропомиозин – также имеет форму двойной спирали. Однако эта спираль образована полипептидными цепями и по длине соответствует 7 звеньям двойной спирали актина. Тромиозин располагается в желобке двойной спирали актина.
Регуляторный белок тропонин присоединяется к тропомиозину и фиксирует его положение в желобке актина, при котором блокируется взаимодействие миозиновых головок с молекулами глобулярного актина тонких нитей.
Тропомиозин. Фибриллярный белок, молекулярная масса - 70 кДа. Имеет вид α-спирали. В тонкой нити на одну молекулу тропомиозина приходится 7 молекул G-актина. Располагается тропомиозин в желобке между двумя спиралями G-актина. Соединяется тропомиозин "конец в конец", цепочка непрерывная. Молекула тропомиозина закрывает активные центры связывания актина на поверхности глобул актина.
Тропонин. Глобулярный белок, молекулярная масса 80 кДа, имеет 3 субъединицы: тропонин "Т", тропонин "С" и тропонин "I". Располагается на тропомиозине с равными промежутками, длина которых равна длине молекулы тропомиозина.
Тропонин Т (ТнТ) - отвечает за связывание тропонина с тропомиозином, через тропонин "Т" конформационные изменения тропонина передаются на тропомиозин.
Тропонин С (ТнС) - Ca2+-связывающая субъединица, содержит 4 участка для связывания кальция, по строению похожа на белок кальмодулин.
Тропонин I (ТнI) - ингибиторная субъединица - это ненастоящий ингибитор - он только лишь создает пространственное препятствие, мешающее взаимодействию актина и миозина в момент, когда тропонин "С" не связан с Са2+.
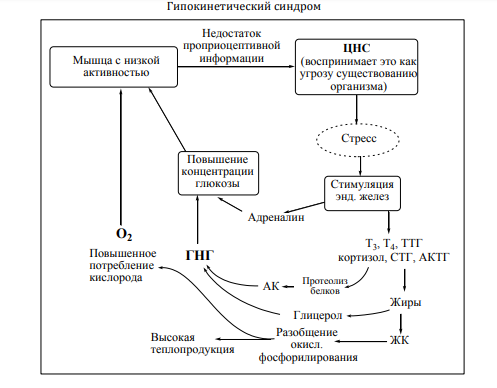
Патогенез ГКС (1-й этап)
-Дефицит проприоцептивной информации
-Стресс (как реакция организма на недостаток проприоцептивной информации)
-Эффекты континсулярных гормонов: катехоламинов, T3,T4, глюкокортикоидов и др.
-Активация протеолиза, липолиза, ГНГ
-Увеличение концентрации ЖК в крови
-Разобщение окисления и фосфорилирования
-Усиление катаболических процессов в организме
-Увеличение теплопродукции
Механизм развития ГКС
Патогенез ГКС (2-й этап)
-Увеличение потребления кислорода (гипокинетический парадокс)
-Снижение массы мышечной ткани
-протеолиз
-Резорбция костной ткани, остеопороз, ухудшение минерального обмена.
-снижение физ. нагрузки, пьезоэлектроэффект.
-Потеря с мочой электролитов Na+,K+,Ca2+
-Как следствие уменьшения количества клеток
-Увеличение частоты спонтанных мутаций
-Следствие высокой концентрации NADHгенерация АФК.
Патогенез ГКС (вывод)
Гипокинетический синдром– диссипативный процесс, вызывающий распад структуры и превращающий ее в тепло, рассеивающееся в окружающей среде.
Алкоголь.
В печени энзим алкогольдегидрогеназа окисляет этанол в ацетальдегид, который затем далее окисляется в безопасную уксусную кислоту посредством ацетальдегиддегидророгеназы. Эти две реакции окисления связаны с восстановлением NAD+ в NADH.
Этанол обладает выраженной органотропностью: в мозгу его концентрация превосходит содержание в крови.
Даже низкие дозы алкоголя запускают активность ингибиторных ГАМК — систем головного мозга, в результате чего высвобождается дофамин. Это приводит к седативному эффекту, сопровождающемуся расслаблением мышц и эйфорией (ощущением опьянения).
При хроническом употреблении алкоголя ГАМК-системы адаптируются, что приводит к росту толерантности к алкоголю, а впоследствии и к алкогольной зависимости, которая сопровождается абстинентным синдромом (похмельный) вследствие снижения активности ГАМК при воздержании.
Основным эффектом приема наркотиков на организм человека является наркотическое опьянение, но они так же обладают рядом характерных побочных эффектов:
· привыкание — толерантность (проявляется в постепенном снижении эффекта от приема вышеуказанных веществ, что вынуждает принимать со временем все большие дозы для достижения эффекта)
· зависимость как психическую, так и физическую, которая проявляется «синдром отмены» или «абстинентный синдром», что является отличительной чертой наркотиков.
Практически все наркотики нацелены на «систему поощрения» мозга, увеличивая в 5-10 раз поток нейромедиаторов типа дофамина и серотонина в постсинаптических нейронах.
Эти нейромедиаторы служат важной частью "системы поощрения" мозга, вызывают чувство удовольствия, влияют на процессы мотивации и обучения.
Химические компоненты хряща
тип II коллагена, специфический для хряща протеогликан.
Конечная функция хряща определяется функцией этих 2 основных типов молекул. Коллагеновые волокна, прочные на разрыв, усиливают механические свойства довольно непрочного протеогликана. Ориентация коллагеновых волокон определяется направлением воздействий, которым эта ткань противостоит.
Протеогликан образует гель, который в 5 раз больше по объему в воде, чем в окружении коллагена. Причем, возможности связывания воды гелем зависят от взаимодействия между этими двумя основными белками хряща. Не исключено, что на это свойство влияют и другие белки хряща.
Главный коллагеновый белок хряща - коллаген II, он относится к классу главных структурных коллагенов, для которых характерно образование поперечно исчерченных прочных фибрилл. Его волокна разнообразны по диаметру, но, как правило, они тоньше волокон коллагена I типа и имеют больше поперечных ковалентных связей. Из хряща выделены и другие типы коллагена, которые составляют около 10 % от общего количества коллагена в хряще. Эти минорные коллагены отличаются по аминокислотному составу, молекулярной массе и свойствам. Их роль пока еще недостаточно хорош выяснена.
В хряще можно найти специфические и общие для всех видов соединительной ткани белки. Из хрящевой ткани выделены два типа ПГ, содержащих хондроитин сульфат или дерматан сульфат небольшого размера. Белковые цепи этих ПГ гомологичны и содержат последовательности, богатые ЛЕЙ. В частности, такие последовательности содержит белок - фибромодулин. Он обнаружен во многих тканях, что указывает на схожесть их функций. Фибромодулин влияет на фибриллогенез. Он найден в коллагеновых волокнах костной ткани, где его рассматривают как основной регулятор фибриллогенеза.
Костная ткань - это особый вид соединительной ткани.
В костной ткани преобладает межклеточное вещество, содержащее большое количество минеральных компонентов, главным образом - солей кальция.
Основные особенности кости - твердость, упругость, механическая прочность.
В компактном веществе кости большая часть минеральных веществ представлена гидроксилапатитом и аморфным фосфатом кальция.
Кроме них встречаются карбонаты, фториды, гидроксиды и значительное количество цитрата.
Химический состав костной ткани:
· 20% - органический компонент,
· 70% - минеральные вещества,
· 10% - вода.
· Губчатое вещество:
· 35-40% - минеральных веществ,
· до 50% - органические соединения,
· вода - 10%.
Особенность минерального компонента в том, что фактическое соотношение кальций/фосфор равно 1,5, хотя расчетное соотношение должно быть 1,67. Это позволяет кости легко связывать или отдавать ионы фосфата, поэтому кость - это депо для минералов, особенно для кальция.
В компактном веществе кости большая часть минеральных веществ представлена гидроксилапатитом и аморфным фосфатом кальция.
На обмен кальция и фосфора влияют гормоны паратгормон, серотонин и активная форма витамина D3.
Паратгормон влияет на процессы созревания активного витамина D3 в почках. Активный витамин D3 (1,25-диоксивитамин D3) увеличивает всасывание кальция в кишечнике и повышает усвоение кальция костной тканью, усиливает действие паратгормона в костной ткани и почках.
Главным регулятором синтеза и секреции этих гормонов является внеклеточный кальций. Если уменьшается его концентрация во внеклеточной жидкости, это приводит к увеличению секреции кальцитонина и уменьшению секреции паратгормона и наоборот. На выработку паратгормона также влияют катехоламины, которые усиливают его секрецию.
Этапы минерлизации костной ткани:
1-й ЭТАП: остеобласты начинают синтезировать костный коллаген, который содержит фосфаты и формирует хондроитинсульфаты. Костный коллаген является матрицей для процесса минерализации. Особенностью процесса минерализации является пересыщение среды ионами кальция и фосфора. На 1 этапе минерализации кальций и фосфор связываются с костным коллагеном. Обязательный участник процесса - сложные липиды.
2-й ЭТАП - в зоне минерализации усиливаются окислительные процессы, распадается гликоген, синтезируется необходимое количество АТФ. Кроме того, в остеобластах увеличивается количество цитрата, необходимого для синтеза аморфного фосфата кальция.
Ионы кальция и фосфора, которые были связаны с белково-углеводным комплексом, переходят в растворимое состояние и формируют кристаллы гидроксилапатита. По мере роста кристаллы гидроксилапатита вытесняют протеогликаны и даже воду до такой степени, что плотная ткань становится практически обезвоженной.
Ингибитор процесса минерализации - неорганический пирофосфат.
В ходе роста и развития организма количество аморфного фосфата кальция уменьшается, потому что кальций связывается с гидроксилапатитом.
37. Изменение СТ при старении, коллагенозах…
Общим возрастным изменением, которое свойственно всем видам соединительной ткани, является уменьшение содержания воды и отношения основное вещество/волокна. Показатель этого соотношения уменьшается как за счет нарастания содержания коллагена, так и в результате снижения концентрации гликозаминогликанов.
В первую очередь значительно снижается содержание гиалуроновой кислоты. Однако не только уменьшается общее количество кислых гликозаминогликанов, но изменяется и количественное соотношение отдельных гликанов. Одновременно происходит также изменение физико-химических свойств коллагена (увеличение числа и прочности внутри- и межмолекулярных поперечных связей, снижение эластичности и способности к набуханию, развитие резистентности к коллагеназе и т.д.), повышается структурная стабильность коллагеновых волокон (прогрессирование процесса «созревания» фибриллярных структур соединительной ткани). Следует помнить, что старение коллагена in vivo неравнозначно износу. Оно является своеобразным итогом протекающих в организме метаболических процессов, влияющих на молекулярную структуру коллагена.
Среди многих поражений соединительной ткани особое место занимают коллагенозы. Для них характерно повреждение всех структурных составных частей соединительной ткани: волокон, клеток и межклеточного основного вещества. К коллагенозам обычно относят ревматизм, ревматоидный артрит, системную красную волчанку, системную склеродермию, дерма-томиозит и узелковый периартериит. Каждое из этих заболеваний имеет своеобразное течение и сугубо индивидуальные проявления. Среди многочисленных теорий развития коллагенозов наибольшее признание получила теория инфекционно-аллергического происхождения.
Наконец, необходимо отметить, что нарушение процесса гидроксилирования коллагена – один из биохимических дефектов при цинге.
Коллаген, синтезированный в отсутствие или при дефиците аскорбиновой кислоты, оказывается недогидроксилированным и, следовательно, имеет пониженную температуру плавления. Такой коллаген не может образовать нормальные по структуре волокна, что и приводит к поражению кожи и ломкости сосудов, столь четко выраженных при цинге.
К факторам, регулирующим метаболизм соединительной ткани, прежде всего следует отнести ферменты, гормоны и витамины.
Многие гормоны оказывают воздействие преимущественно на отдельные определенные разновидности соединительной ткани. В данном разделе рассматриваются гормональные влияния, которые носят общий характер. Так, ряд глюкокортикоидных гормонов (кортизон и его аналоги) угнетают биосинтез коллагена фибробластами, тормозят и другую важнейшую метаболическую функцию фибробластов – биосинтез гликозаминогликанов.
По-видимому, действие глюкокортикоидных гормонов на соединительную ткань не ограничивается угнетением биосинтетической активности фибробластов. Предполагают, что под их влиянием происходит активация ферментного катаболизма коллагена.
Минералокортикоидные гормоны (альдостерон, дезоксикортикостерон) надпочечников, напротив, стимулируют пролиферацию фибробластов и одновременно усиливают биосинтез «основного вещества» соединительной ткани.
Известно также, что тироксин вызывает усиленную деполимеризацию гиалуроновой кислоты, а соматотропный гормон передней доли гипофиза стимулирует включение пролина в полипептидную цепь тропоколлагена.
38. Механизмы канцерогенеза…
Биохимия легочной ткани
Эмфизема лёгких [2] [3] (от др.-греч. ἐμφυσάω — надуваю, раздуваю, разбухаю) — заболевание дыхательных путей, характеризующееся патологическим расширением воздушных пространств дистальнее терминальных бронхиол, которое сопровождается деструктивно-морфологическими изменениями альвеолярных стенок.
Этиология[править | править код]
Выделяют две группы причин, приводящих к развитию эмфиземы лёгких.
В первую группу входят факторы, нарушающие эластичность и прочность элементов структуры лёгких:
· патологическая микроциркуляция,
· изменение свойств сурфактанта,
· врождённый дефицит альфа-1-антитрипсина,
· газообразные вещества (соединения кадмия, оксиды азота и др.),
· табачный дым,
· пылевые частицы во вдыхаемом воздухе.
Эти причины могут привести к развитию первичной, всегда диффузной эмфиземы.
В основе её патогенеза лежит патологическая перестройка всего респираторного отдела лёгкого; ослабление эластических свойств лёгкого приводит к тому, что во время выдоха и, следовательно, повышения внутригрудного давления мелкие бронхи, не имеющие своего хрящевого каркаса и лишённые эластической тяги лёгкого, пассивно спадаются, увеличивая этим бронхиальное сопротивление на выдохе и повышение давления в альвеолах.
Бронхиальная проходимость на вдохе при первичной эмфиземе не нарушается.
Факторы второй группы способствуют повышению давления в респираторном отделе лёгких и усиливают растяжение альвеол, альвеолярных ходов и респираторных бронхиол. Наибольшее значение среди них имеет обструкция дыхательных путей, возникающая при хроническом обструктивном бронхите. Это заболевание становится основной причиной развития вторичной, или обструктивной эмфиземы лёгких, так как именно при нем создаются условия для формирования клапанного механизма перерастяжения альвеол. Так, понижение внутригрудного давления во время вдоха, вызывая пассивное растяжение бронхиального просвета, уменьшает степень имеющейся бронхиальной обструкции; положительное внутригрудное давление в период выдоха вызывает дополнительную компрессию бронхиальных ветвей и, усугубляя уже имеющуюся бронхиальную обструкцию, способствует задержке инспирированного воздуха в альвеолах и их перерастяжению. Важное значение имеет распространение воспалительного процесса с бронхиол на прилегающие альвеолы с развитием альвеолита и деструкции межальвеолярных перегородок.
Патогенез[править | править код]
Центрилобулярная эмфизема развивается вследствие хронической бронхиальной обструкции при хроническом бронхите (бронхиолите). Панацинарная эмфизема может быть того же происхождения при более выраженных изменениях или имеет первичный характер, например, при дефиците альфа-1-антитрипсина. При увеличении бронхиального сопротивления сдавливаются мелкие разветвления бронхов, опорожнение альвеол затрудняется, происходит их растяжение, а в дальнейшем и деструкция межальвеолярных перегородок. Нарушение соотношения вентиляции и кровотока приводит к снижению насыщения артериальной крови кислородом, развитию дыхательного ацидоза.
Патологоанатомические изменения[править | править код]
Лёгкие увеличены в объёме, вздуты, бледно окрашены, пушисты, эластичность их понижена, края округлены. Разрезанное лёгкое плохо спадается, с поверхности стекает небольшое количество пенистой жидкости. В изменённых бронхах нередко содержатся слизисто-гнойные пробки. Правый желудочек расширен. [4
Кровь, ее ф-ии. Основные физико-химические константы крови в норме и при патологии
Основные функции крови.
1. Транспортная (перенос различных веществ):
ØДыхательная (перенос кислорода от органов дыхания к тканям и СО2
в обратном направлении).
ØТрофическая или питательная (перенос питательных веществ от
пищеварительного тракта к клеткам организма и использование клетками
тканей и органов компонентов крови для пластических и энергетических
нужд)
ØЭкскреторная (перенос к органам выделения ненужных или вредных
для организма веществ: конечных продуктов обмена веществ, избытка
минеральных и органических веществ, образующихся в процессе обмена, или
поступивших с пищей).
2. Защитная:
Øсодержит факторы гуморального и клеточного иммунитета,
Øучаствует в регуляции агрегатного состояния крови (факторы
свертывания крови и фибринолиза).
3.Гомеостатическая (вместе с тканевой жидкостью и лимфой создает
внутреннюю среду организма и участвует в поддержании ее постоянства):
ØТерморегулирующая (кровь нагревается во внутренних органах, где
образуется много тепла и охлаждает эти органы, а охлаждается в
поверхностных слоях организма, согревая их).
ØПоддержание постоянства кислотно-основного состояния (за счет
буферных систем).
ØОбеспечение водно-солевого обмена между кровью и тканями.
ØКоррелятивная (регуляторная) — перенос физиологически активных
веществ, которые обеспечивают взаимосвязь между различными органами и тканями, в результате чего организм функционирует как единое целое.
Показатель Норма
Количество крови у взрослых 4,5–6 л (6–8 % массы тела)
Гематокрит (м) 0,42–0,52
(ж) 0,37–0,47
Кровь: депонированная 45–50 %
циркулирующая 50–55 %
Объем плазмы крови около 3 л
Состав плазмы крови:
вода 90–92 %
сухой остаток 8–10 %
общий белок 65–85 г/л
альбумины 35–55 г/л
глобулины 20–35 г/л
фибриноген 2–4 г/л
мочевина 2,5–8,3 ммоль/л
общий билирубин 3,4–20,5 мкмоль/л
глюкоза (цельная кровь) 3,30–5,55 ммоль/л
глюкоза (плазма, сыворотка) 3,30–6,10 ммоль/л
холестерин 3,0–6,2 ммоль/л
триглицериды 0,55–1,65 ммоль/л
неорганические вещества 0,9 %
Вязкость крови у взрослых 5
Относительная плотность (уд.вес) 1,050–1,060
рН крови: артериальной 7,40
венозной 7,35
Крайние пределы рН, совместимые с жизнью 7,0–7,8
Количество эритроцитов: (м) (4,5–5,1) ´л (тера на литр)
(ж) (3,7–4,7) ´л (тера на литр)
Количество гемоглобина (м) 130–160 г/л
(ж) 120–140 г/л
Цветовой показатель: взрослые 0,85–1,05
Осмотическая резистентность эритроцитов: Min 0,46–0,48 % р-р NaCI Max 0,32 –0,34 % р-р NaCI
СОЭ (м) 1–10 мм/ч
(ж) 2–15 мм/ч
новорожденные 1–2 мм/ч
Лейкоциты: количество у взрослых (4–9) ´л (гига на литр)
у новорожденных (15–20) ´л (гига на литр)
Лейкоцитарная формула (%):
Нейтрофилы:
миелоциты 0
метамиелоциты 0
палочкоядерные 1–6
сегментоядерные 47–72
Эозинофилы 0,5–5
Базофилы 0–1
Лимфоциты 19–37
Моноциты 2–11
Индекс регенерации (сдвиг влево) 0,05–0,1
Количество тромбоцитов (150–450) ´/л (гига на литр)
Время свертывания крови (по Ли-Уайту) 5–7 мин
Патология
При гипернатриемии синдром гипергидратацией организма. Гипонатриемия сопровождается дегидротацией. Гиперкалиемия наблюдается при ОПН, гипоальдостеронизме. При обратном (гипоальдостеронизме) состоянии возникает гипокалиемия, увеличивается выделение калия с мочой, и оно сочетается с задержкой натрия в организме. Гиперкальциемия наблюдается при опухолях костей, аденоме паращитовидных желез. Кальций в этих случаях метаболизируется из костей в плазму. Гипокальциемия наблюдается при паратиреозе, и сопровождается судорогами (тетания). Уровень Mg в плазме даже при его значительных потерях длительное время может оставаться стабильным, пополняясь из мышечного депо. Гипофосфатемия характерна для рахита.










