

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
Топ:
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Интересное:
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Горением называют протекающую сравнительно быстро во времени химическую реакцию соединения горючих компонентов с кислородом, сопровождающуюся интенсивным выделением теплоты и резким повышением температуры продуктов сгорания. Реакции горения описываются стехиометрическими уравнениями, характеризующими качественно и количественно вступающие в реакцию и образующиеся в результате ее вещества. Общее уравнение реакции горения любого углеводорода
CmHn + (m + n/4) О2 = mCО2 + (n/2) H2О + Q, (8.1)
где m, n — число атомов углерода и водорода в молекуле; Q — тепловой эффект реакции, или теплота сгорания.
Реакции горения распространенных в практике газов приведены в табл. 8.1. Эти уравнения являются балансовыми и по ним нельзя судить ни о скорости реакций, ни о механизме химических превращений.
Тепловым эффектом, или теплотой сгорания Q, называют количество теплоты, которое выделяется при полном сгорании 1 кмоля, 1 кг или 1 м3 газа при нормальных физических условиях. Различают высшую QB и низшую QH теплоту сгорания. Высшая теплота сгорания включает в себя теплоту, выделяющуюся при конденсации водяных паров в процессе горения. Практически при сжигании газа водяные пары, как правило, не конденсируются, а удаляются вместе с другими продуктами сгорания. Поэтому технические расчеты обычно ведут по низшей теплоте сгорания, т. е. без учета теплоты конденсации водяных паров, составляющей около 2400 кДж/кг *.
* КПД, рассчитанный по низшей теплоте сгорания, численно выше, чем по высшей теплоте сгорания, т. е. создается видимость относительно «благополучного» уровня использования газа. Расчеты КПД по высшей теплоте сгорания сразу более чем на 10% «ухудшают» показатели использования газа в стране. Однако именно это обстоятельство и убеждает в необходимости активно использовать теплоту конденсации водяных паров всевозможными техническими средствами (контактные теплообменники). — Прим. ред.
|
|
| Таблица 8.1 | |
| Газ | Реакция горения |
| Водород | Н2 + 0,5О2 = Н2О |
| Оксид углерода | СО + 0,5О2 = С02 |
| Метан | СН4 + 2О2 = СО2 + 2Н2О |
| Этан | С2Н6 + 3,5О2 = 2СО2 + 3Н2О |
| Пропан | С3Н8 + 5О2 = 3СО2 + 4Н2О |
| н-Бутан | С4Н10 + 6,5О2 = 4СО2 + 5Н2О |
| Изобутан | С4H10 + 6,5О2 = 4СО2 + 5Н2О |
| к-Пентан | С5Н12 + 8О2 = 5СО2 + 6Н2О |
| Этилен | С2Н4 + 3О2 = 2СО2 + 2Н2О |
| Пропилен | С3Н6 + 4,5О2 = 3СО2 + 3Н2О |
| Бутилен | С4Н8 + 6О2 = 4СО2 + 4Н2О |
Высшая (и низшая) теплота сгорания газов, состоящих из нескольких компонентов,
Q = r1Q1 + r2Q2 +... + rnQn, (8.2)
где r1 r2,..., rn - объемные (молярные, массовые) доли компонентов, входящих в смесь; Q1, Q2,..., Qn - теплота сгорания компонентов.
Процесс горения протекает несравненно сложнее, чем по формуле (8.1), так как наряду с разветвлением цепей происходит их обрыв за счет образования промежуточных стабильных соединений. Эти соединения в зоне высоких температур претерпевают дальнейшие стадийные преобразования, приводящие при наличии кислорода к образованию конечных продуктов: водяного пара Н2О и диоксида углерода СО2. При общем или местном недостатке окислителя или при вынужденном охлаждении зоны реакции, например при смывании пламенем холодного теплоприемника, промежуточные соединения могут стабилизироваться и совместно с продуктами завершенного горения попадать в окружающую среду.
Интенсивность выделения теплоты и рост температуры в течение реакции горения в свою очередь приводят к увеличению в реагирующей системе активных частиц. Такая взаимосвязь цепного реагирования и температуры, свойственная всем осуществляемым в практике процессам горения, привела к введению понятия цепочечно-теплового взрыва. Под этим следует понимать, что сами химические реакции горения имеют цепной характер, а их ускорение происходит за счет выделения теплоты и роста температуры в реагирующей системе.
|
|
По закону действующих масс скорость любой химической реакции в гомогенной (однородной) смеси пропорциональна произведению концентраций реагирующих веществ. Для необратимой бимолекулярной реакции эта скорость
ω = КС1С2, (8.5)
где C1 и С2 - концентрации реагирующих компонентов, кмоль/м3; К - константа скорости реакции, зависящая от природы реагирующих веществ и температуры.
При сжигании газа концентрации реагирующих веществ можно условно считать неизменными, так как в зоне горения происходит непрерывный приток свежих компонентов однозначного состава.
Константа скорости реакции (по уравнению Аррениуса)
К = К0е-Е/RT, (8.6)
где К0 - предэкспоненциальный множитель, принимаемый для стехиометрических гомогенных смесей, ~1,0; Е - энергия активации, кДж/кмоль; R - универсальная газовая постоянная, Дж/(кг·К); Т - абсолютная температура, К (°С); е - основание натуральных логарифмов.
Предэкспоненциальный множитель К0 можно трактовать как константу, характеризующую полноту столкновения молекул, а энергию активации Е - как минимальную энергию, необходимую для разрыва существующих связей молекул и образования активных частиц, обеспечивающих эффективность столкновений. Эта энергия для распространенных в технике горючих смесей укладывается в пределы (80÷150)·103 кДж/кмоль. Уравнение (8.6) показывает, что скорость химических реакций резко возрастает с увеличением температуры. Например, при повышении температуры с 500 до 1000 К скорость реакции горения возрастает в зависимости от энергии активации в 2·104÷5·108 раз.
Скорость реакций горения обусловлена также их разветвленным, цепным, характером. Эти реакции протекают через промежуточные химические активные частицы — атомы и радикалы, генерируемые самой реакцией, легко вступающие в соединения с исходными веществами и между собой, приводящие к образованию конечных продуктов и новых активных частиц, способных повторять ту же цепь реакций. Нарастающее самопроизвольное генерирование таких частиц приводит к разгону химических реакций и воспринимается как взрыв всей смеси.
|
|
Наиболее простой и изученной из разветвленных реакций является реакция взаимодействия водорода с кислородом. Зарождение цепи при этом связано с образованием атомарного водорода, возникающего, например, при столкновении молекул с накаленным телом — электрическая искра, пламя:
Н2 + М → Н + Н + М.
Дальнейшее протекание цепной реакции характеризуется схемой:
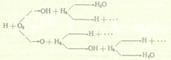
Итог единичного цикла
Н + 3Н2 + О2 → 2Н2О + 3Н.
Схема и итог единичного цикла показывают, что вступление в реакцию одного атома водорода приводит к образованию двух молекул водяного пара и трех атомов водорода, каждый из которых может либо дать начало новой серии превращений, либо рекомбинироваться в стабильную молекулу Н + H = Н2, замедляющую разветвление цепи.
Механизм взаимодействия оксида углерода с кислородом несколько сложнее и связан с сопутствующими, протекающими параллельно реакциями. Объясняется это тем, что сухая смесь оксида углерода с кислородом не реагирует до температуры 700°С, а выше ее протекает медленная гетерогенная (неоднородная) реакция по всему объему только при наличии в горючей смеси некоторого количества водяного пара:
Н2О → ОН + Н;
СО + ОН → СО2 + Н;
Н + О2 → ОН + О;
СО + ОН → СО2 + Н;
СО + О → СО2;
Н + О2 → ОН + О и т. д.
Механизм высокотемпературного горения углеводородов имеет еще более сложный цепной характер и связан с образованием активных частиц в виде атомов и радикалов, а также промежуточных молекулярных соединений. Самое схематичное представление о стадийном окислении простейшего углеводорода метана дают следующие реакции:
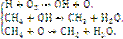
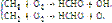
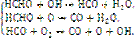

Итог единичного цикла
2СН4 + 4О2 → 2СО2 + 4Н2О.
Пламя горелки Бунзена.
Первая газовая горелка, работающая по принципу газовой инжекции, появилась в начале XIX в. Ее изобрел немецкий химик Ф. Бунзен. Современная лабораторная горелка Бунзена (рис. 17) мало отличается от оригинальной конструкции.
|
|
Горелка состоят из инжектора, встроенного в основание, через который газ подается в вертикальную смесительную трубу, куда поступает воздух через жалюзи цилиндрической формы, располо-

Рис. 17. Атмосферная горелка- с частичным Перемешиванием (горелка Бунзена):
/ — инжектор; 2 — смесительная труба; /, // — воздух соответственно вторичный и первичный; III — газ
женные вокруг инжектирующего сопла и позволяющие регулировать степень подсоса первичного воздуха и тем самым изменять форму и характер пламени. Воздух и газ по мере подъема по смесительной трубе взаимно диффундируют. Образующаяся смесь загорается на выходе из трубки при подсосе вторичного воздуха. Небольшая скорость распространения пламени обеспечивает образование на выходе из горелки устойчивого пламени. Необходимое условие стабилизации пламени — равенство скорости истечения газовоздушной смеси из горелки и скорости распространения пламени. Пламя, образуемое горелкой Бунзена, состоит из внутреннего конуса обычно голубого цвета, образованного негорящими газами, и наружной слегка светящейся оболочки горящего топлива. Конус и оболочка плотно прилегают друг к другу по всей окружности выходного отверстия смесительной трубки горелки Бунзена,
Смесительную трубу горелки Бунэена можно располагать не только вертикально, но и под наклоном и даже горизонтально. Инжекция газом осуществима в любом положении. Воздушные отверстия и жалюзи могут иметь постоянные или переменные размеры. Расход газа меняется в широких пределах, однако установлено, что слишком маленькие расходы газа и воздуха приводят к проскоку пламени, т. е. пламя с головки горелки уходит внутрь смесительной трубки, опускается вниз и горит на срезе инжектирующего сопла. Чрезмерный расход газа приводит к отрыву пламени от горелки. Вероятность проскока и отрыва пламени можно уменьшить, разбив выходное отверстие горелки на более мелкие отверстия.
Количество подсасываемого первичного воздуха оказывает влияние на качество пламени: недостаток его приводит к образованию мягкого светящегося диффузионного пламени; высокая степень подсоса вызывает шум, повышает масштаб турбулентности, делает пламя более острым и жестким. Расход газа варьируется в весьма широких пределах, что позволяет изменять длину пламени. Для большинства газов диапазон регулируемости (особенно для модифицированных горелок Бунзена) может меняться от 10 до 15.
После выбора тепловой мощности инжектирующего сопла для данного газа не так легко заменить его другим газом, не меняя характеристик горелки. Учитывая широкое применение инжекторных горелок, при любой замене одного газа другим необходимо следить за тем, чтобы характеристики сжигания последнего удовлетворяли требованиям той горелки Бунзена, которая была выбрана или разработана для сжигания заменяемого газа.
|
|
|
|
|

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!