Морфофизиологическая характеристика возбудителя африканского трипаносомоза («сонной болезни»). Жизненный цикл возбудителя «сонной болезни» гамбийского и родезийского типов. Пути заражения, лабораторная диагностика и профилактика африканского трипаносомоза.
Trypanosoma brucei gambiense и T.b. rhodesiense (кл. Жгутиковые) — возбудители африканского трипаносомоза, или сонной болезни. Паразит имеет извилистую заостренную с обеих сторон форму. Длина его 17—28 мкм. Стадии, паразитирующие у человека, имеют один жгутик, ундулирующую мембрану сбоку и хорошо заметный кинетопласт у основания жгутика.
Трипаносомы поселяются у человека в крови, лимфе, спинномозговой жидкости, в тканях головного и спинного мозга и в серозных полостях. T. b. gambiense встречается в Западной Африке, а T. b. rhodesiense — в Восточной и Юго-Восточной Африке.
Жизненный цикл этих паразитов протекает в организме человека, домашних и диких млекопитающих, в первую очередь копытных. T. b. gambiense чаще поражает человека, свиней и собак, T. b. rhodesiense — диких животных — антилоп и носорогов. Переносчиком первого подвида является муха це-це, Glossina palpalis, живущая поблизости от жилища человека, второго— G. morsitans, обитающая в открытых саваннах и саванновых лесах. В связи с этим сонная болезнь, возбудителем которой является T. b. gambiense, встречается в антропогенных очагах культурных ландшафтов. Ежегодно регистрируется около 10 000 новых случаев заражения. Восточноафриканский трипаносомоз распространен значительно реже в естественной природе. В основном заболевают охотники, туристы, сезонные рабочие, каждый год — около 1500 человек.
Сонная болезнь без лечения протекает около 5 лет и выражается в нарастающей мышечной слабости, депрессии, истощении и сонливости. Возможны случаи самоизлечения, но обычно заболевание заканчивается смертью больного.
Восточноафриканский трипаносомоз протекает более злокачественно, длится не более 6 мес. и также заканчивается смертью.
Для паразитирования трипаносом у млекопитающих и человека характерны циклические подъемы интенсивности инвазии за счет их размножения, сопровождающиеся изменениями строения и антигенных свойств паразитов. Во время увеличения количества паразитов в крови преобладают трипаносомы удлиненной формы. Антигены, которые они образуют, вызывают формирование антител в организме хозяина. Под действием антител многие паразиты гибнут и интенсивность инвазии снижается. Выжившие трипаносомы укорачиваются и начинают вырабатывать другие антигены. Укороченные формы паразита, инвазионные для мухи це-це, в ее организме вновь приобретают удлиненную форму, инвазионную для человека. Изменение формы тела и смена антигенных свойств оболочки повторяются многократно. Таким образом, популяция паразита в хозяине выживает и избегает его иммунной реакции.
Антигенные свойства поверхности трипаносомы зависят только от одного белка — гликопротеина, полностью покрывающего всю клетку. Гликопротеин построен из 470 остатков аминокислот. Каждая новая волна размножения паразитов представляет собой новую популяцию трипаносом, обладающих новым поверхностным антигеном. Эти вариации антигенных свойств помогают паразиту преодолевать иммунный ответ хозяина и делают невозможной вакцинацию населения, обитающего в природных очагах трипаносомозов.
Смена антигенных свойств обеспечивается заменой поверхностных гликопротеинов, кодируемых разными генами, относящимися к одному мультигенному семейству. Один клон трипаносом может образовывать попеременно до 100 разных варьирующих гликопротеинов. Гены этих протеинов возникли в процессе эволюции, вероятно, путем дупликаций и последующей дифференцировки, как и другие семейства генов. В геноме трипаносомы имеется сайт экспрессии, в который поочередно перемещаются гены поверхностных гликопротеинов, приближаясь к промотору, обеспечивающему их специфическую активацию. Там они транслируются. Не исключено, однако, что сайт экспрессии в геноме трипаносомы не единственный, и даже возможно, что разные гены гликопротеинов активируются несколькими механизмами. В любом случае речь идет о своеобразной адаптации паразита к специфическим условиям существования, повышающей его выживаемость и открывающей ему широкие эволюционные перспективы.
Лабораторная диагностика — исследование мазков крови и спинномозговой жидкости больного для выявления в них возбудителя. Используются также иммунологические реакции и заражение лабораторных животных.
Профилактика — кроме борьбы с переносчиками применяют профилактическое лечение здоровых людей, живущих в очагах трипаносомоза, делающее организм невосприимчивым к инвазии. Практиковавшийся ранее отстрел диких животных, являющихся природным резервуаром паразита, вряд ли рационален в связи с возможным нарушением экологического баланса, который складывался в биогеоценозах на протяжении тысячелетий.
Trypanosoma cruy — возбудитель американского трипаносомоза, или болезни Чагаса. Длина этой трипаносомы в крови человека достигает 20 мкм. Кинетопласт очень крупный, округлой формы. Характерной особенностью возбудителя является способность к внутриклеточному паразитизму. При этом трипаносомы проникают вначале в макрофаги кожи и слизистых оболочек, а затем и в клетки миокарда, нейроглии и мышц, теряя жгутики, ундулирующие мембраны, и превращаясь в безжгутиковые, или амастиготные, формы. Здесь и происходит размножение паразитов. В крови эти трипаносомы никогда не делятся. В конечном счете, пораженная клетка вся заполняется амастиготными формами трипаносом и разрывается, а паразиты инвазируют новые клетки. При этом часть их, превращаясь вновь в жгутиковую форму, поступает в кровь, откуда в дальнейшем они могут попасть в организм переносчика (рис. 19.9).
Переносчиками являются триатомовые клопы pp. Triatoma, Rhodnius и Panstrongylus (см. разд. 21.2.2). В них трипаносомы размножаются и достигают состояния инвазионности, поступая в заднюю кишку. Вскоре после кровососания клопы испражняются на покровы человека или животного и трипаносомы проникают в кровь через раневое отверстие от хоботка или через неповрежденные слизистые оболочки губ, носа и глаз. Окончательными хозяевами кроме человека являются броненосцы, опоссумы, крысы, обезьяны и домашние животные — собаки, кошки и свиньи.
Болезнь поражает в основном детей младшего возраста, у которых протекает остро. В старшем возрасте заболевание переходит в хроническую форму.
Патогенное действие выражается в поражении органов, в клетках которых развиваются паразиты: характерны миокардиты, кровоизлияния в мозговые оболочки и менингоэнцефалит. Иногда заболевание протекает легко и заканчивается самопроизвольным излечением.
Диагностика — в острой форме заболевания возможно обнаружение трипаносом в крови. При хроническом течении рационально введение крови больного морским свинкам, у которых они обнаруживаются в большом количестве на 14-е сутки. Существует еще и своеобразный метод диагностики — кормление на больном неинвазированных переносчиков-клопов, в кишечнике которых трипаносомы быстро размножаются и легко обнаруживаются. Применяют также и методы иммунодиагностики.
Трипаносомы представляют большой интерес не только потому, что способны вызывать у человека серьезные, смертельно опасные заболевания. Колоссальная экологическая пластичность, обеспечивающая им эффективное паразитирование в организме хозяина на протяжении нескольких лет, в условиях постоянно действующих механизмов иммунитета, позволяет этим паразитам осваивать и новых хозяев. Так, описанная в последние годы вспышка трипаносомоза в Эфиопии была вызвана адаптацией к человеку Т.b. brucei — подвида, паразитирующего обычно только у крупного рогатого скота и антилоп. Та же причина, вероятно, лежит в основе существования вспышек трипаносомозов в Индии и Малайзии, где у больных были выделены паразиты, обитающие обычно в крови грызунов и низших обезьян. В Центральной и Южной Америке кроме Т. cruzy известна и еще одна трипаносома — Т. rangeli, которая чаще паразитирует у кошек и собак, но способна инвазировать и человека, вызывая у него нетяжелую, быстро проходящую лихорадочную реакцию.
Морфофизиологическая характеристика малярийных плазмодиев. Диагностические признаки различий видов малярийных плазмодиев. Жизненный цикл возбудителя трёхдневной малярии. Пути заражения, лабораторная диагностика и профилактика малярии.
Малярийные плазмодии Plasmodium (кл. Споровики) — возбудители малярии. Известны следующие виды малярийных плазмодиев, паразитирующие у человека: Р. vivax — возбудитель трехдневной малярии, Р. falciparum — возбудитель тропической малярии, Р. malariae — возбудитель четырехдневной малярии, Р. ovale — возбудитель овале-малярии, близкой к трехдневной. Три первых вида широко распространены в тропических и субтропических климатических поясах, последний — только в тропической Африке. Все виды сходны морфологически и жизненными циклами, отличаясь друг от друга деталями строения и некоторыми особенностями цикла развития, проявляющимися в основном продолжительностью его отдельных периодов.
Жизненный цикл малярийных плазмодиев типичен для споровиков, включая стадии бесполого размножения в виде шизогонии, полового процесса и спорогонии. Окончательным хозяином паразитов является комар р. Anopheles (см. разд. 21.22), а промежуточным — только человек. Комар является одновременно и переносчиком. Поэтому малярия — типичное антропонозное трансмиссивное заболевание.
Со слюной зараженного комара при укусе плазмодии попадают в кровь человека (рис. 19.10). Развитие паразитов в организме человека происходит синхронно. С током крови они разносятся по организму и поселяются в клетках печени. Здесь они растут и размножаются шизогонией таким образом, что один паразит делится на тысячи дочерних особей. Клетки печени при этом разрушаются и паразиты, называющиеся на этой стадии мерозоитами, поступают в кровь и внедряются в эритроциты. С этого момента начинается эритроцитарная часть цикла развития плазмодия. Паразит питается гемоглобином, растет и размножается шизогонией. При этом каждый плазмодий делится на 8—24 мерозоита. После разрушения эритроцита мерозоиты попадают в плазму крови и оттуда в новые эритроциты, после чего весь цикл эритроцитарной шизогонии повторяется.
Из части мерозоитов в эритроцитах образуются незрелые половые клетки — мужские и женские гаметоциты. Они являются инвазионной стадией для комара. Дальнейшее их развитие возможно только в его пищеварительной системе. При укусе больного человека комаром гаметоциты попадают в желудок последнего, где из них образуются зрелые гаметы. В результате оплодотворения в желудке комара.
образуется подвижная зигота, которая перемещается на наружную поверхность стенки желудка и покрывается оболочкой, формируя ооцисту. С этого момента начинается период спорогонии, когда содержимое ооцисты многократно делится, образуя около 10000 спорозоитов — тонких серповидных клеток, которые после разрыва оболочки поступают в слюнные железы комара. При кровососании спорозоиты поступают в кровяное русло человека.
Таким образом, в организме человека плазмодий размножается только бесполым путем — шизогонией, человек является его промежуточным хозяином. В организме комара проходят две другие стадии цикла развития паразита: половой процесс — гаметогония и образование спорозоитов за счет деления под оболочкой ооцисты — спорогония. Поэтому малярийный комар является окончательным хозяином этого паразита.
Выход большого количества мерозоитов из эритроцитов сопровождается выбросом в плазму крови значительной массы токсических продуктов жизнедеятельности. Их воздействие на организм приводит к резкому повышению температуры, ознобу, слабости и головным болям. Такое состояние возникает внезапно и длится в среднем 1,5—2 ч. Вслед за этим наступает чувство жара, сухость во рту, жажда. Температура тела достигает 40—41°С. Через несколько часов все перечисленные симптомы исчезают, и больные обычно засыпают. Весь приступ может продолжаться от 6 до 12 ч. При трехдневной и овале-малярии промежутки между приступами составляют 48 ч, число таких приступов может достигать 10—15, после чего они прекращаются за счет повышения уровня специфического иммунитета, но паразиты в крови еще могут обнаруживаться. В таком случае человек становится паразитоносителем и продолжает представлять опасность для окружающих как возможный источник заражения.
Естественный отбор приводит к возникновению новых антигенных вариантов возбудителя, которые обеспечивают возможность наступления рецидивов заболевания. Рецидивы могут повторяться несколько раз, но постепенно популяция эритроцитарных паразитов полностью погибает. Однако в течение 3—5 лет инвазия может вновь активизироваться за счет находящихся в латентном состоянии в печени экзоэритроцитарных шизонтов, которые могут выходить из печеночных клеток и внедряться в эритроциты. Таким образом, весь процесс болезни может начаться снова.
При малярии, вызываемой Р. malariae, приступы повторяются через 72 ч. Часто встречается и бессимптомное носительство. Экзоэритро-цитарной стадии в цикле развития этого паразита нет, поэтому поздние рецидивы невозможны, хотя инвазия характеризуется упорным течением и длится до 40 лет.
При тропической малярии вначале приступы развиваются через разные промежутки времени, а позже — через 24 ч. От осложнений со стороны центральной нервной системы или почек возможна смерть больного. Шизонты в клетках печени не сохраняются, а заболевание может продолжаться до 18 мес.
Все виды малярийных плазмодиев могут инвазировать человека и при гемотрансфузии (переливание крови). В этом случае ни у одного из паразитов не формируется экзоэритроцитарной стадии. Поэтому поздних рецидивов в этом случае не бывает. Гемотрансфузионный способ заражения наиболее часто встречается при четырехдневной малярии в связи с тем, что при этой форме болезни шизонты в эритроцитах находятся в очень малом количестве и могут не обнаруживаться при исследовании крови доноров.
Иногда человек может быть инвазирован одновременно двумя или тремя видами плазмодиев. В таком случае малярийные приступы не имеют четкой периодичности и клинический диагноз затруднен.
Лабораторный диагноз малярии можно поставить только в период, соответствующий стадии эритроцитарной шизогонии, когда в крови удается обнаружить паразитов.
Плазмодий, недавно проникший в эритроцит, имеет кольцевидную форму. Его цитоплазма выглядит как ободок, окружающий крупную вакуоль с продуктами диссимиляции. Ядро паразита смещено к краю клетки. Следующая стадия называется амебовидным шизонтом. У паразита появляются ложноножки, а вакуоль увеличивается. Наконец плазмодий занимает почти весь эритроцит. Следующая стадия развития паразита — фрагментация шизонта. На фоне деформированного эритроцита обнаруживаются множественные мерозоиты, в каждом из которых лежит ядро. Кроме бесполых клеток в эритроцитах можно увидеть и гаметоциты. Они отличаются крупными размерами, не имеют псевдоподий и вакуолей.
Профилактика малярии — раннее выявление и лечение больных, профилактическое лечение в зонах широкого распространения малярии. Как и при любых трансмиссивных заболеваниях, необходима прицельная борьба с переносчиками.
Понятие о природно-очаговых заболеваниях. Примеры.
Е.Н.Павловский – основоположник учения о природной очаговости заболеваний.
Характерные особенности природно-очаговых заболеваний:
1. Циркулируют а природе независимо от человека.
2. Резервуаром служат дикие животные, составляющие с возбудителями и переносчиками биоценотический комплекс.
3. Распространены не повсеместно, а на ограниченной территории с определенным географическим ландшафтом, что связано с ареалом компонентов биоценоза.
Пример: таежный весенне-летний энцефалит. Природный резервуар –бурундук, белка, заяц, еж, обитающие в лесу и зараженные вирусом. Иксодовые клещи передают вирус от животного к животному. Территорию, на которой обитают дикие животные – резервуары возбудителя, а также переносчики называют природным очагом заболевания. Таким образом, условиями возникновения и существования очага служит присутствие возбудителя, животного-резервуара, восприимчивого к нему, переносчика и соответствующих природно-климатических условий,
обеспечивающих всем этим компонентам существование. Например, природный очаг лейшманиоза – это часть территории полупустыни Ии пустыни, где обитают песчанки, зараженные лейшманиями и москитами, живущими в их норах. Существующий природный очаг потенциально опасен для человека, так как он, попав на такую территорию, может заболеть, так как ему будет передан возбудитель антропозоонза. Зараженность животных-резервуаров и переносчиков на территории очага может быть значительной (66% песчанок и 3% москитов заражены в очагах лейшманиоза). Важную роль в существовании очага играет способность клещей к трансовариальной передаче возбудителя и климато-географические природные условия. Иногда один и тот же ландшафт может включать в себя очаги различных заболеваний. Например, норы грызунов полупустынь могут быть очагами не только лейшманиозов, но и клещевого возвратного тифа, чумы.
Первоначально природная очаговость была установлена только для трансмиссивных заболеваний, однако дальнейшие исследования показали, что подобный характер имеют многие иные заболевания, например, гельминтозы – описторхоз, парагонимоз, дифиллоботриоз. Учение Е.Н.Павловского сыграло важную роль в развитии медицинской паразитологии, а именно в определении мер профилактики данной группы заболеваний (болезнь Чагаса, трипаносомозы, желтая лихорадка, шистосоматозы). Раньше в профилактических мерах считали целесообразным лишь лечить больных людей и уничтожать переносчиков, однако более правильным оказалось уничтожение животных-резервуаров. Подобные меры позволили уменьшить число больных в очагах лейшманиоза с 90 до 0.04%.
Понятие о трансмиссивных болезнях. Примеры.
Трансмиссивные заболевания могут быть как паразитарными, так и инфекционными. Возбудители этих заболеваний передаются посредством переносчиков. Различают облигатно-трансмиссивные и факультативно-трансмиссивные заболевания. Облигатно-трансмиссивные передаются только через переносчика (малярия, сыпной тиф). Для передачи факультативно-трансмиссивных заболеваний участие переносчиков необязательно (туляремия и чума.) Переносчики играют важнейшую роль в распространении многих эпидемических заболеваний. Специфические связи между возбудителем и хозяином позволяет выделить следующие группы трансмиссивных заболеваний:
- зоонозы – болезни, свойственные только животным (малярия птиц).
- антропозоонозы – болезни, возбудители которых могут поражать как животных, так и человека и переносчик может обеспечить циркуляцию паразита между животными и человеком (чума, таежный энцефалит, лейшманиоз).
- антропонозы – болезни, свойственные Тольку человеку (трихомоноз, амебиаз).
Трансмиссивные болезни (лат. transmissio — перенесение на других) — заразные болезни человека, возбудители которых передаются кровососущими членистоногими (насекомыми и клещами).
Трансмиссивные болезни включают более 200 нозологических форм, вызываемых вирусами, бактериями, риккетсиями, простейшими и гельминтами. Часть из них передаётся только с помощью кровососущих переносчиков (облигатные трансмиссивные болезни, например сыпной тиф, малярия и др.), часть различными способами, в том числе и трансмиссивно (например, туляремия, заражение которой происходит при укусах комаров и клещей, а также при снятии шкурок с больных животных). В передаче возбудителей трансмиссивных болезней участвуют специфические и механические переносчики. В специфических переносчиках возбудитель либо размножается и накапливается (например, вирусы в теле клещей), либо созревает до инвазионной стадии (например, личинки филярий в комарах, мошках, слепнях, малярийные плазмодии в теле комаров). Как размножение, так и развитие возбудителей в теле специфических переносчиков может происходить только при достаточно высокой, строго определённой температуре для каждой пары паразит — переносчик. Так, половое размножение, или спорогония, возбудителя трёхдневной малярии продолжается 19 дней при 20 °C и 6½ дней при температуре 30 °C, и только после этого в слюнных железах переносчика появляется инвазионная стадия паразита — спорозоит. Передача возбудителя переносчиком осуществляется различными способами. Наиболее часто возбудитель проникает со слюной, которую переносчик вводит в место укола перед началом кровососания. Так вводятся спорозоиты малярийного паразита. Перенос риккетсий вшами (см. Сыпной тиф эпидемический) и трипаносом триатомовыми клопами происходит во время дефекации переносчика; возбудитель из фекалий проникает затем в ранку на месте укола. Возбудитель вшиного возвратного тифа (Borrelia recurrentis) скапливается в теле вши и может проникнуть в организм человека лишь при раздавливании вши руками и втирании ее гемолифмы в кожу при расчёсах. Многие переносчики передают лишь одного, специфического для них паразита. Так, мухи цеце передают лишь трипаносому — возбудителя сонной болезни человека, мошки — возбудителя онхоцеркоза, триатомовые клопы — возбудителя американского трипаносомоза (болезни Шагаса). Москиты могут переносить возбудителей лейшманиозов и лихорадки паппатачи. Наиболее разнообразные связи с паразитами установились у комаров и клещей. Комары семейства Culicidae передают многие виды вирусов, в том числе возбудителя жёлтой лихорадки, лихорадки денге, вирусных энцефалитов (см. Энцефалиты комариные). Они являются переносчиками также малярии и филяриатозов. Иксодовые клещи передают вирусы, в том числе возбудителей клещевого энцефалита и геморрагических лихорадок, риккетсий — возбудителей пятнистых лихорадок, североазиатского сыпного тифа (см. Североазиатский клещевой риккетсиоз) и др., а также спирохет. В переносе возбудителей болезни у многих групп насекомых участвуют только самки. У мухи цеце, вшей и у всех групп клещей кровососами и переносчиками являются особи обоего пола.В ряде случаев возбудитель болезни передается переносчиком своему потомству. Такая трансовариальная передача выявлена у комаров, инфицированных вирусами, у клещей, инфицированных вирусами, риккетсиями и спирохетами, и у москитов, инфицированных флебовирусами..В организме механических переносчиков возбудители не развиваются и не размножаются. Попавший на хоботок, в кишечник или на поверхность тела механического переносчика возбудитель передается непосредственно (при укусе) либо путем контаминации ран, слизистых оболочек хозяина или пищевых продуктов. Самыми распространенными механическими переносчиками являются мухи семейства Muscidae, которые известны как переносчики вирусов, бактерий, простейших, гельминтов.
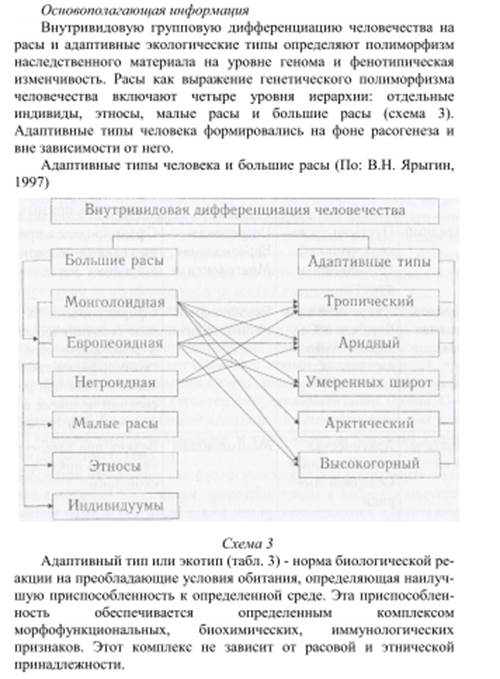
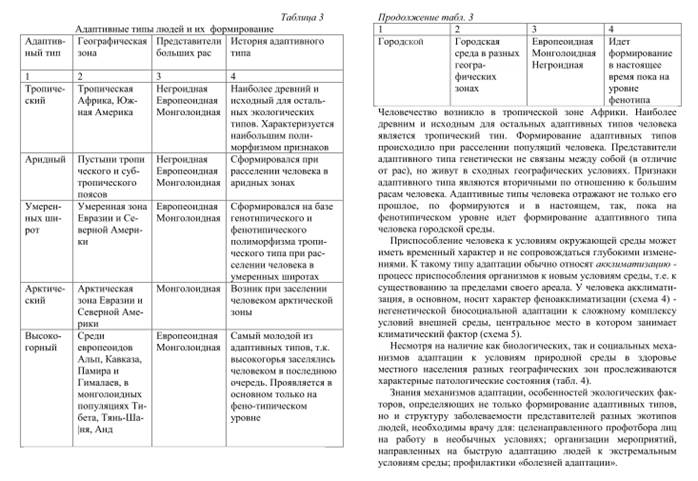
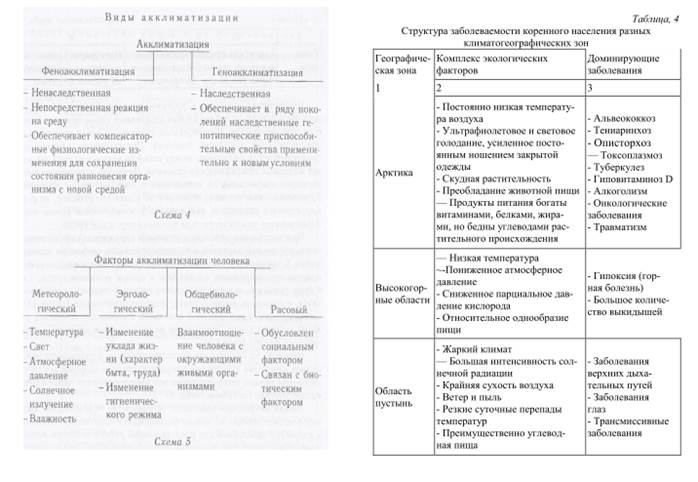
Адаптивных типов:
- тропического,
-арктического,
-высокогорного,
-зоны пустынь и полупустынь (аридного).

Морфофизиологическая характеристика вегетативных форм и цисты дизентерийной амебы. Жизненный цикл дизентерийной амебы. Пути заражения, лабораторная диагностика и профилактика амебиаза.
Амебиаз -- протозойная инфекция, характеризующаяся язвенным поражением толстой кишки, возможностью образования абсцессов в различных органах и склонностью к затяжному и хроническому течению. Это заболевание характеризуется эндемичностью (заболевание, свойственное данной местности) и преимущественно распространено в районах с жарким климатом.
Возбудитель заболевания -- дизентерийная амеба. Жизненный цикл дизентерийной амебы включает две стадии -- вегетативную (трофозоит) и покоя (циста), которые могут переходить одна в другую в зависимости от условий обитания в организме хозяина.Дизентерийная амеба в организме больного человека встречается в трех формах.
Просветная форма дизентерийной амёбы (лат. forma minuta) имеет размер около 20 мкм. Находится в верхнем отделе толстого кишечника. Движется с помощью псевдоподий. Ядро сферическое, 3–5 мкм в поперечнике, хроматин расположен под ядерной оболочкой в виде небольших глыбок; в центре ядра небольшая кариосома.
При внедрении просветной формы амёбы в ткани образуется тканевая форма (лат. forma magna) размером 20–60 мкм. В отличие от просветной формы не содержит в цитоплазме никаких включений. В этой стадии амёба размножается в стенке толстой кишки, образуя язвы. Язвенное поражение толстого кишечника сопровождается выделением слизи, гноя и крови.
Просветные и тканевые формы амёбы, попавшие в просвет кишки из язв, увеличиваются в размере до 30 мкм и больше и приобретают способность фагоцитировать эритроциты. Эта форма называется большой вегетативной, или эритрофагом.
Иногда амёбы из кишечника по кровеносным сосудам проникают в другие органы (прежде всего печень), формируя там вторичные очаги — абсцессы (внекишечный амёбиаз).
При затихании острой фазы болезни большая вегетативная форма уменьшается в размерах, переходит в просветную форму, которая инцистируется в кишечнике. Выброшенная при дефекации во внешнюю среду, она погибает в течение 15–20 минут.
Мелкая вегетативная форма обитает в просвете кишки. Размеры ее 8—20 мкм. В цитоплазме можно обнаружить бактерии и грибки — элементы микрофлоры кишечника.
Крупная вегетативная форма также обитает в просвете кишки в гнойном содержимом язв кишечной стенки. Ее размеры — до 45 мкм. Цитоплазма четко разделена на прозрачную, стекловидную эктоплазму и зернистую эндоплазму. В ней расположены ядро с характерной темно окрашенной кариосомой и эритроциты, которыми она питается. Крупная форма энергично передвигается с помощью широких псевдоподий.
В глубине пораженных тканей располагается тканевая форма. Она мельче крупной вегетативной формы и не имеет в цитоплазме эритроцитов. Цисты обнаруживаются в фекалиях хронически больных и паразитоносителей, у которых заболевание проходит бессимптомно. Цисты имеют округлую форму диаметром 8—15 мкм и от одного до четырех ядер в виде колечек.
Цисты образуются при сгущении фекалий в толстой кишке. Просветная форма окружается оболочкой и превращается в шаровидную цисту (размер около 12 мкм) с 4 ядрами, не отличающимися по строению от ядра вегетативной формы. Незрелые цисты содержат от 1 до 3 ядер. Имеют вакуоль с гликогеном. Часть цист хроматоидные тела.
С фекалиями цисты выбрасываются во внешнюю среду и при попадании в желудочно-кишечный тракт человека после метацистной стадии развития (деления на 8 дочерних амёб) образуют просветные формы.
Цисты могут сохранять жизнеспособность в воде и влажной почве более месяца.
Источником инфекции является человек, больной острой и хронической формой амебиаза, выздоравливающий, цистоноситель. Путь передачи -- фекально-оральный. Возможны различные пути распространения амебиаза -- пищевой, водный, контактно-бытовой. Факторами передачи возбудителя чаще являются пищевые продукты, особенно овощи и фрукты, реже -- вода, предметы домашнего обихода, белье, посуда, игрушки и т. д. Рассеиванию цист амеб способствуют мухи и тараканы.
Человек заражается амебной формой дизентерии через рот и только цистами. Цисты, попав в желудочно-кишечный тракт, под воздействием панкреатического сока освобождаются от оболочки, превращаются в вегетативные формы, которые и внедряются в стенку толстой кишки, преимущественно восходящей части ободочной и слепой, где образуется язвенный процесс. Иногда язвы возникают в прямой и сигмовидной кишках. Язвы бывают глубокие, часто проникающие до серозного покрова, вследствие чего может быть прободение кишечной стенки.
Гематогенная диссеминация амеб вызывает развитие внекишечного амебиаза с формированием абсцессов в печени, легких, головном мозге и других органах. Длительный, хронически протекающий кишечный амебиаз может послужить причиной образования кист, полипов и амебом. Амебомы представляют собой опухолевидные образования в стенке толстой кишки.
Амебиазом болеют люди различного возраста, но, по статистическим данным, чаще мужчины в возрасте 20--50 лет.
Дизентоерийные амебы, паразитируя в кишечнике, поражают преимущественно его слизистую оболочку. В результате воспалительного процесса происходит образование язв. Диаметр язв различный -- от нескольких миллиметров до 2--2,5 см. Дно язв покрыто гноем. В тяжелых случаях возможны перфорация кишечной стенки и развитие гнойного перитонита. Заживление язв влечет за собой разрастание соединительной ткани, стеноз и даже полную непроходимость кишечника.
Возможно гематагенное распространение амеб, что приводит к внекишечному амебиазу. Чаще всего поражается печень, в ней возникают очаги некроза, которые затем абсцедируются. Амебные абсцессы могут развиваться в легких, коже, головном мозге и других органах.
Жизненный цикл паразита сложен (рис. 19.4). Человек заражается амебиазом, проглатывая цисты паразита с водой или пищевыми продуктами, загрязненными землей. В просвете толстой кишки из цисты образуется, за счет следующих друг за другом делений, восемь мелких клеток, превращающихся в мелкие вегетативные формы. Вреда человеку они не приносят. Они могут вновь инцистироваться и выходить наружу. При ухудшении условий существования хозяина мелкие вегетативные формы способны превращаться в крупные, которые вызывают образование язв. Погружаясь глубже, они превращаются в тканевые формы, которые в особо тяжелых случаях могут попадать в кровь и разноситься по всему организму. При этом возможно образование абсцессов в печени, легких и других органах. В остром периоде заболевания у больного в фекалиях обнаруживаются не только цисты, но и трофозоиты.
Диагноз ставится на основе обнаружения в фекалиях трофозоитов с заглоченньми эритроцитами. Четырехъядерные цисты могут свидетельствовать скорее о хроническом течении заболевания или о пара-зитоносительстве.
Личная профилактика — соблюдение правил гигиены питания. Общественная профилактика — санитарное благоустройство туалетов, предприятий общественного питания.
2. Морфофизиологическая характеристика вегетативных форм и цисты балантидия. Жизненный цикл балантидия. Пути заражения, лабораторная диагностика и профилактика балантидиаза.
Возбудитель болезни относится к типу простейших. Балантидии являются наиболее крупными представителями паразитических простейших человека. Жизненный цикл паразита включает две стадии — вегетативную и цистную. Вегетативная стадия имеет овальную форму, более узкую с одной стороны, размерами 50—80 мкм в длину и 35—60 мкм в ширину. Тело инфузории покрыто спиральными рядами ресничек, обеспечивающих вращательно-поступательное движение возбудителя. На переднем конце расположено ротовое отверстие, окруженное ресничками, способствующими захвату пищевых комочков. Вегетативные формы паразита чувствительны к неблагоприятным условиям внешней среды и быстро в ней погибают; в фекалиях могут сохраняться до 5—6 ч. Цисты балантидиев имеют округлую форму, достигают 50—60 мкм в диаметре. Цисты могут сохранять жизнеспособность во внешней среде в течение нескольких недель. Балантидиаз — кишечный зооноз. Резервуар возбудителей — свиньи. В случаях крайне неблагоприятных санитарно-гигиенических условий инвазированный человек может служить дополнительным источником паразитов.
Механизм заражения — фекально-оральный, через воду, загрязненную фекалиями свиней, через овощи, почву. Возможно заражение человека от свиней контактно-бытовым путем при уходе за животными и несоблюдении гигиенических норм. Балантидиаз регистрируется в виде спорадических случаев, в основном среди сельских жителей, занятых свиноводством. Наибольшее число случаев болезни описано в странах Азии (Китай, Филиппины), Северной и Южной Америки (Бразилия, Венесуэла), Африки (Египет, Заир, Судан), на Гавайях.
Проглоченные цисты балантидиев достигают восходящих отделов толстой кишки, превращаясь в трофозоиты (вегетативная форма), размножаются преимущественно в слепой кишке. Паразитирование балантидиев может не сопровождаться выраженными клиническими проявлениями. В результате синтеза гиалуронидазы инфузории приобретают возможность внедриться в слизистую оболочку толстой кишки, где развиваются гиперемия пораженных участков, усиление пролиферации эпителия кишечных крипт (либеркюновые железы), его некроз с образованием эрозий, на месте которых в дальнейшем могут формироваться глубокие язвы. Язвенные дефекты расположены обычно в местах перегибов кишечной стенки, преимущественно в слепой, сигмовидной и прямой кишке. Язвы расположены вдоль складок слизистой оболочки, края их неровные, подрытые, дно покрыто некротическими массами. Окружающие участки слизистой оболочки гиперемированы и отечны. В краях язвы и в толще слизистой оболочки часто обнаруживаются возбудители. Поражаются мезентериальные лимфатические узлы.
Профилактика включает соблюдение мер личной гигиены при уходе за свиньями (мытье рук после работы и перед едой), запрещение использования воды из открытых водоемов без предварительного обеззараживания. Важно своевременное выявление, госпитализация и лечение больных балантидиазом и носителей балантидий. Выписка переболевших из стационара разрешается только после 3 отрицательных анализов фекалий в течение 1 нед.
Балантидий Balantidium coli (кл. Инфузории) — возбудитель балантидиаза. Это крупное простейшее, длиной до 200мкм. Сохранены многие признаки свободноживущих инфузорий: все тело покрыто ресничками, имеются цитостом и цитофаринкс. Под пелликулой расположен слой прозрачной эктоплазмы, глубже находится эндоплазма с органеллами и двумя ядрами. Макронуклеус имеет гантелевидную или бобовидную форму, рядом с ним находится маленький микронуклеус. Циста балантидия овальна, до 50—60 мкм в диаметре, покрыта двуслойной оболочкой, ресничек не имеет. Микронуклеус обычно не виден, а в цитоплазме отчетливо выделяется сократительная вакуоль.
Балантидий может жить в кишечнике человека, питаясь бактериями и не принося ему вреда, но иногда внедряется в стенку кишки, вызывая образование язв с гнойным и кровянистым отделением. В этом случае в его цитоплазме часто обнаруживаются форменные элементы крови хозяина. Для заболевания характерны длительные поносы с кровью и гноем, а иногда и перфорация кишечной стенки с перитонитом. Как и при амебной дизентерии, В. coli может попадать в кровеносное русло и оседать в печени, легких и других органах, вызывая там образование абсцессов.
Особенностью этих инфузорий является их способность вырабатывать фермент гиалуронидазу, благодаря которой они внедряются и в неповрежденную стенку кишки, где на гистологических препаратах обнаруживаются целые скопления тканевых трофозоитов, морфологически не отличимых от живущих в просвете кишки, но не способных к образованию цист. Кроме человека, балантидий встречается также у крыс и свиней, которые и являются его основным резервуаром.
Лабораторная диагностика — обнаружение цист и трофозоитов в мазках фекалий больного.
Профилактика — как при лямблиозе, однако в связи с зоонозной природой балантидиаза следует также вести борьбу с грызунами и обеспечивать гигиеническое содержание свиней.










