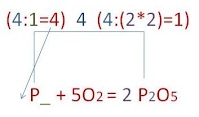Основные законы химии.
(Стехиометрия. Закон сохранения массы веществ. Закон постоянства состава веществ молекулярной структуры. Закон Авогадро и следствия из него)
По этой теме я решила для вас найти интересный материал вне учебника
Ход занятия
1. Прочитайте лекционный материал
2. Выполните все задания, которые есть в лекционном материале.
3. Выполните домашнее задание (см. пункт 2), сделав все соответствующие записи с отметкой о пункте (теме, например: тема 2 или Закон сохранения массы веществ) и номере задания.
Лекционный материал
1. Стехиоме́трия
Стехиоме́трия (от др.-греч. στοιχεῖον «элемент» + μετρέω «измерять») — система законов, правил и терминов, обосновывающих расчёты состава веществ и количественных соотношений между массами (объёмами для газов) веществ в химических реакциях.
Термин «стехиометрия» ввёл И. Рихтер в книге «Начала стехиометрии, или Искусство измерения химических элементов» (J. B. Richter. Anfangsgründe der Stöchyometrie oder Meßkunst chymischer Elemente. Erster, Zweyter und Dritter Theil. Breßlau und Hirschberg, 1792–93), обобщивший результаты своих определений масс кислот и оснований при образовании солей.
Стехиометрия включает нахождение химических формул, составление уравнений химических реакций, расчёты, применяемые в препаративной химии и химическом анализе. Понятие стехиометрии относят как к химическим соединениям, так и к химическим реакциям.
Соотношения, в которых, согласно законам стехиометрии, вступают в реакцию вещества, называют стехиометрическими, так же называют соответствующие этим законам соединения. В стехиометрических соединениях химические элементы присутствуют в строго определённых соотношениях (соединения постоянного стехиометрического состава, они же дальтониды).
Примером стехиометрических соединений могут служить вода Н2О, сахароза С12Н22О11 и практически все другие органические, а также множество неорганических соединений.
В то же время многие неорганические соединения в силу разных причин могут иметь переменный состав (бертоллиды). Вещества, для которых наблюдаются отклонения от законов стехиометрии, называют нестехиометрическими. Так, оксид титана(II) имеет переменный состав, в котором на один атом титана может приходиться от 0,65 до 1,25 атомов кислорода.
В основе стехиометрии лежат законы сохранения массы, эквивалентов, закон Авогадро, Гей-Люссака, закон постоянства состава, закон кратных отношений. Открытие законов стехиометрии, строго говоря, положило начало химии как точной науки. Правила стехиометрии лежат в основе всех расчётов, связанных с химическими уравнениями реакций и применяются в аналитической и препаративной химии, химической технологии и металлургии.
2. Закон сохранения массы веществ
Проблемный вопрос: изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
Чтобы ответить на данный вопрос наблюдайте за следующими видео-экспериментами: (пройдите по ссылкам)
Горение свечи в замкнутом сосуде
Сохранение массы веществ в реакциях
Вывод: Масса веществ до и после реакции не изменилась.
Формулировка закона сохранения массы: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.

Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки.
Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым.
Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.

Химические уравнения
Закон сохранения массы веществ применяется при составлении уравнений химических реакций.
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
Посмотрим видео - эксперимент: Нагревание смеси железа и серы (пройдите по ссылке)
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1.
Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства:
Zn + O2 → ZnO
Fe + Cl2→ FeCl3
Mg + HCl → MgCl2 + H2
Al(OH)3 → Al2O3 + H2O
HNO3→ H2O+NO2+O2
CaO+H2O→ Ca(OH)2
H2+Cl2→ HCl
KClO3→ KClO4+KCl
Fe(OH)2+H2O+O2→ Fe(OH)3
KBr+Cl2→ KCl+Br2
№2.
Используя алгоритм составления уравнений химических реакций, составьте уравнения реакций взаимодействия между следующими парами веществ:
1) Na и O2
2) Na и Cl2
3) Al и S
3. Закон постоянства состава вещества
Вы изучали знаки химических элементов, их произношение, порядковый номер; изучали, что такое «относительная атомная масса». Вспомним, что ученые прошлого пытались создать атомно-молекулярную теорию, но эти разработки во второй половине 18 века не продвинулись вперед. Для окончательного формирования этого учения не хватало знания законов, определяющих отношения между количеством веществ реагирующих друг с другом и образующихся при химических реакциях. Эти законы были открыты лишь в конце 18 в начале 19 века.
В результате установления закона сохранения массы с конца 18 века в химии прочно утвердились количественные методы исследования. Был изучен количественный состав многих веществ. При этом был установлен закон постоянства состава вещества.
Представьте себе на минутку: Вы закончили медуниверситет и открыли частную стоматологическую клинику.
К Вам пришел пациент, которому Вы поставили диагноз: «Кариес».
Кариес зубов - самая распространенная болезнь нашего времени. Если ее запустить, кариозная полость доходит до пульпы – ткани, содержащей нервы, кровеносные и лимфатические сосуды.
Зуб очень болит. Чтобы обезболить, врач вынужден убить нерв. Для этого используется «мышьяк» - паста, содержащая мышьяковистую кислоту, вещество, имеющее определенный состав. Это вещество быстро проникло в пульпу, и через 24-48 часов зуб был мертв. Теперь Вы можете поставить пломбу.
- Как узнать формулу этого вещества (мышьяковистой кислоты)?
- В каком соотношении находятся элементы в этом веществе?
- Это вещество имеет постоянный или переменный состав?
Отвечая на эти вопросы, сформулируйте, пожалуйста, цели и задачи сегодняшнего урока.
Вывод: в ходе сегодняшнего урока мы изучим закон постоянства состава вещества; научимся применять закон на практике; научимся отличать вещества постоянного состава от переменного.
Ученые XVII-XVIII вв. проводили множество количественных измерений, в т.ч. по определению массовой доли элемента в веществе.
Но результаты их опытов были неточными, и как следствие, не совпадали.
Французский химик Клод Луи Бертолле пытался доказать, что состав веществ зависит от пропорций, в которых находятся реагирующие вещества.
В отличие от него другой французский химик Жозеф Луи Пруст провел много экспериментов по исследованию состава различных веществ и сделал вывод о постоянстве состава вещества.
Формулировка, предложенная Прустом, гласит: когда несколько элементов образуют химически чистый образец, то он состоит из одних и тех же атомов. Отношения их масс и числа также носят постоянный характер.
Примеры:
1. Хлорид натрия (NaCl) можно получить при взаимодействии соляной кислоты с гидроксидом натрия. Второй способ — обработка соляной кислотой карбоната натрия. В двух разных химических реакциях получаем соединение, формула которого NaCl. И в первом, и во втором случае вещество содержит 39,33% натрия и 60,66% хлора.2.
2. Кислород (химический знак O) при образовании молекулы воды соединяется с одним и тем же количеством водорода (H). Если взаимодействует 1,11 г водорода с 8,89 г кислорода, то образуется 10 г воды (H2O). Увеличение количества одного из веществ приводит к такому же результату. Не прореагируют атомы того элемента, которого взяли в избытке. Масса воды в этом опыте остается такой же – 10 г, состав ее молекул отражает формула H2O, то образуется 10 г воды (H2O). Увеличение количества одного из веществ приводит к такому же результату. Не прореагируют атомы того элемента, которого взяли в избытке. Масса воды в этом опыте остается такой же – 10 г, состав ее молекул отражает формула H2O.
Суть закона
В своей работе «Исследование меди» в 1799 г. Пруст показал, что природный карбонат меди и карбонат меди, полученный химиками в лаборатории, имеют один и тот же состав.
Ничем не различаются вода, текущая из нашего крана, вода из родника, или вода, полученная синтетическим путем (имеется в виду состав чистого вещества – воды, а не состав смеси). Вода всегда будет содержать по массе 11,1 % водорода и 88,9 % кислорода.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, - является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
На основе закона постоянства состава вещества можно производить различные расчеты.
Задача №1. В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H2SO4?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H2SO4
m(H): m(S): m(O) = 2Ar(H): Ar(S): 4Ar(O) = 2: 32: 64 = 1: 16: 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г - Н, 16 г - S и 32 г - О.
Задача №2. Водород соединяется с серой в массовых отношениях 1: 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32.
Обозначим количество атомов водорода в формуле - х, а серы - у: НхSу
m(H): m(S) = хAr(H): уAr(S)= х1: у32 = (2х1): (1х32) = 2: 32 = 1: 16
Следовательно, формула сероводорода Н2S
Задача №3. Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле - х, серы - у, а кислорода - z: CuxSyOz
m(Cu): m(S): m(O) = хAr(Cu): уAr(S): zAr(O) = x64: y32: z16 = (1х64): (1х32): (4*16) = 64:32:64 = 2:1:2
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Решите задачи
№1. Применяя сведения об относительных атомных массах химических элементов, вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H2CO3.
№2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1:8?
№3. Углерод и кислород в углекислом газе соединяются в массовых отношениях 3:8.
Выведите химическую формулу углекислого газа
№4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношеннии 1:8.
Закон Авогадро.
Итак, нас интересует, как связаны между собой объем газов и количество молекул, содержащихся в этом объеме? Этим вопросом заинтересовался в начале XIX столетия итальянской ученый Амедео Авогадро.
После многочисленных экспериментов с газообразными веществами он в 1811 году сформулировал свой закон, который со временем получил название закона Авогадро.

Формулировка закона - В равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул.
Прошу напомнить, сколько молекул содержит 1 моль любого вещества? (содержит одинаковое число молекул, это число равно 6,02 • 1023 молекул.)

Примеры:
1 моль воды = 6,02·1023 молекул Н2О,
1 моль железа = 6,02·1023 атомов Fe,
1 моль хлора = 6,02·1023 молекул Cl,
1 моль ионов хлора Cl = 6,02·1023 ионов Cl-,
1 моль кислорода О2 = 6,02·1023 молекул О2.
А как вы думаете, в честь кого названо это число? (В честь итальянского ученого Амедео Авогадро это число назвали постоянной Авогадро)

Прошу записать со слайда обозначение постоянной Авогадро NA = 6,02 ∙1023 молекул/моль
При вычислении постоянной Авогадро используют следующие формулы NA = N/n n = N/NA N=NA ∙ n
Слайд 5

Прошу напомнить, что обозначают:
- N – количество молекул
- n – количество вещества
Сообщаю, что постоянная Авогадро настолько велика, что с трудом поддается воображению.
В пустыне Сахара содержится менее трех молей самых мелких песчинок.
Если взять 1 моль долларовых бумажек, то они покроют все материки Земли 2-х километровым плотным слоем.
Но вернемся к закону Авогадро. Из него следует, что какой бы мы с вами газ не взяли, в равных его объёмах при одинаковых условиях будет содержаться одинаковое число молекул. Прошу привести примеры.
У каждого закона есть свои следствия и дополнения. Так и у закона Авогадро оно имеется – массы различных газов, в которых содержится одинаковое число молекул, должны занимать одинаковые объемы.

И так, экспериментально доказано, что 1 моль любого вещества содержит 6,02 . 1023 молекул, это величина постоянна у любого газа при н.у. (нормальных условиях) и не изменяется; так же экспериментально установлено, что масса любого газа при н.у. занимает одинаковый объем.
Наводящие вопросы.
- Как можно назвать объем 1 моль газа по аналогии с молярной массой? (Молярный объем)
- Каким будет молярный объем любого газа при одинаковых условиях? (22,4 л/моль)
Правильно, прошу записать определение молярного объема в тетрадь. (Объём 1 моль данного газа называют молярным объёмом и обозначают VМ = 22,4л/моль)
Запишите формулу нахождения молярного объёма

Расшифруем каждый показатель:
Vm молярный объём, величина постоянная = 22,4 л/моль
V объём выражается в л, м3, мл
n количество вещества выражается в молях
Прошу, используя исходную формулу получить объём и количество вещества:
V = Vm ∙ n
Зная молярный объем газа, можно определить количество вещества л, которое содержится в объеме V при нормальных условиях:
пVт = 22,4 л/моль.
Если мы знаем, что в одном моле вещества содержится такое количество молекул, которое равняется числу Авогадро, то можем вычислить число молекул газа в определенном объеме при нормальных условиях: N
Задание: Назовите это число. Работая с текстом учебника, интернет-ресурса, прочитайте и запишите следствие закона.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Решение задач
Задача № 1 Расcчитайте молярную массу углекислого газа СО2
Задача № 2 Вычислите массу СО2, если n = 2 моль
Закрепление изученного
А) Найдите число молекул при н.у. для 4 моль азота N2.
Б) Найдите число молекул при н.у. для 5,6 моль кислорода О2.
В) Найдите объём, который при н.у. займут 5 моль углекислого газа СО2.
Г) Найдите объём, который при н.у. займут 0,25 моль хлора Сl2.
Д) Вычислите, какой объём при н.у. займет азот массой 560г.
Е) Вычислите, какой объём при н.у. займет оксид серы SO2 массой 8г.
Готовые ответы должны быть оформлены в формате «Word». Название файла должно содержать фамилию студента, группу и дату задания. Например, «Петров Ст119 23.03.20»
Ваши ответы жду на электронный адрес [email protected]
Основные законы химии.
(Стехиометрия. Закон сохранения массы веществ. Закон постоянства состава веществ молекулярной структуры. Закон Авогадро и следствия из него)
По этой теме я решила для вас найти интересный материал вне учебника
Ход занятия
1. Прочитайте лекционный материал
2. Выполните все задания, которые есть в лекционном материале.
3. Выполните домашнее задание (см. пункт 2), сделав все соответствующие записи с отметкой о пункте (теме, например: тема 2 или Закон сохранения массы веществ) и номере задания.
Лекционный материал
1. Стехиоме́трия
Стехиоме́трия (от др.-греч. στοιχεῖον «элемент» + μετρέω «измерять») — система законов, правил и терминов, обосновывающих расчёты состава веществ и количественных соотношений между массами (объёмами для газов) веществ в химических реакциях.
Термин «стехиометрия» ввёл И. Рихтер в книге «Начала стехиометрии, или Искусство измерения химических элементов» (J. B. Richter. Anfangsgründe der Stöchyometrie oder Meßkunst chymischer Elemente. Erster, Zweyter und Dritter Theil. Breßlau und Hirschberg, 1792–93), обобщивший результаты своих определений масс кислот и оснований при образовании солей.
Стехиометрия включает нахождение химических формул, составление уравнений химических реакций, расчёты, применяемые в препаративной химии и химическом анализе. Понятие стехиометрии относят как к химическим соединениям, так и к химическим реакциям.
Соотношения, в которых, согласно законам стехиометрии, вступают в реакцию вещества, называют стехиометрическими, так же называют соответствующие этим законам соединения. В стехиометрических соединениях химические элементы присутствуют в строго определённых соотношениях (соединения постоянного стехиометрического состава, они же дальтониды).
Примером стехиометрических соединений могут служить вода Н2О, сахароза С12Н22О11 и практически все другие органические, а также множество неорганических соединений.
В то же время многие неорганические соединения в силу разных причин могут иметь переменный состав (бертоллиды). Вещества, для которых наблюдаются отклонения от законов стехиометрии, называют нестехиометрическими. Так, оксид титана(II) имеет переменный состав, в котором на один атом титана может приходиться от 0,65 до 1,25 атомов кислорода.
В основе стехиометрии лежат законы сохранения массы, эквивалентов, закон Авогадро, Гей-Люссака, закон постоянства состава, закон кратных отношений. Открытие законов стехиометрии, строго говоря, положило начало химии как точной науки. Правила стехиометрии лежат в основе всех расчётов, связанных с химическими уравнениями реакций и применяются в аналитической и препаративной химии, химической технологии и металлургии.
2. Закон сохранения массы веществ
Проблемный вопрос: изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
Чтобы ответить на данный вопрос наблюдайте за следующими видео-экспериментами: (пройдите по ссылкам)
Горение свечи в замкнутом сосуде
Сохранение массы веществ в реакциях
Вывод: Масса веществ до и после реакции не изменилась.
Формулировка закона сохранения массы: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.

Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки.
Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым.
Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.

Химические уравнения
Закон сохранения массы веществ применяется при составлении уравнений химических реакций.
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
Посмотрим видео - эксперимент: Нагревание смеси железа и серы (пройдите по ссылке)
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
Алгоритм составления уравнения химической реакции
| Составим уравнение химической реакции взаимодействия фосфора и кислорода
|
| 1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку:
P + O2 →
|
| 2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
P + O2 → P2O5
|
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
- Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
- В данном случае это атомы кислорода.
- Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:

- Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:

- Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:
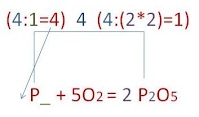
- Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен:
4P + 5O2 = 2P2O5
|
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1.
Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства:
Zn + O2 → ZnO
Fe + Cl2→ FeCl3
Mg + HCl → MgCl2 + H2
Al(OH)3 → Al2O3 + H2O
HNO3→ H2O+NO2+O2
CaO+H2O→ Ca(OH)2
H2+Cl2→ HCl
KClO3→ KClO4+KCl
Fe(OH)2+H2O+O2→ Fe(OH)3
KBr+Cl2→ KCl+Br2
№2.
Используя алгоритм составления уравнений химических реакций, составьте уравнения реакций взаимодействия между следующими парами веществ:
1) Na и O2
2) Na и Cl2
3) Al и S
3. Закон постоянства состава вещества
Вы изучали знаки химических элементов, их произношение, порядковый номер; изучали, что такое «относительная атомная масса». Вспомним, что ученые прошлого пытались создать атомно-молекулярную теорию, но эти разработки во второй половине 18 века не продвинулись вперед. Для окончательного формирования этого учения не хватало знания законов, определяющих отношения между количеством веществ реагирующих друг с другом и образующихся при химических реакциях. Эти законы были открыты лишь в конце 18 в начале 19 века.
В результате установления закона сохранения массы с конца 18 века в химии прочно утвердились количественные методы исследования. Был изучен количественный состав многих веществ. При этом был установлен закон постоянства состава вещества.
Представьте себе на минутку: Вы закончили медуниверситет и открыли частную стоматологическую клинику.
К Вам пришел пациент, которому Вы поставили диагноз: «Кариес».
Кариес зубов - самая распространенная болезнь нашего времени. Если ее запустить, кариозная полость доходит до пульпы – ткани, содержащей нервы, кровеносные и лимфатические сосуды.
Зуб очень болит. Чтобы обезболить, врач вынужден убить нерв. Для этого используется «мышьяк» - паста, содержащая мышьяковистую кислоту, вещество, имеющее определенный состав. Это вещество быстро проникло в пульпу, и через 24-48 часов зуб был мертв. Теперь Вы можете поставить пломбу.
- Как узнать формулу этого вещества (мышьяковистой кислоты)?
- В каком соотношении находятся элементы в этом веществе?
- Это вещество имеет постоянный или переменный состав?
Отвечая на эти вопросы, сформулируйте, пожалуйста, цели и задачи сегодняшнего урока.
Вывод: в ходе сегодняшнего урока мы изучим закон постоянства состава вещества; научимся применять закон на практике; научимся отличать вещества постоянного состава от переменного.
Ученые XVII-XVIII вв. проводили множество количественных измерений, в т.ч. по определению массовой доли элемента в веществе.
Но результаты их опытов были неточными, и как следствие, не совпадали.
Французский химик Клод Луи Бертолле пытался доказать, что состав веществ зависит от пропорций, в которых находятся реагирующие вещества.
В отличие от него другой французский химик Жозеф Луи Пруст провел много экспериментов по исследованию состава различных веществ и сделал вывод о постоянстве состава вещества.
Формулировка, предложенная Прустом, гласит: когда несколько элементов образуют химически чистый образец, то он состоит из одних и тех же атомов. Отношения их масс и числа также носят постоянный характер.
Примеры:
1. Хлорид натрия (NaCl) можно получить при взаимодействии соляной кислоты с гидроксидом натрия. Второй способ — обработка соляной кислотой карбоната натрия. В двух разных химических реакциях получаем соединение, формула которого NaCl. И в первом, и во втором случае вещество содержит 39,33% натрия и 60,66% хлора.2.
2. Кислород (химический знак O) при образовании молекулы воды соединяется с одним и тем же количеством водорода (H). Если взаимодействует 1,11 г водорода с 8,89 г кислорода, то образуется 10 г воды (H2O). Увеличение количества одного из веществ приводит к такому же результату. Не прореагируют атомы того элемента, которого взяли в избытке. Масса воды в этом опыте остается такой же – 10 г, состав ее молекул отражает формула H2O, то образуется 10 г воды (H2O). Увеличение количества одного из веществ приводит к такому же результату. Не прореагируют атомы того элемента, которого взяли в избытке. Масса воды в этом опыте остается такой же – 10 г, состав ее молекул отражает формула H2O.
Суть закона
В своей работе «Исследование меди» в 1799 г. Пруст показал, что природный карбонат меди и карбонат меди, полученный химиками в лаборатории, имеют один и тот же состав.
Ничем не различаются вода, текущая из нашего крана, вода из родника, или вода, полученная синтетическим путем (имеется в виду состав чистого вещества – воды, а не состав смеси). Вода всегда будет содержать по массе 11,1 % водорода и 88,9 % кислорода.