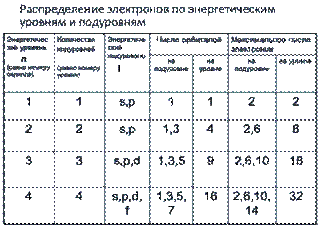
1. Электроны в атоме размещаются по энергетическим уровням. Максимальное число электронов N на уровне n определяется по формуле N =2 n 2.
2. Внутри каждого уровня выделяются подуровни. Их число равно номеру уровня, но не больше 4-х. Различают s-, p-, d-, f – подуровни.
3. На подуровнях располагаются орбитали. Число орбиталей на подуровне составлает 2l-1 (l- номер подуровня).
4. На одной орбитали может находиться не более одного 2 электронов.
s - подуровень – 1орбиталь
р – подуровень - 3 орбитали
d – подуровень - 5 орбиталей
f - подуровень – 7 орбиталей
- свободная орбиталь
- наполовину заполненные орбитали с неспаренным электроном
- заполненная орбиталь с двумя спаренными электронами, имеющими противоположные спины;
максимальное число электронов на подуровнях: s- 2, p- 6, d- 10, f –14.
Рис.1. Схема подразделения уровней на подуровни
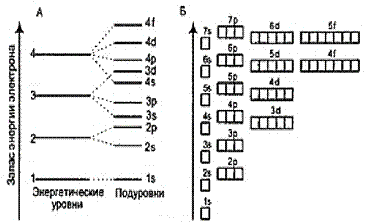
• Первым заполняется s-подуровень, затем р-, d- и f-подуровни.
• Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
• В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
• На одной орбитали не может быть больше двух электронов (принцип Паули).
Способы изображение электронной конфигурации:
1.Схема электронного строения – показывает распределение электронов по уровням.
2. Электронная формула - показывает распределение электронов по подуровням.
3. Электронно-графическая формула - показывает распределение электронов по орбиталям и спины электронов.

Составление схемы электронного строения атома.
| Действия
| Теоретические знания
| Пример
|
| С помощью ПС (периодической системы) установите и запишите:
1) заряд ядра элемента и общее число электронов в атоме;
| заряд ядра элемента и общее число электронов в атоме = порядковый номер элемента в ПС
|  Fe (26 e) Fe (26 e)
+26
|
| 2) число и обозначение уровней в электронной оболочке атома;
| число уровней = номер периода, в котором находиться элемент
| 1(К) 2(L) 3 (M) 4 (N)
+26))))
|
 3) число e на внешнем уровне 3) число e на внешнем уровне
| число электронов на внешнем уровне:
элементов А-групп (главных подгрупп) = номеру группы;
 элементов В-групп (побочных подгрупп): Pt - 0 e;
Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au -1е; элементов В-групп (побочных подгрупп): Pt - 0 e;
Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au -1е;
 остальных – 2е остальных – 2е
|
1(К) 2(L) 3(M) 4(N)
+26))))
2
|
| 4) максимальное число электронов на каждом уровне кроме внешнего и предвнешнего;
| максимальное число электронов на уровне = 2n2
(n – номер уровня)
|
1(К) 2(L) 3(M) 4(N)
+26))))
2 8 2
|
| 5) число электронов на предвнешнем уровне.
| число электронов на предвнешнем уровне = общее число электронов - число электронов на всех уровнях, кроме предвнешнего
|
1(К) 2(L) 3(M) 4(N)
+26))))
2 8 14 2
|
Самостоятельная работа.
1. Составьте схемы электронного строения атомов: Na, S, Br.
2. C помощью ПС определите химические элементы, если фрагменты их схем электронного строения:
а) +Х ))); б) +У )) в) +Z ))))
2 8 7 ? 2 ??? 3
2. Составление электронной формулы атома.
| Действия
| Теоретические знания
| Пример
|
| С помощью ПС:
1) составьте схему электронного строения атома;
| См. «1. Составление схемы электронного строения атома»;
| Fe (26e) 1(К) 2(L) 3(M) 4(N)
+26) ) ))
2 8 14 2
|
| 2) для всех уровней запиши обозначение составляющих их подуровней в порядке заполнения электронами
| порядок заполнения подуровней электронами (см. Рис1):
1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p
|
1s2s2p3s3p4s3d4p
|
| 3) поочередно для каждого уровня запишите распределение электронов по подуровням (над значком подуровня пишем число, которое обозначает количество электронов, которые находятся на этой орбитали).
| максимальное число электронов на подуровнях:
s- 2, p- 6, d- 10, f –14
Число электронов не может превышать максимального значения на подуровне
|
1s2 2s 22p 63s23p64s2 3d6 4p0
|

Самостоятельная работа 2.
1.Составьте электронные формулы атомов: Сa, Sе, Аr.






 Fe (26 e)
Fe (26 e)

 3) число e на внешнем уровне
3) число e на внешнем уровне
 элементов В-групп (побочных подгрупп): Pt - 0 e;
Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au -1е;
элементов В-групп (побочных подгрупп): Pt - 0 e;
Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au -1е;
 остальных – 2е
остальных – 2е




