М Э = М /2 = 31,77 г/моль.
Пропорция по закону Фарадея:
М Э С u = 31,77г/моль - F = 26,8 А. час
m Cu = 63,54 г - q = I . τ . η
τ = 63,54 . 26,8 / 31,77 . 20 = 2,7 час.
► Задача: Идет процесс выделения кислорода:
2Н2О - 4 e → О2 + 4Н+
Какое количество электричества q понадобится для получения 2,8 л О2, (н.у.)? Выход по току η= 70%.
Решение:
Объем 1 моль-экв. кислорода: V Э = 22,4/4 = 5,6 л/моль.
Пропорция по закону Фарадея:
V Э О2 = 5,6 л/моль - F = 26,8 А. час
V О2 = 2,8 л - q . η
q = 2,8 . 26,8 / 5,6 . 0,7 = 19,38 А. час.

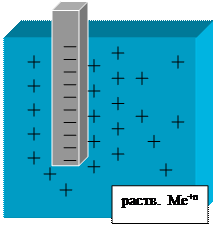
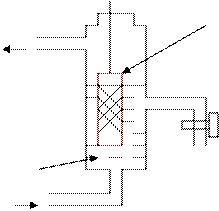
Металл Ме погружен в раствор
собственных ионов Меn+.
На границе раздела электрод - ионный проводник:
Ме: Ме n + × n е Û Ме n + + n е
 а) Ме + mН2О ® Меn+ × (Н2О)m+ ne
а) Ме + mН2О ® Меn+ × (Н2О)m+ ne
 Ме
Ме
раствор Ме
б) диффузия Ме n + в раствор;
в) образуется двойной
электрический слой
на Ме (-), в растворе (+);

г) на границе Ме – раствор
возникает
скачок потенциалов:
(Y 2 - Y 1) = Е Ме n + /Ме
- электродный потенциал;
Знак потенциала – заряд на Ме

д) устанавливается равновесие:
Ме + mН2О Û Меn+ × (Н2О)m + ne
J выхода Ме n+ = J адсорб Ме n+
- возникает ► равновесный.
. электродный.
. потенциал :
. Е р Ме n + /Ме , [В].

► активные Ме (Fe, Zn) Þ переход ионов в раствор
Þ (- Е р Ме n + /Ме):
Ме ® Ме n + + ne
► неактивные Ме (Cu, Ag) Þ адсорбция ионов из раствора Þ (+ Е р Ме n + /Ме):
Ме n + + ne ® Ме
► благородные Ме (Au, Pt) Þ разность потенциалов возникает за счет адсорбции молекул газа Þ газовые электроды, например:
 Н+р-р / Н2; Pt
Н+р-р / Н2; Pt
окисленная восстановленная
форма форма
Pt / Pt: адсорбция Н2
H2 на границе Ме - раствор:
потенциалопределяющая
реакция:
2Н+ + 2е Û Н2; Е р Н+/Н2
H+
H2
Условно считают при стандартном состоянии:
 р Н2 = 1 (10 5 Па) │
р Н2 = 1 (10 5 Па) │
► а Н+ = 1моль/л } (с.с.)
│
и Т = 298 К
► Абсолютное значение электродного потенциала определить нельзя. Þ измеряют относительные значения электродных потенциалов - относительно электрода сравнения, потенциал которого известен, например, Е 0 Н+/Н2 = 0 В.

О2, Pt / ОН-р-р
окисленная восстановленная
форма форма
На границе Ме-раствор:
Потенциалопределяющая реакция:
О2 + 2Н2О + 4е Û 4ОН-, Е р О2/ОН-;
при с.с. Е 0 О2/ОН- = + 0,401 В



Примеры: Е р Н+/Н2 Е р Pb +2/ Pb Е 0О2/ОН- Е 0 Cl 2/ Cl -

потенциалопределяющая реакция: Ox + ne Û Red

!
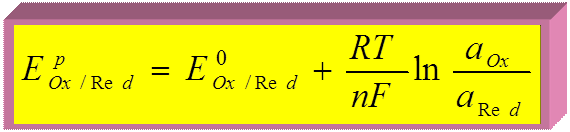
R – универсальная газовая постоянная, 8,31Дж/моль.К
n – число электронов, принимающих участие в реакции
F – число Фарадея, 96500 Кл/моль
T – температура, К.
Уравнения Нернста:
► для металлических электродов:
потенциалопределяющая реакция:
M е(р-р) n + + n 
 M е(к).
M е(к).
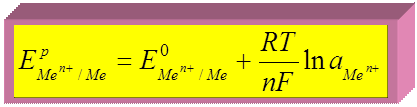
Для Т = 298 К и переходя к десятичному логарифму:
► для водородного электрода:
потенциалопределяющая реакция: 2Н+ + 2е 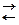 Н2
Н2
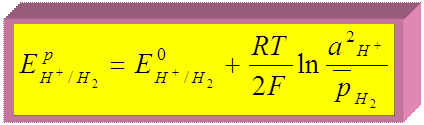
т.к.  ,
,  , при Т = 298 К Þ
, при Т = 298 К Þ
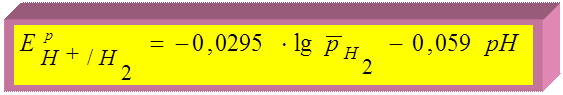
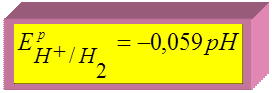 при
при  Þ
Þ
► для кислородного электрода:
потенциалопределяющая реакция:
О2 + 4 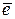 + 2Н2О
+ 2Н2О 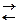 4ОН–
4ОН–
т.к. 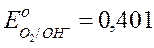 В ,
В , 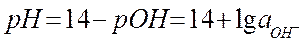
при Т = 298 К Þ
при 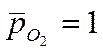
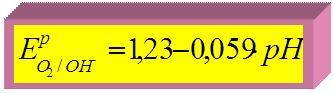
Þ
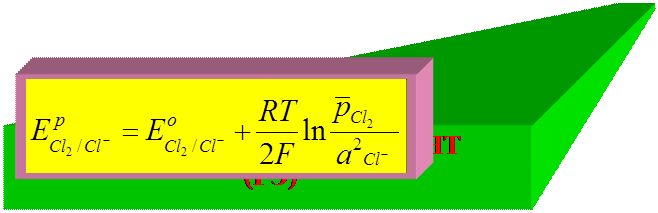
► для газового (хлорного) электрода:
потенциалопределяющая реакция:
Cl 2 + 2 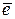
 2Cl –
2Cl –
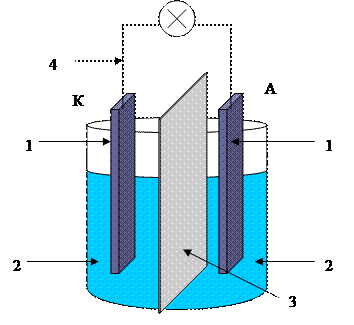
СХЕМА ГЭ
1 - электроды: катод К +, анод А -;
Растворы электролита;
Диафрагма, проницаемая для ионов;




 а) Ме + mН2О ® Меn+ × (Н2О)m+ ne
а) Ме + mН2О ® Меn+ × (Н2О)m+ ne
 Ме
Ме 



 Н+р-р / Н2; Pt
Н+р-р / Н2; Pt
 р Н2 = 1 (10 5 Па) │
р Н2 = 1 (10 5 Па) │





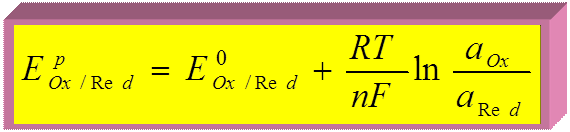

 M е(к).
M е(к).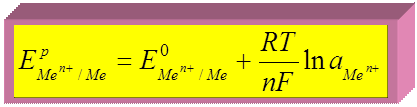
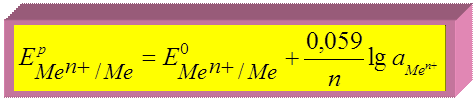
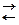 Н2
Н2
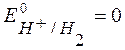 ,
,  , при Т = 298 К Þ
, при Т = 298 К Þ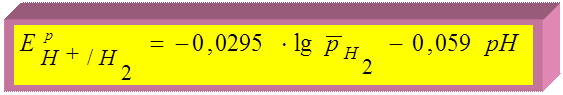
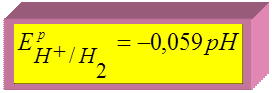 при
при 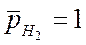 Þ
Þ + 2Н2О
+ 2Н2О  4ОН–
4ОН–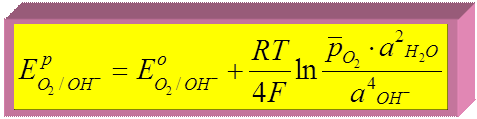
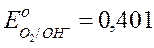 В ,
В , 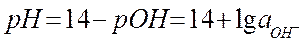

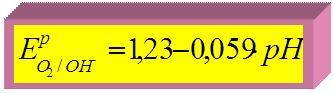
 2Cl –
2Cl –