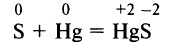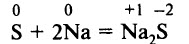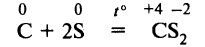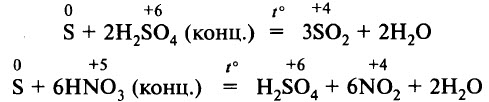Характеристика элемента серы
Сера S – элемент № 16, 3–й период, VIA группа (халькогены). Электронная конфигурация атома серы в стационарном состоянии 1s22s22p63s23p4:
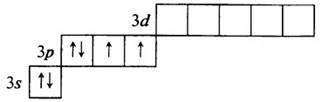
Электронная формула атома серы: 
Валентные возможности серы: II – в стационарном состоянии, IV (3s23p33d1) и VI (3s13p33d2) – в возбуждённом состоянии атома.
Наиболее характерными для серы являются следующие степени окисления:
0 – в простых веществах (ромбическая, пластическая сера);
–2 – в сероводороде Н2S и сульфидах (FeS, Na2S);
+4 – в оксиде серы (IV) SO2, сернистой кислоте Н2SO3 и её солях – сульфитах (K2SO3);
+6 – в оксиде серы (VI) S03, серной кислоте Н2SO4 и её солях – сульфатах (K2SO4).
Реже сера проявляет степени окисления:
–1 – в дисульфидах, например FeS2;
+1 – S2C12 – дихлорид дисеры или дихлорид серы (I);
+2 – SC12 – дихлорид серы или хлорид серы (II).
Высшим оксидом серы является оксид серы (VI) SO3 (серный ангидрид), его характер – кислотный. Высшим гидроксидом серы является серная кислота Н2SO4 – сильный электролит, нелетучая, стабильная двухосновная кислота. Водородным соединением серы является сероводород Н2S (газ при обычных условиях), его водный раствор – сероводородная кислота, двухосновная, слабый электролит.
Сера – простое вещество
Наиболее прочны молекулы серы S8, имеющие форму короны.
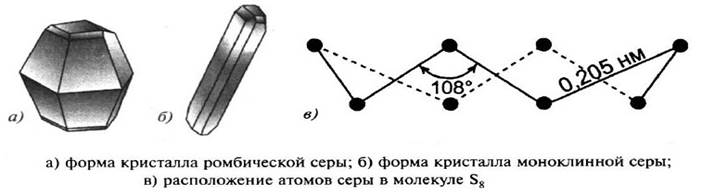
Сера образует несколько аллотропных модификаций: ромбическая сера и моноклинная сера. Кристаллическая решётка в обоих случаях молекулярная, в узлах решётки – молекулы S8.
При выливании расплава серы в холодную воду образуется пластичная масса – пластическая сера, не имеющая кристаллического строения. Её макромолекулы образованы линейными цепями Sn. При хранении пластическая сера становится хрупкой, изменяет окраску и переходит в ромбическую модификацию.
Если медленно нагреть ромбические кристаллы выше 96 °С, то они превращаются в моноклинную модификацию. В обеих модификациях молекулы серы находятся в форме восьмичленных колец, но упакованы они по–разному. Переход ромбической серы в моноклинную при 96 °С является обратимым. При нагревании до 112 °С сера плавится, а составляющие кристаллическую решётку восьмичленные кольца разрываются, образуя молекулы с открытой цепью.
При обычных условиях сера – твёрдое кристаллическое вещество; кристаллы жёлтого цвета, хрупкие, лёгкие (р ≈ 2 г/см3), легкоплавкие (t0пл ≈ 113°С для ромбической серы).
Для серы характерна окислительно-восстановительная двойственность: по отношению к металлам и водороду сера выступает в роли окислителя.
С водородом сера взаимодействует при нагревании с образованием сероводорода: 
При обычных условиях сера взаимодействует со ртутью: 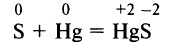
При нагревании сера взаимодействует со многими металлами: 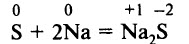
По отношению к неметаллам сера выступает в роли восстановителя. При нагревании сера сгорает в кислороде: 
Сера взаимодействует со всеми галогенами. Фтор окисляет серу до высшей степени окисления.
При температуре примерно 700–800 °С уголь взаимодействует с серой, образуется сероуглерод: 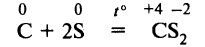
Сера реагирует с концентрированной серной и азотной кислотами: 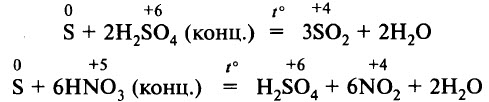
Сера используется для производства серной кислоты, в реакции вулканизации каучука, для производства инсектицидов, в косметической промышленности.

Применение серы
Физические свойства
Оптические свойства
Применение серы

Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат.
Чистая сера:
· Необходима для того, чтобы превратить каучук в резину. Этот процесс называют вулканизацией каучука. Резиновая промышленность потребляет до 10% общего объема получаемой серы.
· Входит в состав лекарственных средств против паразитов и заболеваний кожи (чесотка, псориаз и др), средств для ванн против ревматизма и подагры, некоторых лекарств, принимаемых внутрь.
· Применяется в химической промышленности: почти 50% всей производимой в мире серы идет для получения серной кислоты, еще четверть — для получения сульфитов; до 15% используется в производстве инсектицидов для борьбы с вредителями винограда, хлопчатника и некоторых других культур.
Сера требуется для:
· изготовления красок и ультрамарина для лако-красочной промышленности, полимеров и синтетических волокон, диоксида серы, сероуглерода, сульфатов, люминофоров, эбонита, удобрений;
· изготовления многих пиротехнических и взрывчатых смесей, в том числе пороха и состава для спичечных головок;
· изготовления бумаги;
· создания некоторых сталей с особыми свойствами;
· дезинфекции овощехранилищ, птичников, подвалов в сельском хозяйстве;
· виноделия, при хранении овощей и фруктов.
Серосодержащие руды часто являются сырьем для получения цветных металлов.
Серная кислота применяется:
· в электротехнической промышленности для производства аккумуляторов;
· для очистки нефтепродуктов;
· для очистки проволоки и металлического листа от окалины, для травления металлических поверхностей;
· в изготовлении лекарственных средств и красителей;
· в химической промышленности в качестве сырья для производства широкого спектра химических веществ, для осушения газов, для повышения концентрации азотной кислоты.
Оксид серы используется для:
· получения серной и азотной кислоты, олеума, сульфитов, тиосульфатов;
· дезинфекции помещений в сельском хозяйстве, в виноделии, в консервировании плодово-ягодной продукции;
· отбеливания тканей (шерсти, шелка).
Сероводород находит применение в производстве чистой серы и серной кислоты, сульфитов и тиосульфатов.
Сера (англ. Sulphur) — S
| Молекулярный вес
| 32.06 г/моль
|
| Происхождение названия
| Латинское sulfur (происходящее из эллинизированного написания этимологического sulpur), предположительно, восходит к индоевропейскому корню *swelp — «гореть»
|
| IMA статус
| действителен, описан впервые до 1959 (до IMA)
|
Физические свойства

| Цвет минерала
| жёлтый, серно-жёлтый, коричневато- или зеленовато-жёлтый, оранжевый, белый
|
| Цвет черты
| бесцветный
|
| Прозрачность
| прозрачный, полупрозрачный
|
| Блеск
| смоляной, жирный
|
| Спайность
| несовершенная по {001}, {110} и {111}
|
| Твердость (шкала Мооса)
| 1.5 — 2.5
|
| Излом
| неровный, раковистый
|
| Прочность
| очень хрупкая
|
| Отдельность
| отдельность по {111}
|
| Плотность (измеренная)
| 2.07 г/см3
|
| Радиоактивность (GRapi)
| 0
|
Оптические свойства

| Тип
| двухосный (+)
|
| Показатели преломления
| nα = 1.958 nβ = 2.038 nγ = 2.245
|
| Максимальное двулучепреломление
| δ = 0.287
|
| Оптический рельеф
| очень высокий
|
| Плеохроизм
| видимый
|
| Рассеивание
| относительно слабое r<v
|
| Люминесценция в ультрафиолетовом излучении
| не флюоресцентный
|
Характеристика элемента серы
Сера S – элемент № 16, 3–й период, VIA группа (халькогены). Электронная конфигурация атома серы в стационарном состоянии 1s22s22p63s23p4:

Электронная формула атома серы: 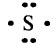
Валентные возможности серы: II – в стационарном состоянии, IV (3s23p33d1) и VI (3s13p33d2) – в возбуждённом состоянии атома.
Наиболее характерными для серы являются следующие степени окисления:
0 – в простых веществах (ромбическая, пластическая сера);
–2 – в сероводороде Н2S и сульфидах (FeS, Na2S);
+4 – в оксиде серы (IV) SO2, сернистой кислоте Н2SO3 и её солях – сульфитах (K2SO3);
+6 – в оксиде серы (VI) S03, серной кислоте Н2SO4 и её солях – сульфатах (K2SO4).
Реже сера проявляет степени окисления:
–1 – в дисульфидах, например FeS2;
+1 – S2C12 – дихлорид дисеры или дихлорид серы (I);
+2 – SC12 – дихлорид серы или хлорид серы (II).
Высшим оксидом серы является оксид серы (VI) SO3 (серный ангидрид), его характер – кислотный. Высшим гидроксидом серы является серная кислота Н2SO4 – сильный электролит, нелетучая, стабильная двухосновная кислота. Водородным соединением серы является сероводород Н2S (газ при обычных условиях), его водный раствор – сероводородная кислота, двухосновная, слабый электролит.
Сера – простое вещество
Наиболее прочны молекулы серы S8, имеющие форму короны.

Сера образует несколько аллотропных модификаций: ромбическая сера и моноклинная сера. Кристаллическая решётка в обоих случаях молекулярная, в узлах решётки – молекулы S8.
При выливании расплава серы в холодную воду образуется пластичная масса – пластическая сера, не имеющая кристаллического строения. Её макромолекулы образованы линейными цепями Sn. При хранении пластическая сера становится хрупкой, изменяет окраску и переходит в ромбическую модификацию.
Если медленно нагреть ромбические кристаллы выше 96 °С, то они превращаются в моноклинную модификацию. В обеих модификациях молекулы серы находятся в форме восьмичленных колец, но упакованы они по–разному. Переход ромбической серы в моноклинную при 96 °С является обратимым. При нагревании до 112 °С сера плавится, а составляющие кристаллическую решётку восьмичленные кольца разрываются, образуя молекулы с открытой цепью.
При обычных условиях сера – твёрдое кристаллическое вещество; кристаллы жёлтого цвета, хрупкие, лёгкие (р ≈ 2 г/см3), легкоплавкие (t0пл ≈ 113°С для ромбической серы).
Для серы характерна окислительно-восстановительная двойственность: по отношению к металлам и водороду сера выступает в роли окислителя.
С водородом сера взаимодействует при нагревании с образованием сероводорода: 
При обычных условиях сера взаимодействует со ртутью: 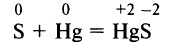
При нагревании сера взаимодействует со многими металлами: 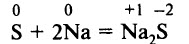
По отношению к неметаллам сера выступает в роли восстановителя. При нагревании сера сгорает в кислороде: 
Сера взаимодействует со всеми галогенами. Фтор окисляет серу до высшей степени окисления.
При температуре примерно 700–800 °С уголь взаимодействует с серой, образуется сероуглерод: 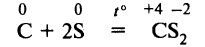
Сера реагирует с концентрированной серной и азотной кислотами: 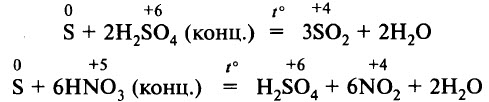
Сера используется для производства серной кислоты, в реакции вулканизации каучука, для производства инсектицидов, в косметической промышленности.

Применение серы
Физические свойства
Оптические свойства