Принято считать, что процессом, непосредственно связанным с работающим механизмом поперечно-полосатого мышечного волокна, является распад АТФ с образованием АДФ и неорганического фосфата. Возникает вопрос: каким образом мышечная клетка может обеспечить свой сократительный аппарат достаточным количеством энергии в форме АТФ, т.е. каким образом в процессе мышечной деятельности происходит непрерывный ресинтез этого соединения? Прежде всего ресинтез АТФ обеспечивается трансфосфорилированием АДФ с креатинфосфатом. Данная реакция катализируетсяферментом креатинкиназой:

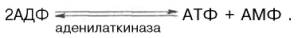
Креатинкиназный путь ресинтеза АТФ является чрезвычайно быстрым и максимально эффективным (за счет каждой молекулыкреатинфосфата образуется молекула АТФ). Именно поэтому долгое время не удавалось установить уменьшение концентрации АТФ и соответственно повышение концентрации АДФ даже при достаточно продолжительном тетанусе. Применив специфический ингибиторкреатинкиназы (1-фтор-2,4-динитро-фенол), а также с помощью агентов, препятствующих окислительному фосфорилированию АДФ вАТФ, Т. Кейн и соавт. (1962) смогли продемонстрировать прямой распад АТФ с одновременным приростом неорганического фосфата иАДФ при одиночном сокращении изолированной мышцы лягушки. Некоторое количество АТФ может ресинтезироваться в ходе аденилаткиназной (миокиназной) реакции:
Запасы креатинфосфата в мышце невелики, а доступность энергии креатинфосфата имеет ценность для работающей мышцы только в том случае, если расход его постоянно возмещается синтезом АТФ в процессе метаболизма. Для любой ткани, в том числе мышечной, известны два фундаментальных биохимических процесса, в ходе которых регенерируются богатые энергией фосфорные соединения. Один из этих процессов – гликолиз, другой – окислительное фосфорилирование. Наиболее важным и эффективным из них является последний. При достаточном снабжении кислородом мышца, несмотря на анаэробный механизм сокращения, в конечном итоге работает за счет энергии, образующейся при окислении (в цикле Кребса) как продуктов распада углеводов, так и ряда других субстратовтканевого дыхания, в частности жирных кислот, а также ацетата и ацетоацетата. В последнее время появились данные, доказывающие, что креатинфос-фат в мышечной ткани (в частности, в сердечной мышце) способен выполнять не только роль как бы депо легкомобилизуемых макроэргических фосфатных групп, но также роль транспортной формы макроэргических фосфатных связей, образующихся в процессе тканевого дыхания и связанного с ним окислительного фосфорилирования. Предложена схема переноса энергии из митохондрий в цитоплазму клетки миокарда. АТФ, синтезированный в матриксе митохондрий, переносится через внутреннюю мембрану с участием специфической АТФ–АДФ-транслоказы на активный центр митохондриального изофермента креатинкиназы, который расположен на внешней стороне внутреннеймембраны; в межмембранном пространстве (в присутствии ионов Mg2+) при наличии в среде креатина образуется равновесный тройной фермент-субстратный комплекс креатин–креатинкиназа–АТФ–Mg2+, который затем распадается с образованиемкреатинфосфата и АДФ–Mg2+. Креатинфосфат диффундирует в цитоплазму, где используется в миофибриллярной креатинкиназнойреакции для рефосфорилирования АДФ, образовавшегося при сокращении. Высказываются предположения, что не только в сердечной мышце, но и в скелетной мускулатуре имеется подобный путь транспорта энергии из митохондрий в миофибриллы. При работе умеренной интенсивности мышца может покрывать свои энергетические затраты за счет аэробного метаболизма. Однако при больших нагрузках, когда возможность снабжения кислородом отстает от потребности в нем, мышца вынуждена использовать гликолитический путь снабжения энергией. При интенсивной мышечной работе скорость расщепления гликогена или глюкозы с образованием молочной кислоты увеличивается в сотни раз. Соответственно содержание молочной кислоты в мышечной ткани может повышаться до 1,0–1,2 г/кг и более. С током крови значительное количество молочной кислоты поступает в печень, где ресинтезируется в глюкозу и гликоген (глюконеогенез) за счет энергии окислительных процессов. Перечисленные механизмы ресин-тезаАТФ при мышечной деятельности включаются в строго определенной последовательности. Наиболее экстренным является креатинкиназный механизм, и лишь примерно через 20 с максимально интенсивной работы начинается усиление гликолиза, интенсивность которого достигает максимума через 40–80 с. При более длительной, а следовательно, и менее интенсивной работе все большее значение приобретает аэробный путь ресинтеза АТФ. Содержание АТФ и креатинфосфата в сердечной мышце ниже, чем в скелетной мускулатуре, а расход АТФ велик. В связи с этим ресинтез АТФ в миокарде должен происходить намного интенсивнее, чем в скелетной мускулатуре. Для сердечной мышцы теплокровных животных и человека основным путем образования богатых энергией фосфорных соединений является путь окислительного фосфорилирования, связанный с поглощением кислорода. Регенерация АТФ в процессе анаэробного расщепленияуглеводов (гликолиз) в сердце человека практического значения не имеет. Именно поэтому сердечная мышца очень чувствительна к недостатку кислорода. Характерной особенностью обмена веществ в сердечной мышце по сравнению со скелетной является также то, что аэробное окисление веществ неуглеводной природы при работе сердечной мышцы имеет большее значение, чем при сокращении скелетной мышцы. Только 30–35% кислорода, поглощаемого сердцем в норме, расходуется на окисление углеводов и продуктов их превращения. Главным субстратом дыхания в сердечной мышце являются жирные кислоты. Окисление неуглеводных веществобеспечивает около 65–70% потребности миокарда в энергии. Из свободных жирных кислот в сердечной мышце особенно легко подвергается окислению олеиновая кислота.
164. Биохимические изменения при мышечных дистрофиях и денервации мышц. Креатинурия.
Общими для большинства заболеваний мышц (прогрессирующие мышечные дистрофии, атрофия мышц в результате их денервации, тенотомия, полимиозит, некоторые авитаминозы и т.д.) являются резкое снижение в мышцах содержания миофибриллярных белков, возрастание концентрации белков стромы и некоторых саркоплазматических белков, в том числе миоальбумина. Наряду с изменениями фракционного состава мышечных белков при поражениях мышц наблюдается снижение уровня АТФ и креатинфосфата. Например, через 12 дней после денервации содержание АТФ в денервированной икроножной мышце кролика снижается более чем в 2 раза. Отмечаются также снижение АТФазной активности контрактиль-ных белков (миозина), уменьшение количества имидазолсодержащих дипептидов. При прогрессирующих мышечных дистрофиях и других заболеваниях, связанных с распадом мышечной ткани, часто отмечаются сдвиги в фосфолипидном составе мышц: значительно снижается уровень фосфатидилхолина и фосфатидилэтаноламина, концентрациясфингомиелина и лизо-фосфатидилхолина повышается. До сих пор истинные механизмы изменения фосфолипидного составамышечной ткани при патологии не выяснены, неизвестна также роль этих сдвигов в патогенезе мышечных дистрофий. Для многих форм патологии мышечной ткани характерны нарушение метаболизма креатина и его усиленное выделение с мочой (креатинурия). Несмотря на многочисленные исследования и обилие фактического материала, вопрос о причинах креатинурии при заболеваниях мышц не может считаться окончательно решенным. Принято считать, что креатинурия у больных миопатией является результатом нарушения в скелетной мускулатуре процессов фиксации (удержания) креатина и его фосфорилирования. Если нарушен процесс синтеза креатинфосфата, то не образуется и креатинина; содержание последнего в моче резко снижается. В результате креатинурии и нарушения синтеза креатинина резко повышается креатиновый показатель (креатин/креатинин) мочи. При патологии мышечной ткани можно наблюдать определенную закономерность в изменении активности ферментов в мышцах: уменьшается активность ферментов, локализованных в саркоплазме; незначительно изменяется активность ферментов, связанных смитохондриями; заметно возрастает активность лизосомальных ферментов. Наконец, показано, что при многих заболеваниях мышечной системы наступают сдвиги в системе цАМФ: снижается содержание цАМФ в мышечной ткани, повышается активностьфосфодиэстеразы и нарушается способность аденилатциклазы активироваться под влиянием адреналина и фторида натрия.
165. Химический состав нервной ткани. Миелиновые мембраны: особенности состава и структуры.
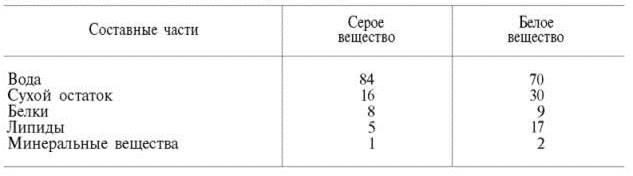
На долю белков приходится примерно 40% от сухой массы головного мозга. Мозговая ткань является трудным объектом для изучения белкового состава вследствие большого содержания липидов и наличия белково-ли-пидных комплексов. А.Я. Данилевский впервые разделил белки мозговой ткани на растворимые в воде и солевых растворах белки и нерастворимые белки. Обширные исследования в этой области были проведены также А.В. Палладиным и сотр., которые разделили белки нервной ткани на 4 фракции: извлекаемые водой, 4,5% раствором КСl, 0,1% раствором NaOH и нерастворимый остаток. Установлено, что серое веществобогаче белками, растворимыми в воде, чем белое вещество,– соответственно 30 и 19%. Белое вещество, напротив, содержит гораздо больше (22%) нерастворимого белкового остатка, чем серое вещество (5%). В дальнейшем было выделено 5–10 фракций растворимых белков мозга, различающихся по своей электрофоретической подвижности. В настоящее время, сочетая методы экстракции буферными растворами, хроматографии на колонках с ДЭАЭ-целлюлозой и диск-электрофореза в полиакриламидном геле, удалось выделить из ткани мозга около 100 различных растворимых белковых фракций. В нервной ткани содержатся как простые, так и сложные белки. Простые белки – это альбумины (нейроальбумины), глобулины(нейроглобулины), катионные белки (гистоны и др.) и опорные белки (нейросклеропротеины). Альбумины и глобулины по своим физико-химическим свойствам несколько отличаются от аналогичных белков сыворотки крови, поэтому их называют нейроальбуминами и нейроглобулинами. Количество нейрогло-булинов в головном мозге относительно велико – в среднем 5% по отношению ко всем растворимым белкам. Нейроальбумины являются основным белковым компонентомфосфопротеинов нервной ткани, на их долю приходится основная масса растворимых белков (89–90%). В свободном состоянии нейроальбумины встречаются редко. В частности, они легко соединяются с липидами, нуклеиновыми кислотами, углеводами и другими небелковыми компонентами. Белки, которые в процессе электрофоретического разделения при рН 10,5–12,0 движутся к катоду, получили название катионных. Главнейшими представителями этой группы белков в нервной ткани являются гистоны, которые делятся на пять основных фракций в зависимости от содержания в их полипептидных цепях остатков лизина, аргинина и глицина.
Нейросклеропротеины можно охарактеризовать как структурно-опорные белки. Основные представители этих белков – нейроколлагены, нейроэлас-тины, нейростромины и др. Они составляют примерно 8–10% от общего количества простых белковнервной ткани и локализованы в основном в белом веществе головного мозга и в периферической нервной системе.
Сложные белки нервной ткани представлены нуклеопротеинами, липопротеинами, протеолипидами, фосфопротеинами,гликопротеинами и т.д. В мозговой ткани содержатся в значительном количестве еще более сложные надмолекулярные образования, такие, как липонуклеопротеины, липогликопротеины и, возможно, липогликонуклеопротеиновые комплексы.
Нуклеопротеины – белки, которые принадлежат либо к дезоксирибонук-леопротеинам, либо к рибонуклеопротеинам. Часть этих белковиз мозговой ткани извлекается водой, другая часть – солевыми средами, а третья – 0,1 М раствором щелочи.
Липопротеины составляют значительную часть водорастворимых белков мозговой ткани. Их липидный компонент – это в основномфосфоглицериды и холестерин.
Протеолипиды – это белково-липидные соединения, экстрагируемые органическими растворителями из ткани мозга. Отличаются от водорастворимых липопротеинов тем, что они нерастворимы в воде, но растворимы в смеси хлороформ–метанол. Белки, освобожденные от липидов, растворимы в воде, а также (благодаря высокому содержанию гидрофобных аминокислот) в смеси хлороформ–метанол. Наибольшее количество про-теолипидов сосредоточено в миелине, в небольших количествах они входят в состав синаптических мембран и синаптических пузырьков.
Фосфопротеины в головном мозге содержатся в большем количестве, чем в других органах и тканях,– около 2% от общего количества всех сложных белков мозга. Фосфопротеины обнаружены в мембранах различных морфологических структур нервной ткани.
Гликопротеины представляют собой чрезвычайно гетерогенную группу белков. По количеству белка и углеводов, входящих в состав гликопро-теинов, их можно разделить на две основные группы. Первая группа – это гликопротеины, содержащие от 5 до 40% углеводови их производных; белковая часть состоит преимущественно из альбуминов и глобулинов. В гликопротеинах, составляющих вторую группу, содержится 40–85% углеводов, часто обнаруживается липидный компонент; по своему составу они могут быть отнесены к гликолипопротеинам.
В нервной ткани обнаружен ряд специфических белков, в частности белок S-100 и белок 14-3-2. Белок S-100, или белок Мура, называют также кислым белком, так как он содержит большое количество остатков глутаминовой и аспарагиновой кислот. Этот белоксосредоточен в основном в нейроглии (85-90%), в нейронах его не более 10-15% от общего количества белка в головном мозге. Установлено, что концентрация белка S-100 возрастает при обучении (тренировках) животных. Пока нет оснований считать, что белокS-100 непосредственно участвует в формировании и хранении памяти. Не исключено, что его участие в этих процессах опосредованно.Белок 14-3-2 также относится к кислым белкам. В отличие от белка S-100 он локализован в основном в нейронах; в нейроглиальныхклетках его содержание невелико. Пока неясна роль белка 14-3-2 в выполнении специфических функций нервной ткани.
Ферменты. В мозговой ткани содержится большое количество ферментов, катализирующих обмен углеводов, липидов и белков. До сихпор в кристаллическом виде из ЦНС млекопитающих выделены лишь некоторые ферменты, в частности ацетилхолинэстераза и креатинкиназа.
Значительное количество ферментов в мозговой ткани находится в нескольких молекулярных формах (изоферменты): ЛДГ, альдолаза, креатинкиназа, гексокиназа, малатдегидрогеназа, глутаматдегидрогеназа, холинэстераза, кислая фосфатаза, моноаминоксидаза и др.
Среди химических компонентов головного мозга особое место занимают липиды, высокое содержание и специфическая природа которых придают мозговой ткани характерные особенности. В группу липидов головного мозга входят фосфоглицериды, холестерин,сфингомиелины, цереброзиды, ганглиозиды и очень небольшое количество нейтрального жира. Многие липиды нервной ткани находятся в тесной взаимосвязи с белками, образуя сложные системы типа протеолипидов.
В сером веществе головного мозга фосфоглицериды составляют более 60% от всех липидов, а в белом веществе – около 40%. Напротив, в белом веществе содержание холестерина, сфингомиелинов и особенно церебрози-дов больше, чем в сером веществе.
В мозговой ткани имеются гликоген и глюкоза, но по сравнению с другими тканями ткань мозга бедна углеводами. Общее содержаниеглюкозы в головном мозге разных животных составляет в среднем 1–4 мкмоль на 1 г ткани, а гликогена – 2,5–4,5 мкмоль на 1 г ткани. Интересно отметить, что общее содержание гликогена в мозге эмбрионов и новорожденных животных значительно выше, чем в мозге взрослых. Например, у новорожденных мышей в отличие от взрослых особей уровень гликогена в 3 раза выше. По мере роста и дифференцировки мозга концентрация гликогена быстро снижается и остается относительно постоянной у взрослого животного.
В мозговой ткани имеются также промежуточные продукты обмена углеводов: гексозо- и триозофосфаты, молочная, пировиноградная и другие кислоты.
В мозговой ткани на долю адениновых нуклеотидов приходится около 84% от всех свободных нуклеотидов. Большую часть оставшихсянуклеотидов составляют производные гуанина. В целом количество высокоэргических соединений в нервной ткани невелико. Содержание нуклеотидов и креатин-фосфата в головном мозге крыс составляет в среднем (в мкмоль на 1 г сырой массы): АТФ – 2,30–2,90; АДФ – 0,30–0,50; АМФ – 0,03–0,05; ГТФ – 0,20–0,30; ГДФ – 0,15–0,20; УТФ – 0,17–0,25; креатинфосфат – 3, 5 0 – 4,75. Распределение основных макроэргических соединений примерно одинаково во всех отделах мозга. Содержание циклических нуклеотидов (цАМФ и цГМФ) в головном мозге значительно выше, чем во многих других тканях. Уровень цАМФв мозге в среднем 1–2, а цГМФ – до 0,2 нмоль на 1 г ткани. Для мозга характерна также высокая активность ферментов метаболизмациклических нуклеотидов. Большинство исследователей считают, что циклические нуклеотиды участвуют в синаптической передаче нервного импульса.
Ионы Na+, K+, Cu2+, Fe3+, Ca2+, Mg2+и Мn2+ распределены в головном мозге относительно равномерно в сером и белом веществе. Содержание фосфатов в белом веществе выше, чем в сером. Количественное соотношение неорганических анионов и катионов в мозговой ткани свидетельствует о дефиците анионов. Расчет показывает, что для покрытия дефицита анионов потребовалось бы в 2 раза больше белков, чем их имеется в мозговой ткани. Принято считать, что остающийся дефицит анионов покрывается за счет липидов. Вполне возможно, что участие липидов в ионном балансе – одна из функций головного мозга.
Миелиновое вещество – понятие морфологическое. По сути миелин – это система, образованная многократно наслаивающимисямембранами клеток нейроглии вокруг нервных отростков (в периферических нервных стволах нейроглия представлена леммоцитами, или шванновскими клетками, а в белом веществе ЦНС – астроцитами).
По химическому составу миелиновое вещество является сложным белково-липидным комплексом.
На долю липидов приходится до 80% плотного осадка; 90% всех липидов миелина представлено холестерином, фосфолипидами и церебро-зидами. Считают, что в липоидных слоях миелиновых оболочек молекулы различных липидов имеют строго определенное расположение.









