

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Производные карбоновых кислот, как и сами кислоты, способны вступать в реакции нуклеофильного замещения у sp2--гибридизован- ного атома углерода с образованием других функциональных производных. Механизм такого замещения отличается от рассмотренного выше механизма нуклеофильного замещения у sp3--гибридизованного атома углерода в галогеноалканах и спиртах (см. 4.3).
Тетраэдрический механизм нуклеофильного замещения. Сначала нуклеофил присоединяется к атому углерода группы С=О с образованием нестабильного промежуточного аниона (интермедиата). Механизм реакции называют тетраэдрическим, так как атом углерода при этом переходит из sp2- в sр3-гибридное состояние и принимает тетраэдрическую конфигурацию.

На второй стадии от интермедиата отщепляется частица Z и атом углерода вновь становится sp2-гибридизованным. Таким образом, эта реакция замещения включает стадии присоединения и отщепления.
По такому механизму реакция протекает при наличии достаточно сильного нуклеофила и хорошей уходящей группы Z, напри- мер, в случае щелочного гидролиза сложных эфиров и других функциональных производных карбоновых кислот. Легкость нуклеофильной атаки зависит от величины частичного положительного заряда δ+ на атоме углерода карбонильной группы. В функциональных производных карбоновых кислот он увеличивается с ростом -I-эффекта заместителя Z и уменьшается с увеличением его M-эффекта. В результате этих эффектов величина заряда и, следовательно, способность подвергаться нуклеофильной атаке в рассматриваемых соединениях уменьшаются в приведенной ниже последовательности. К этому же выводу приводит и анализ стабильности уходящих групп Z-, которые выделены цветом (см. 4.2.1).
|
|
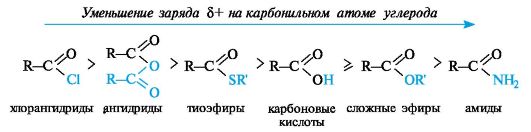
Производные карбоновых кислот по сравнению с альдегидами и кетонами труднее подвергаются нуклеофильной атаке, так как электрофильность карбонильного атома углерода обычно снижается
за счет +M-эффекта заместителя Z. По этой причине в нуклеофильных реакциях функциональных производных карбоновых кислот часто оказывается необходимым кислотный катализ путем протонирования атома кислорода карбонильной группы. Примером такой активации служит уже рассмотренная реакция этерификации (см. 6.1.3).
В результате взаимодействия карбоновых кислот и их функциональных производных со спиртами или аминами в молекулы этих соединений вводится ацильный остаток. По отношению к таким реакциям используют общее название - реакции ацилирования. С этой позиции реакцию этерификации можно рассматривать как ацилирование молекулы спирта.
Функциональные производные кислот обладают разной реакционной способностью в реакциях ацилирования. Наиболее активны хлорангидриды и ангидриды; из них можно получать практически любые производные кислот. Сами кислоты и сложные эфиры (с остатками алифатических спиртов) - значительно менее активные ацилирующие агенты. Реакции замещения с их участием проводятся в присутствии катализаторов. Амиды вступают в реакции ацилирования еще труднее, чем кислоты и сложные эфиры.
Соли карбоновых кислот ацилирующей способностью не обладают, поскольку анион карбоновой кислоты не может быть атакован отрицательно заряженным нуклеофилом или молекулой с неподеленной парой электронов.
Сложные эфиры
Сложные эфиры - широко распространенные в природе производные кислот. Многие лекарственные средства содержат в своей структуре сложноэфирные группировки.
Помимо реакции этерификации, сложные эфиры образуются, причем значительно легче, при ацилировании спиртов или фенолов ангидридами кислот.
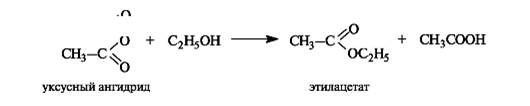
Некоторые реакции сложных эфиров приведены на схеме 6.3.
|
|
Схема 6.3. Реакции сложных эфиров
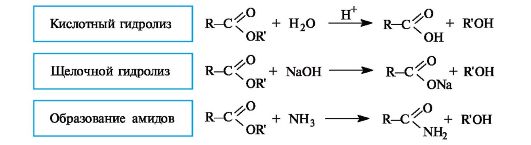
Сложные эфиры способны гидролизоваться и в кислой, и в щелочной среде. Как уже упоминалось (см. 6.1.3), кислотный гидро- лиз сложных эфиров - реакция, обратная реакции этерификации. Несмотря на обратимость этой реакции, кислотный гидролиз легко сделать необратимым при использовании большого избытка воды.
При щелочном гидролизе сложных эфиров щелочь выступает как реагент (на 1 моль сложного эфира расходуется 1 моль щелочи).
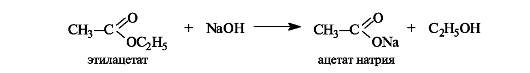
Щелочной гидролиз эфиров - необратимая реакция, поскольку образующийся карбоксилат-ион не способен взаимодействовать с алкоксид-ионом (частицы с одноименными зарядами). Такой гидролиз называют также омылением сложных эфиров. Этот термин связан с тем, что соли высших кислот, образующиеся при щелочном гидролизе жиров, называются мылами.
Тиоэфиры
Тиоэфиры - серные аналоги сложных эфиров - находят весьма ограниченное применение в классической органической химии, но играют важную роль в организме. Известно, что для проявления каталитической активности большинству ферментов, имеющих белковую природу, необходимо соучастие коферментов, которыми служат разнообразные по строению низкомолекулярные органические соединения небелковой природы. Одну из групп коферментов составляют
ацилкоферменты, выполняющие функцию переносчиков ацильных групп. Из них наиболее распространен ацетилкофермент А.
При всей сложности строения молекулы ацетилкофермента А с позиций химического подхода можно определить, что этот кофермент функционирует как тиоэфир.
В качестве тиола, участвующего в его образовании, выступает кофермент А (сокращенно обозначаемый CoASH), молекула которого построена из остатков трех компонентов - 2-аминоэтантиола, пантотеновой кислоты и аденозиндифосфата (дополнительно фосфорилированного по положению 3 в рибозном фрагменте). Аденозиндифосфат (АДФ) рассмотрен в дальнейшем как представитель другой важной группы коферментов - нуклеозидполифосфатов (см. 14.3.1). Пантотеновая кислота образует, с одной стороны, амидную связь с 2-аминоэтанти- олом, а с другой - сложноэфирную связь с остатком АДФ.
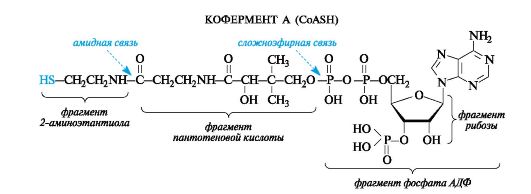
По ацилирующей способности все ацилкоферменты А и в том числе ацетилкофермент А, будучи тиоэфирами, занимают «золотую сере- дину» между высокореакционными ангидридами и малоактивными карбоновыми кислотами и сложными эфирами. Их достаточно высокая активность обусловлена, в частности, повышенной стабильностью уходящей группы - аниона CoA-S- - по сравнению с гидроксид- и алкоксид-ионами кислот и сложных эфиров соответственно.
|
|
Ацетилкофермент А in vivo является переносчиком ацетильных групп на нуклеофильные субстраты.

Этим путем, например, осуществляется ацетилирование гидроксилсодержащих соединений.
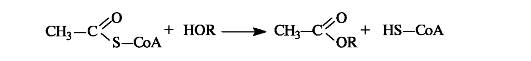
С использованием ацетилкофермента А протекает превращение холина в ацетилхолин, являющегося посредником при передаче нервного возбуждения в нервных тканях (нейромедиатором) (см. 9.2 1).

Кроме этого, можно отметить важное участие в процессах обмена веществ самого кофермента А, функционирующего в качестве тиола. В организме любые карбоновые кислоты активируются путем превращения в реакционноспособные производные - тиоэфиры.
Амиды и гидразиды
Наряду со сложными эфирами важной группой производных кислот являются амиды карбоновых кислот, также широко распростра- ненные в природе. Достаточно упомянуть пептиды и белки, в структуре которых содержатся многочисленные амидные группировки.
В зависимости от степени замещения у атома азота амиды могут быть монозамещенными и дизамещенными (см. 6.2.1).
Амиды образуются при ацилировании аммиака и аминов ангидридами или сложными эфирами.
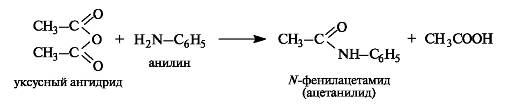

Амиды обладают самой низкой ацилирующей способностью и гидролизуются намного труднее, чем другие производные кислот. Гидролиз амидов проводится в присутствии кислот или оснований.
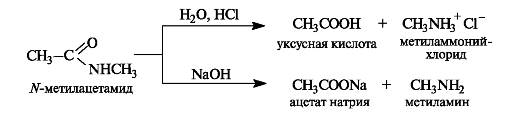
Высокая устойчивость амидов к гидролизу объясняется электронным строением амидной группы, во многом сходным со стро- ением карбоксильной группы. Амидная группа представляет собой р,л-сопряженную систему, в которой неподеленная пара электронов атома азота сопряжена с π-электронами связи С=О. Вследствие сильного +M-эффекта аминогруппы частичный положительный заряд на карбонильном атоме углерода амидов меньше, чем у других функциональных производных кислот. В результате связь углерод-азот в амидах имеет частично двойной характер.
|
|
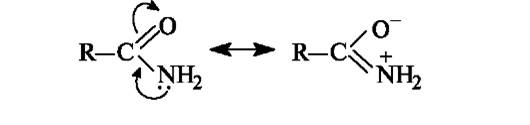
Следствием сопряжения является также чрезвычайно низкая основность атома азота амидной группы. Напротив, у амидов появляются слабые кислотные свойства. Следовательно, амиды обладают амфотерными свойствами.
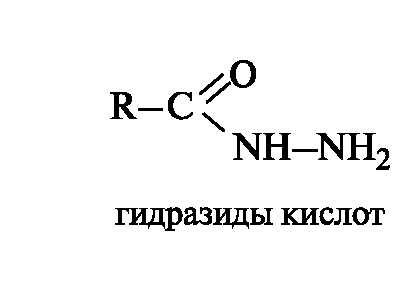
Амидам родственны гидразиды - производные карбоновых кислот, содержащие остаток гидразина H2NNH2. Немало лекарственных
средств являются по своей природе гидразидами, например, противотуберкулезное средство изониазид (см. 13.4.1). Как и амиды, гидразиды подвергаются гидролизу в достаточно жестких условиях с расщеплением связи C-N.
Ангидриды
Ангидриды кислот чаще встречаются in vivo в виде смешанных ангидридов, включающих ацильные остатки разных кислот, причем одна из кислот - неорганическая (чаще всего фосфорная).

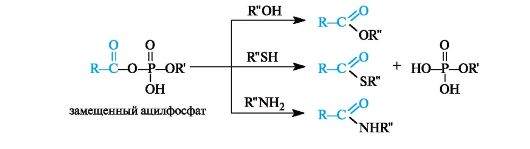
Ацилфосфаты являются хорошими переносчиками ацильных групп, поскольку в реакциях нуклеофильного замещения фосфатные группы представляет собой хорошие уходящие группы.
Замещенные ацилфосфаты - метаболиты, с участием которых в организме осуществляется перенос ацильных остатков к гидроксильным, тиольным группам и аминогруппам различных соединений.
Сульфоновые кислоты
|
|
|

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!