

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
Топ:
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Интересное:
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Аспарагиновая кислота (ионизированная форма – аспартат) и её амид аспарагин являются заменимыми гликогенными аминокислотами.

L-Аспартат L-Аспарагин
Остаток аспартата в белках заряжен отрицательно. Наряду с глутаматом, аспартат формирует отрицательный заряд белков крови и ряда других белков. Остатки аспартата в белках могут входить в состав каталитического участка активного центра фермента, участвуя в кислотно-основном катализе.
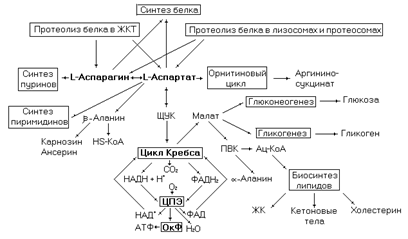
Рис. 31. Метаболические превращения аспартата и аспарагина.
Остатки аспартата в белках могут фосфорилироваться и дефосфорилироваться. Через эту химическую модификацию регулируется работа некоторых белков (Na+/K+-АТФ-аза). Радикалы аспарагина в белках могут гликозилироваться, образуя N-гликозидную связь. Таким образом, идет формирование гликопротеинов.
Аспартат участвует во временном и постоянном обезвреживании аммиака. Временное обезвреживание аммиака осуществляется через образование аспарагина в реакции катализируемой аспарагинсинтетазой. Аспартат участвует в окончательном обезвреживании аммиака в орнитиновом цикле, в реакции катализируемой аргининосукцинатсинтетазой.
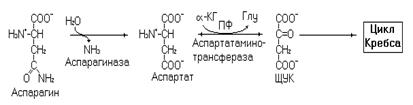
Рис. 32. Катаболизм аспарагина и аспартата.
Окисление щавелевоуксусной кислоты в цикле Кребса сопровождается образованием 6 молекул НАДН; 6 Н+; 2 ФАДН2; 2 ГТФ, что в совокупности составит 20 молекул АТФ. С учетом затрат на обезвреживание аммиака в орнитиновом цикле суммарная биоэнергетика окисления аспартата составит 16 молекул АТФ, а для аспарагина – 12 молекул АТФ.
Декарбоксилирование аспартата приводит к образованию a-аланина или b-аланина. a-Аланин может трансаминироваться с a-кетоглутаровой кислотой с образованием пирувата и глутамата. В свою очередь пируват в митохондриях с участием пируватдегидрогеназного комплекса окисляется в ацетил-КоА. Через ацетил-КоА углеродные атомы аспарагина и аспартата могут вступать в синтез жирных кислот, холестерола и их производных (триацилглицеролы, глицерофосфолипиды, холестерин, стероидные гормоны, желчные кислоты). b-Аланин используется организмом на синтез КоА и биологически активных дипептидов карнозина и ансерина.
|
|
Аспартат участвует в синтезе пиримидиновых нуклеотидов, а в головном мозге, предположительно, выполняет функцию нейромедиатора.
Аспарагин участвует в синтезе пуриновых нуклеотидов как донор аминогрупп.
Диагностически ценным является определение активности аспартатаминотрансферазы в крови. Фермент катализируют обратимую реакцию. Активность этого фермента в сыворотке крови возрастает при инфаркте миокар-
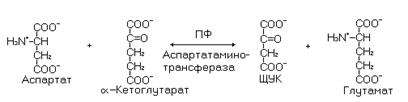
да, гепатитах и другой патологии связанной с некрозом тканей и гибелью клеток. При некрозе внутриклеточные ферменты поступают в кровь, где их активность вырастает многократно. Активность аспартатаминотрансферазы в сыворотке при инфаркте миокарда выше, чем активность аланинаминотрансферазы, а при гепатите наоборот.
Задания к разделу «Обмен аспарагиновой кислоты
и аспарагина»
Задание 1
Остаток аспарагина может подвергаться химической модификации.
1. Назовите два типа химической модификации остатков аспарагина.
2. Как называются сложные белки, возникающие в результате химической модификации остатков аспарагина?
Задание 2
Превращение одних заменимых аминокислот в другие осуществляются через реакции трансаминирования (в том числе). В одной из таких реакций образуется аспартат.
1. Напишите эту реакцию, назовите фермент и кофермент участвующие в ней.
2. Какая патология сопровождается высокой активностью фермента в крови?
|
|
Задание 3
Имеется несколько путей образования аспартата в организме человека.
1. Назовите пути образования аспартата.
2. Напишите реакцию образования аспартата из кетокислоты.
Задание 4
Один из атомов азота мочевины поступает в неё из аспартата, при этом образуется соединение, распад которого приводит к образованию аргинина и фумаровой кислоты.
1. Напишите реакцию орнитинового цикла с участием аспартата.
2. Напишите реакции ресинтеза аспартата из фумаровой кислоты.
Задание 5
Напишите реакции катаболизма аспартата и подсчитайте биоэнергетику этого процесса.
Задание 6
В процессе катаболизма аспартата образуется промежуточный продукт, используемый в гликогенезе.
1. Назовите этот промежуточный продукт.
2. Напишите реакции синтеза гликогена из этого продукта.
3. Сколько молекул этого продукта необходимо для удлинения цепи гликогена на 1 единицу?
Задание 7
При физиологических значениях рН остатки аспартата в белках заряжены отрицательно.
1. Назовите белки с высоким содержанием аспартата.
2. Какого типа взаимодействия возникают между остатком аспартата и остатками других аминокислот при формировании третичной структуры белка?
3. Какие специфические функции белков обеспечиваются радикалом аспартата.
Задание 8
Напишите реакции синтеза аспартата из углеродных атомов и аминогруппы a-аланина. Подсчитайте биоэнергетику.
Обмен аргинина
Аргинин – частично заменимая для человека аминокислота (может синтезироваться в орнитиновом цикле), гликогенная, с положительно заряженным радикалом.
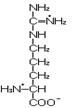
L-аргинин
В организм человека эта аминокислота поступает с пищей, образуется при протеолизе эндогенных белков и в орнитиновом цикле. Наряду с лизином, аргинин в большом количестве входит в состав ядерных белков – гистонов. Остатки аргинина и лизина придают этим белкам положительный заряд, что дает им возможность взаимодействовать с отрицательно заряженными полинуклеотидными цепями ДНК и формировать хроматин с высокой плотностью упаковки. В ряде ферментов остатки аргинина участвуют в формировании и функционировании их активного центра.
Превращения аргинина в организме представлены на следующей схеме.
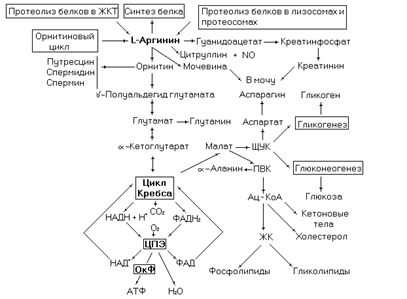
Рис. 33. Метаболические превращения аргинина.
|
|
Одной из очень важных для организма реакций с участием аргинина является реакция образования оксида азота, которая катализируется сложным ферментным комплексом NO-синтазой.
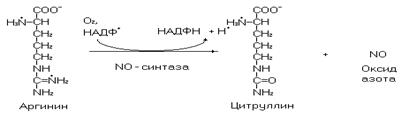
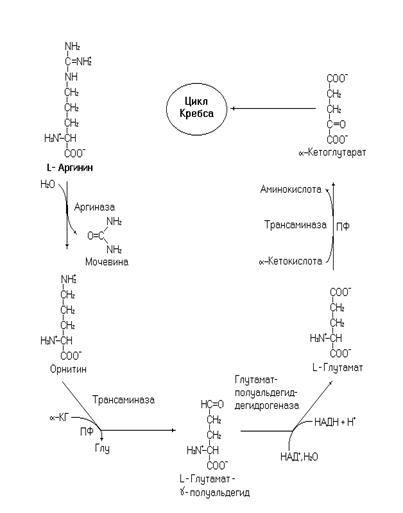
Рис. 34. Катаболизм аргинина.
Оксид азота первичный мессенджер. Он взаимодействует с гемом растворимой гуанилатциклазы, что приводит к образованию цГМФ (вторичный мессенджер) – расширяет сосуды, снижает частоту сердечных сокращений. Кроме того, оксид азота регулирует апоптоз, предотвращает агрегацию тромбоцитов, выполняет функцию нейромедиатора, препятствует развитию опухолей.
Молекула аргинина у человека используется в синтезе биогенных аминов (путресцина, спермина и спермидина), креатинфосфата. У микроорганизмов аргинин используется в синтезе макроэргического фосфата (аргининфосфат). При декарбоксилировании аргинина образуется агматин.
Катаболизм аргинина идет через последнюю реакцию орнитинового цикла как показано на рисунке 34.
a-Кетоглутарат окисляется через 2,5 оборота цикла Кребса. Биоэнергетика окисления аргинина составит 22 молекулы АТФ (с учетом нейтрализации 2 аминогрупп в орнитиновом цикле).
Углеродный остов молекулы аргинина может участвовать в синтезе углеводов, липидов, аминокислот и других соединений, как это показано на схеме.
Гипераргинемия – заболевание, связанное с нарушением реабсорбции аргинина и некоторых аминокислот в нефроне. При данной патологии увеличивается концентрация аргинина и ряда аминокислот в крови.
Задания к разделу «Обмен аргинина»
Задание 1
Синтезируйте спермидин с участием аргинина. Объясните биологическую функцию спермидина.
Задание 2
Одним из промежуточных производных катаболизма аргинина является a-кетоглутарат. Объясните коллекторную функцию этого соединения в сборе аминогрупп от разных аминокислот для последующей передачи в синтез мочевины.
Задание 3
Получите пролин из аргинина. Используйте для этого не только углеродные атомы аргинина, но и его аминогруппу. Подсчитайте биоэнергетику этого биосинтеза.
Задание 4
|
|
Одним из направлений метаболизма аргинина является его участие в синтезе макроэргического фосфата используемого для поддержания мышечного сокращения. Получите это соединение, подсчитайте биоэнергетику процесса.
Обмен гистидина
Гистидин частично заменимая, гликогенная аминокислота. По свойствам радикала относится к группе аминокислот с положительно заряженными радикалами.
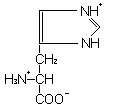 L-Гистидин
L-Гистидин
Гистидин относят к полунезаменимым аминокислотам, поскольку организм взрослого человека может продолжительное время существовать без поступления этой аминокислоты с пищей, однако растущий организм в ней нуждается. Радикалы гистидина участвуют в формировании третичной структуры белков. Некоторые ферменты содержат радикалы гистидина в каталитическом участке активного центра, где они участвуют в кислотно-основном катализе.
Очень многообразны функции остатков гистидина в гемоглобине. В этом олигомерном белке каждая из четырех полипептидных цепей присоединена к молекуле гема через координационную связь между азотом имидазола гистидина протомера и железом гема. Ряд остатков гистидина гемоглобина участвует
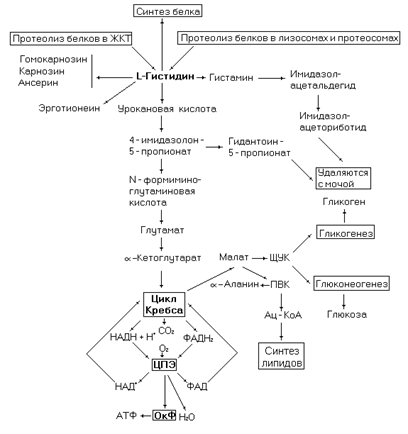
Рис. 35. Метаболические превращения гистидина.
в транспорте протонов от периферических тканей к легким, поскольку легко присоединяют протоны, и легко их отдают (pK имидазола гистидина – 6,0). Кроме того, другие гистидиновые остатки гемоглобина участвуют в связывании 2,3-дифосфоглицерата, соединения регулирующего сродство гемоглобина к кислороду. Такое связывание обеспечивается за счет электростатических взаимодействий между положительно заряженными остатками гистидина и отрицательно заряженной молекулой 2,3-дифосфоглицерата. Взаимодействие этого соединения с гемоглобином приводит к снижению его сродство к кислороду, что позволяет организму приспосабливаться к низкому парциальному давлению этого газа, и адекватно обеспечивать потребности организма в кислороде.
Декарбоксилирование гистидина приводит к образованию гистамина.
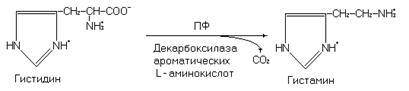
Реакция катализируется декарбоксилазой ароматических L-аминокислот, не специфическим по отношению к гистидину ферменту (катализирует декарбоксилирование диоксифенилаланина, 5-гидрокситриптофана, фенилаланина, тирозина и триптофана).
Гистамин выполняет функцию нейромедиатора в нервной ткани и медиатора в других тканях, депонируется в тучных клетках соединительной ткани и базофильных гранулоцитах крови, участвует в развитии аллергических и воспалительных реакций. Высвобождение гистамина из его депо стимулируют тканевые гормоны, некоторые лекарственные препараты и аллергены. Гистамин (через Н1 рецептор) стимулирует сокращение гладких мышц бронхов, расширяет капилляры и повышает их проницаемость. Через H2 рецептор стимулирует образование соляной кислоты в желудке и замедляет сердечный ритм, а через Н3 рецептор активирует ЦНС. В организме человека гистамин быстро разрушается, превращаясь в имидазолацеториботид, который удаляется с мочой.
|
|
Гистидин используется в синтезе дипептидов карнозина и ансерина.
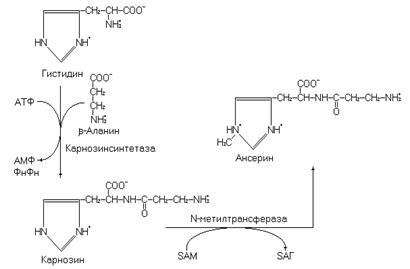
Примечание: SAM – S-аденозилметионин, SАГ – S-аденозилгомоцистеин.
Карнозин и ансерин полифункциональные молекулы. Известно, что эти пептиды выполняют буферную функцию, защищают клетки от действия активных форм кислорода, образуют хелаты с ионами двухвалентных металлов, активируют гуанилатциклазу, замедляют старение организма.
В головном мозге человека присутствует гомокарнозин, который синтезируется из гистидина и g-аминомасляной кислоты (функция гомокарнозина неизвестна).
Существует два пути катаболизма гистидина. В одном из них (преобладает у человека, приматов и крысы) гистидин преобразуется до гидантоин-5-пропионовой кислоты, в виде которой поступает в мочу. По другому пути гистидин трансформируется до a-кетоглутаровой кислоты, дальнейшее окисление которой происходит в цикле Кребса и цепи переноса электронов. Начальные стадии обоих путей совпадают. Эти метаболические пути осуществляются следующим образом.
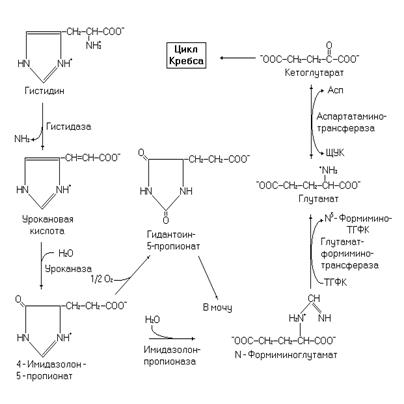
Рис. 36. Катаболизм гистидина
Превращение глутамата в a-кетоглутарат может протекать с использованием аланинаминотрансферазы и глутаматдегидрогеназы, а не только аспартатаминотрансферазы, как это приведено на рисунке. Биоэнергетика окисления гистидина через цикл Кребса и цепь переноса электронов составит 23,5 молекулы АТФ (с учетом обезвреживания аммиака в орнитиновом цикле и трансаминазной реакции) или 26 молекул АТФ (с учетом обезвреживания аммиака в орнитиновом цикле и глутаматдегидрогеназной реакции).
Из гистидина образуется a-кетоглутарат, который может вступить на путь синтеза углеводов или липидов, как это показано на рисунке 35.
Известно генетическое нарушение обмена гистидина – гистидинемия. Заболевание обусловлено недостатком фермента гистидазы. При данном заболевании повышается уровень гистидина в крови. В крови и моче появляется имидазолпируват, образующийся из гистидина в результате блока превращения его в урокановую кислоту. Имидазолпируват дает положительную реакцию с хлоридом железа, что может привести к постановке неправильного диагноза, в виду того, что положительная реакция с хлоридом железа бывает при фенилкетонурии. Кроме имидазолпирувата в моче больных появляются продукты его превращения – имидазолацетат и имидазоллактат. Более половины больных гистидинемией страдают умственной отсталостью и дефектами речи.
Задания к разделу «Обмен гистидина»
Задание 1
Напишите реакции катаболизма гистидина до гидантоин-5-пропионовой кислоты. Подсчитайте биоэнергетику процесса.
Задание 2
Получите из гистидина гистамин. Объясните роль гистамина в организме человека. Как осуществляется дальнейший метаболизм гистамина (схема)?
Задание 4
На основе углеродных атомов гистидина возможен синтез нескольких аминокислот. Напишите подробную схему синтеза аспарагина из гистидина. Обе аминогруппы аспарагина также должны принадлежать исходному гистидину. Подсчитайте биоэнергетику процесса.
Обмен пролина
Пролин – заменимая, гликогенная иминокислота с гидрофобным радикалом.
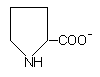 L-пролин
L-пролин
Обмен иминокислоты можно представить следующей схемой.
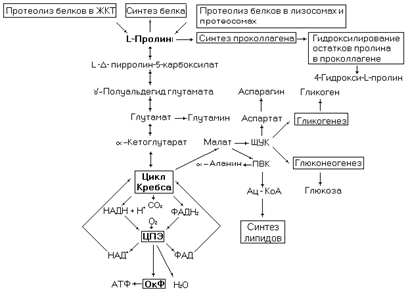
Рис. 37. Метаболические превращения пролина.
Высокое содержание пролина в коллагене, где на эту иминокислоту и её гидроксилированные формы приходится более 20 % от общего количества аминокислот. Гидроксилирование остатков пролина пролилгидроксилазой осуществляется в процессе синтеза цепей проколлагена, когда полипептидная цепь ещё связана с рибосомой. Это пептидилгидроксилаза – оксигеназа со смешанной функцией, для действия которой необходим О2, Fе2+, аскорбиновая кислота и a-кетоглутарат. Один атом кислорода из его молекулы связывается с остатком пролина, а другой поступает в состав сукцината.
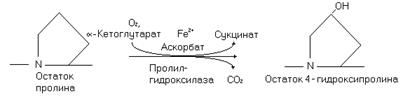
Остатки гидроксипролина стабилизируют тройную спираль тропоколлагена, повышают его устойчивость к действию протеаз. В отличие от гидроксилизина остатки гидроксипролина не гликозилируются. Аскорбат участвующий в этой реакции участвует также в гидроксилировании остатков лизина в проколлагене.
Превращение глутамата в a-кетоглутарат (рис. 38) катализируется трансаминазами или глутаматдегидрогеназой. Дальнейшее окисление a-кетоглутарата осуществляется в цикле Кребса и ЦПЭ. Биоэнергетика окисления пролина составит 28,5 молекул АТФ в случае использования трансаминазной реакции или 31 молекулу АТФ при окислении через глутаматдегидрогеназную реакцию (с учетом затрат на нейтрализацию аммиака через орнитиновый цикл).
a-Кетоглутарат может метаболизировать в углеводы, липиды, аминокислоты и другие метаболиты, как это представлено на рисунке 37.
При недостаточности в организме человека витамина C у него развивается цинга, в числе симптомов которой увеличение проницаемости сосудов, расшатывание и выпадение зубов. Эти симптомы легко объясняются нарушением гидроксилирования остатков пролина и лизина в проколлагене. Молекулы коллагена
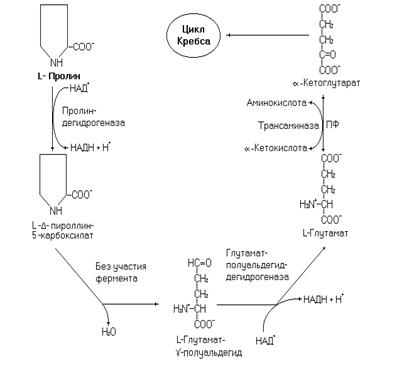
Рис. 38. Катаболизм пролина.
участвующие в прикреплении зуба к челюсти и коллаген, входящий в стенки сосудов подвергаются действию протеаз и разрушаются. Нарушается гликозилирование остатков гидроксилизина и образования коллагеновых фибрилл. Всё это в совокупности и вызывает соответствующую симптоматику.
Протеолиз эндогенного коллагена приводит к образованию свободного гидроксипролина. В отличие от пролина окисление гидроксипролина идет с образованием таких промежуточных продуктов как пируват и глиоксилат. При генетическом дефекте в гене, кодирующем первичную структуру фермента 4-гидроксипролиндегидрогеназы, развивается гипергидроксипролинемия. Это заболевание характеризуется повышенным содержанием 4-гидроксипролина в крови, однако, значимой патологической картины не отмечается.
Кроме гипергидроксипролинемии известны и другие генетические нарушения метаболизма пролина. Гиперпролинемия типа 1 связана с дефектом фермента пролиндегидрогеназы, а гиперпролинемия типа 2 с дефектом фермента глутаматполуальдегиддегидрогеназы. В половине зарегистрированных случаев у больных отмечается умственная отсталость. Тем не менее, оба заболевания считаются не опасными для жизни.
Задания к разделу «Обмен пролина»
Задание 1
Синтезируйте пролин из углеродных атомов аргинина. Подсчитайте биоэнергетику процесса.
Задание 2
Напишите реакцию, блок которой при цинге приводит к повышению проницаемости капилляров и как следствие к повышенной кровоточивости десен, расшатыванию и выпадению зубов. Объясните наблюдаемые симптомы, через молекулярные изменения, возникающие при этом заболевании.
Задание 3
Протеолиз эндогенного коллагена приводит к образованию 4-гидроксипролина. Напишите реакции катаболизма 4-гидроксипролина до пирувата и глиоксилевой кислоты. Получите из пирувата аспартат.
Обмен метионина
Метионин – гликогенная, незаменимая аминокислота. По свойствам своего радикала относится к группе аминокислот с неполярным радикалом.
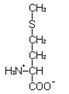 L-метионин
L-метионин
В обменный пул метионин поступает в результате гидролиза пищевых белков или собственных белков организма.
Превращения этой аминокислоты в организме можно представить в виде следующей схемы.
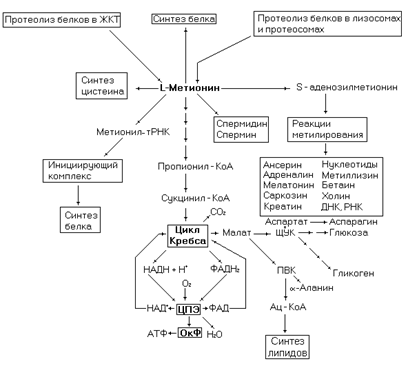
Рис. 39. Метаболические превращения метионина.
Активная форма метионина – S-аденозилметионин, участвует в реакциях метилирования. Она образуется в реакции метионина с АТФ. Метилированию подвергаются нуклеиновые кислоты, белки, гормоны и другие соединения. Метилирование нуклеиновых кислот по азотистым основаниям, предположительно защищает их от действия нуклеаз, ферментов гидролизующих нуклеиновые кислоты. Участвуя в реакциях метилирования, S-аденозилметионин преобразуется до сукцинил-КоА.
Окисление сукцинил-КоА в лимоннокислом цикле дает 26 молекул АТФ, однако с учетом предыдущих этапов и затрат на нейтрализацию аммиака энергетический баланс окисления метионина составит 19,5 молекул АТФ.
Преобразование S-аденозилметионина в сукцинил-КоА тормозится при недостатке метионина в организме (метионин – незаменимая аминокислота). В этом случае происходит регенерация метионина из гомоцистеина (промежуточный продукт катаболизма S-аденозилметионина).
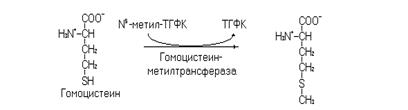
Гомоцистеин метилируется ферментом гомоцистеинметилтрансферазой. Промежуточным переносчиком метильной группы для этой реакции служит метилкобаламин (коферментная форма витамина В12).
Метионин (эукариоты) участвует в биосинтезе белка, а конкретно в образовании инициирующего комплекса, где присутствует в форме метионил-тРНК. Хотя синтез белка и начинается с метионина, однако, в зрелом белке с N-конца он, как правило, отсутствует, удаляясь из него с сигнальной последовательностью во время посттрансляционной модификации белка. Естественно, что метионин участвует и в построении молекул белка.
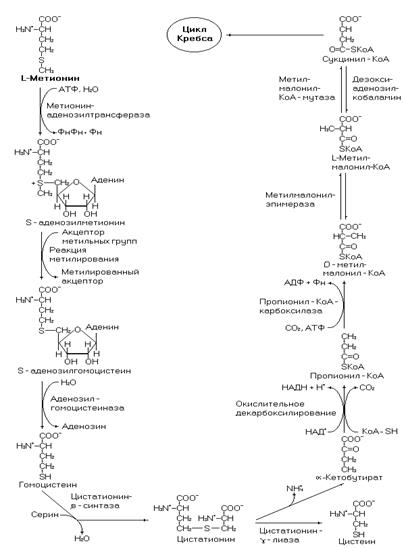
Рис. 40. Катаболизм метионина.
Прокариоты в образовании инициирующего комплекса используют формил-метионил-тРНК – производное метионина.
Один из ферментов катаболизма метионина метилмалонил-КоА-мутаза нуждается в дезоксиаденозилкобаламине – коферментной форме витамина В12, поэтому при недостаточности этого витамина развивается метилмалонатная ацидурия. Через преобразование L-метилмалонил-КоА в сукцинил-КоА идет катаболизм жирных кислот с нечетным числом углеродных атомов, изолейцина и валина, поэтому и эти соединения осуществляют свой вклад в развитие метималонатной ацидурии при недостаточности витамина В12.
Углеродный скелет метионина может участвовать в реакциях анаболизма, в частности, в синтезе глюкозы и гликогена. В синтез углеводов поступает сукцинил-КоА, который сначала через цикл Кребса преобразуется до малата. Малат выводится из митохондрий дикарбоксилатной транспортной системой в цитозоль и через малатдегидрогеназную реакцию превращается в оксалоацетат, последний, в зависимости от типа клетки, вступает или в глюконеогенез или гликогенез. В свою очередь глюкоза может преобразовываться в рибозо-5-фосфат, а через него вступать в нуклеиновый обмен. Глюкоза используется на синтез других углеводов, гликопротеидов, гликолипидов и ряда других соединений.
Метионин может участвовать и в липидном обмене. Для этого углеродный скелет метионина преобразуется до ацетил-КоА, из которого синтезируются жирные кислоты и холестерол. Из жирных кислот и холестерола образуется множество их производных используемых для построения клеточных структур (биомембраны), сигнальных молекул первого порядка (гормоны), сигнальных молекул второго порядка (вторичные мессенджеры).
Задания к разделу «Обмен метионина»
Задание 1
Одной из важных функций метионина является его участие в реакциях метилирования. В этих реакциях участвует активная форма метионина – S-аденозилметионин. Напишите структуру этого соединения и его реакцию с фосфатидилэтаноламином.
Задание 2
Введите серу метионина в молекулу цистеина. Подсчитайте биоэнергетику процесса.
Задание 3
Напишите реакцию катализируемую цистатионин-g-лиазой. Введите один из продуктов этой реакции в орнитиновый цикл и синтезируйте мочевину. Подсчитайте биоэнергетику процесса.
Задание 4
Метилмалонатная ацидурия возникает вследствие недостаточности в организме одного из водорастворимых витаминов. Назовите этот витамин и его коферментную форму. Какое отношение к обмену метионина имеет этот витамин?
|
|
|

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!