Заменимые аминокислоты образуются из других аминокислот или продуктов небелкового обмена. Часто в этих синтезах используются реакции трансаминирования. Даже аминокислоты с разветвленной цепью (валин, лейцин, изолейцин) могут синтезироваться при наличие кетопроизводных этих аминокислот.
a-Аланин синтезируется в реакции трансаминирования пировиноградной кислоты с глутаминовой кислотой. Пируват образуется из углеводов в результате гликолиза или гликогенолиза, при деградации глицина, серина, треонина, цистеина, из глицерина образованного при деградации нейтральных жиров или глицерофосфолипидов и ряда других соединений.
Пируват может карбоксилироваться с образованием оксалоацетата. Оксалоацетат трансаминируется с глутаматом и образует аспарагиновую кислоту. Аспарагин образуется из аспарагиновой кислоты.
Серин может образовываться двумя путями, в обратимой
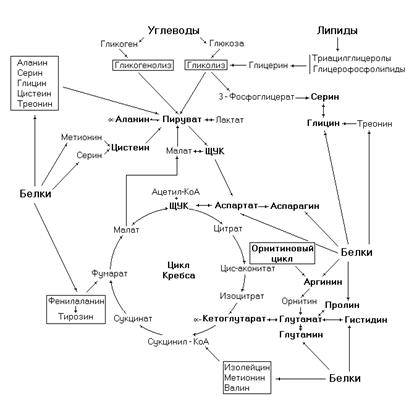
Рис. 9. Пути образования заменимых аминокислот из продуктов белкового, углеводного и липидного обменов.
реакции превращения глицина в серин и из 3-фосфоглицерата – промежуточного продукта гликолиза.
Тирозин синтезируется из фенилаланина в реакции катализируемой фенилаланин-4-гидроксилазой.
Глицин синтезируется тремя путями: из серина, треонина и в реакции катализируемой глицинсинтазой.
Аргинин образуется в орнитиновом цикле.
Глутаминовая кислота синтезируется из a-кетоглутаровой кислоты в глутаматдегидрогеназной реакции. В свою очередь из глутаминовой кислоты образуются глутамин, пролин, гистидин.
Цистеин образуется из серина и метионина.
Более подробно все синтезы рассмотрены в разделах обмена отдельных аминокислот.
ОБМЕН ПРОТЕИНОГЕННЫХ АМИНОКИСЛОТ
Обмен a -аланина
a-Аланин – гликогенная, заменимая аминокислота с гидрофобным радикалом.
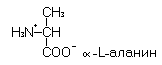
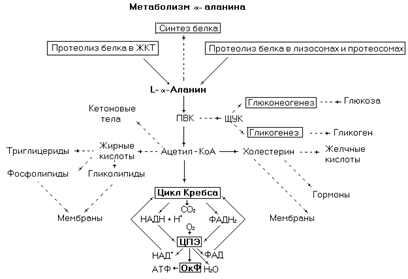
Рис. 10. Метаболические превращения a-аланина в организме человека.
По распространенности в белках эта аминокислота уступает только глицину. В организм человека a-аланин поступает с пищей, образуется в процессе протеолиза эндогенных белков, синтезируется из пировиноградной кислоты при трансаминировании с глутаматом.
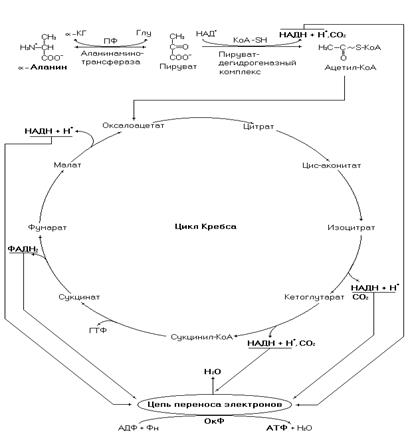
Рис. 11. Катаболизм a-аланина.
Биоэнергетика полного окисления a-аланина составит 8,5 молекул АТФ (с учетом затрат на нейтрализацию аммиака в орнитиновом цикле).
В метаболическом отношении по сравнению с другими аминокислотами a-аланин относительно инертен. Он участвует в синтезе белков и биологически активных пептидов, но в реакциях вторичных метаболических путей участвует плохо. Однако, вследствие высокого содержания этой аминокислоты в организме и белках пищи, часто используется её углеродный скелет. Основной промежуточный продукт её катаболизма – пируват, который может окисляться до конечных продуктов, участвовать в синтезе углеводов, а после деградации до ацетил-КоА в синтезе липидов.
Синтез a-аланина осуществляется из пировиноградной кислоты (промежуточный продукт катаболизма углеводов, белков и глицерина) за счет обращения реакции катализируемой аланинаминотрансферазой.
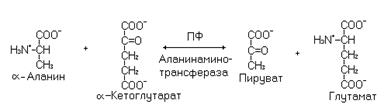
a-Аланин участвует во временном обезвреживании аммиака в мышечной ткани (глюкозо-аланиновый цикл). Эта аминокислота образуется в мышцах в результате трансаминирования пирувата с глутаматом. Источником пирувата в этом случае, главным образом, являются углеводы.
Задания к разделу «Обмен a-аланина»
Задание 1
В мышцах a-аланин участвует в работе глюкозо-аланинового цикла. Напишите реакции этого цикла (схема) и объясните его биологическую роль.
Задание 2
Назовите небелковые источники углеродных атомов для синтеза a-аланина. Напишите реакции синтеза аминокислоты из продукта, образующегося при гидролизе нейтральных жиров. Подсчитайте биоэнергетику процесса.
Задание 3
Получите b-аланин из a-аланина. Подсказка – синтез пойдет через образование аминокислоты содержащей 4 углеродных атома.
Обмен глицина
Глицин – гликогенная, заменимая аминокислота. В виду отсутствия хирального центра не образует оптических изомеров.
 Глицин
Глицин
Одна из простейших аминокислот, в значительных количествах содержится в составе белков. В коллагене его содержание составляет до 30% от остальных аминокислот. В этом белке глицин входит в состав повторяющейся последовательности Гли – X – Y, где Х чаще всего пролин или гидроксипролин, а Y - a-аланин или другая аминокислота. Глицин образуется при гидролизе пищевых белков в ЖКТ, внутриклеточном протеолизе эндогенных белков, из серина, треонина и в глицинсинтазной реакции. Основным направлением использования глицина является синтез белка.
В головном мозге глицин выполняет функцию нейромедиатора. Вместе с глутаминовой кислотой и цистеином принимает участие в синтезе биологически активного пептида – глутатиона.
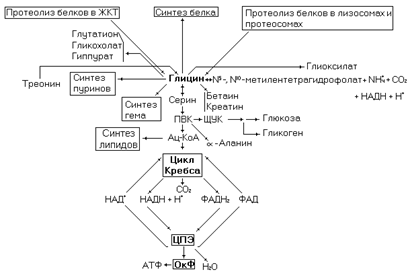
Рис. 12. Метаболические превращения глицина.
Основной путь катаболизма глицина происходит через глицинсинтазную обратимую реакцию (через эту реакцию осуществляется и синтез глицина).
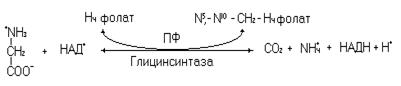
Приведенная выше реакция осуществляется мультиферментным комплексом в митохондриях. Меньшая часть глицина метаболизирует через превращение в серин и далее до ацетил-КоА, в виде которого углеродный скелет аминокислоты поступает в цикл Кребса для дальнейшего окисления.
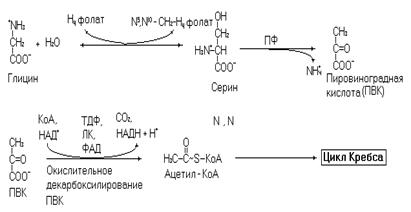
Рис. 13. Катаболизм глицина через серин.
Биоэнергетика окисления глицина по этому пути составит 8,5 молекул АТФ (с учетом затрат на нейтрализацию аммиака через орнитиновый цикл).
Пировиноградная кислота, образующаяся в приведенной последовательности реакций, может использоваться в реакциях анаболизма, в частности, синтезе глюкозы (глюконеогенез) и её производных (уроновые кислоты, аминосахара, гексозы, гликопротеиды, гликолипиды, гликозоаминогликаны) синтезе гликогена (гликогенез) и a-аланина.
Через глюкозу обмен глицина может сопрягаться (через пентозофосфатный путь) с обменом нуклеотидов и нуклеиновых кислот.
Карбоксилирование пирувата ферментом пируваткарбоксилазой приводит к образованию ЩУК, а из неё образуются аспартат и аспарагин. Ацетил-КоА (образуется при окислительном декарбоксилировании ПВК в митохондриях) может вступать на путь синтеза жирных кислот, кетоновых тел, холестерола, а также их производных. Глицерофосфолипиды и холестерол используются на построение клеточных мембран, синтез гормонов (стероидные гормоны), органических осмолитов (глицерофосфохолин), желчных кислот (холевая, таурохолевая, гликохолевая), вторичных мессенджеров (диацилглицерол) и других продуктов.
Глицин участвует в работе сукцинат-глицинового цикла.
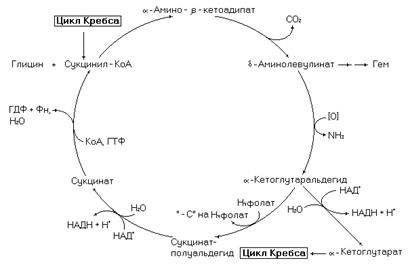
Рис. 14. Сукцинат-глициновый цикл.
Этот метаболический путь связан с циклом Кребса и необходим для синтеза гема. Реакции цикла начинаются с конденсации глицина с сукцинил-КоА и завершаются образованием сукцинил-КоА. Процесс становится линейным в случае использования d-аминолевулината (промежуточный продукт цикла) в синтезе гема. С циклом Кребса этот метаболический путь связан через такие промежуточные продукты как сукцинил-КоА и a-кетоглутарат.
Глицин участвует в нейтрализации некоторых соединений путем образования коньюгатов.
Коньюгация глицина с холевой кислотой в печени приводит к образованию гликохолата участвующего в эмульгировании жиров в ЖКТ и всасывании продуктов гидролиза. Другая парная

Рис. 16. Синтез гиппуровой кислоты.
желчная кислота – таурохолевая синтезируется из таурина (продукт превращения глицина).
Глицин участвует в синтезе креатинфосфата. Креатинфосфат – макроэргический фосфат, участвует в транспорте фосфорильной группы в миофибриллы и рефосфорилировании АДФ до АТФ. Синтез креатинфосфата осуществляется в почках и печени, а используется и деградирует он в мышцах. В мышцах креатинфосфат может спонтанно дегидратироваться и дефосфорилироваться без участия ферментов, превращаясь в креатинин. Креатинин выделяется из организма с мочой, и его концентрация в ней зависит от мышечной массы человека и интенсивности физической работы.
Глицин участвует в нейтрализации некоторых соединений путем образования коньюгатов. В частности коньюгация глицина с активной формой бензойной кислоты приводит к образованию гиппуровой кислоты.
Важным направлением метаболизма глицина является его участие в синтезе пуриновых азотистых оснований.
При нарушении обмена глицина развивается глицинурия и первичная гипероксалурия. При глицинурии уровень глицина в плазме крови нормальный, а экскреция глицина с мочой может
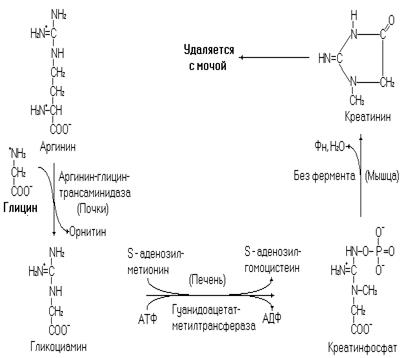
Рис. 15. Синтез креатинфосфата.
достигать 1 г в сутки. Предположительно дефект связан с нарушением реабсорбции аминокислоты в нефронах.
Первичная гипероксалурия характеризуется повышенным выделением с мочой щавелевой кислоты (оксалата) независимо от поступления оксалата с пищей. При этом заболевании отмечается отложение оксалатных камней в мочевыводящих путях, развивается нефрокальциноз и рецидивирующая инфекция мочевыводящих путей. Возникающая далее почечная недостаточность и гипертония приводят к смерти в раннем возрасте. При этом заболевании нарушена активность глицинтрансаминазы и нарушено окисление глиоксилата в формиат. Глиоксилат образуется при дезаминировании глицина, в дальнейшем глиоксилат окисляется в оксалат, избыток которого и приводит к поражению почек (мочекаменная болезнь).
Задания к разделу «Обмен глицина»
Задание 1
Напишите реакцию, катализируемую глицинсинтазой. Напишите схему утилизации аммиака и углекислого газа, образующихся в этой реакции.
Задание 2
Напишите реакции синтеза креатинфосфата с участием глицина. Охарактеризуйте роль креатинфосфата в организме. В виде какого конечного продукта удаляется из организма креатинфосфат?
Задание 3
Глицин участвует в синтезе биологически активного трипептида. Напишите структуру этого трипептида, объясните его роль в эритроцитах.
Задание 4
Какая патология обмена глицина сопровождается повышенной экскрецией глицина с мочой при нормальном его содержании в крови? Назовите возможную причину возникновения данной патологии.
Задание 5
Сукцинат-глициновый цикл начинается с конденсации глицина с сукцинил-КоА в реакции катализируемой d-аминолевулинатсинтазой. Напишите эту реакцию. Сколько углеродных атомов глицина поступит в состав d-аминолевулината.
Задание 6
Напишите процессы обезвреживания токсичных для организма продуктов с участием глицина. Назовите пути удаления глициновых коньюгатов.
Обмен серина
Серин – заменимая гликогенная аминокислота, по свойствам радикала относящаяся к группе аминокислот с полярными, незаряженными радикалами.
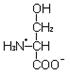 L-серин
L-серин
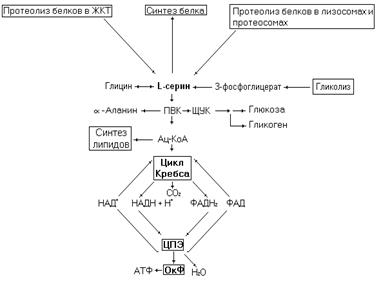
Рис. 17. Метаболические превращения серина.
Серин поступает в обменный пул в результате гидролиза экзогенных и эндогенных белков, синтезируется из промежуточного продукта гликолиза 3-фосфоглицерата, а главным образом из глицина. Как все протеиногенные аминокислоты серин участвует в синтезе белков. Ряд ферментов (ацетилхолинэстераза, сериновые протеиназы и др.) содержат остаток серина в каталитическом участке активного центра, где он участвует в кислотно-основном катализе как донор протонов. Остатки серина в белках участвуют в формировании третичной структуры белка, образуя водородные связи с радикалами других аминокислот. Через гидроксильную группу радикала серина идет присоединение углеводов в гликопротеидах. Между остатком серина и углеводом образуется O-гликозидная связь.
Остатки серина в белках могут фосфорилироваться и дефосфорилироваться. Фосфорилирование радикала серина происходит в следующей реакции.

Дефосфорилирование остатков серина осуществляется протеинфосфатазами (гидролитически). Как фосфорилирование, так и дефосфорилирование остатков серина необходимо для регуляции биологической активности белков. Одни белки при фосфорилировании активируются, а другие теряют свою активность. Так, гликогенфосфорилаза (фермент, катализирующий фосфоролиз гликогена) при фосфорилировании активируется, а гликогенсинтетаза (фермент, участвующий в синтезе гликогена) при фосфорилировании инактивируется. Такая регуляция активности белков очень удобна для клетки и организма в целом, позволяя им быстро реагировать на внутренние или внешние изменения.
Серин участвует в синтезе мембранных липидов или их компонентов. В частности он идет на синтез фосфатидилсерина, сфингозина, сфингомиелина, фосфатидилэтаноламина, фосфатидилхолина, цереброзидов и ганглиозидов. Остатки серина в фосфатидилсерине (расположены во внутреннем слое мембраны) могут фосфорилироваться, что усиливает трансмембранный потенциал и способствует переносу ионов через мембрану по электрическому градиенту.
Кроме описанного выше синтеза серина из глицина, он может синтезироваться из 3-фосфоглицериновой кислоты (образуется в гликолизе) и треонина.
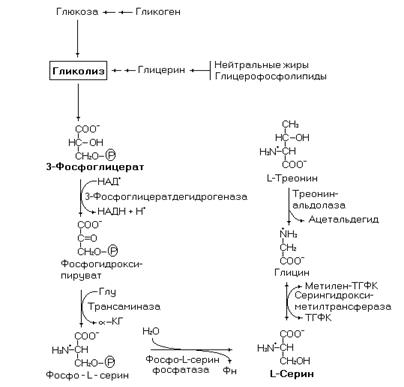
Рис.18. Синтез серина из 3-фосфоглицерата и треонина.
Декарбоксилирование серина, с участием сериндекарбоксилазы, приводит к образованию этаноламина. Этаноламин может в дальнейшем вступить на путь образования фосфатидилэтаноламина или преобразоваться в холин, а далее в фосфатидилхолин или сфингомиелин. Сложные липиды, образованные с участием серина, используются на построение клеточных мембран (определяя их основные свойства).
Молекула серина поставляет углеродные атомы для синтеза цистеина (более подробно описано в главе по обмену метионина).
Катаболизм серина может идти по двум направлениям. Одно из них протекает через реакцию катализируемую сериндегидратазой.

В этом случае серин сначала преобразуется в пировиноградную кислоту, далее через окислительное декарбоксилирование в ацетил-КоА, а последний окончательно окисляется через цикл Кребса и дыхательную цепь. Энергетический баланс такого окисления составит 8,5 молекул АТФ (с учетом затрат на нейтрализацию аммиака в орнитиновом цикле). Этот вариант катаболизма осуществляется в печени человека, однако, основным путем катаболизма серина является его превращение через глицин и далее как это представлено ниже.
Окисление серина через глицин энергетически менее выгодно, чем окисление через пировиноградную кислоту, однако образующиеся на этом пути N5, N10 - метилентетрагидрофолат и НАДН могут использоваться в анаболических реакциях.
Катаболизм серина через образование ПВК это ещё и путь поступления его углеродных атомов в реакции анаболизма. ПВК карбоксилируется с образованием щавелевоуксусной кислоты. Реакция катализируется пируваткарбоксилазой, идет с участием

Рис. 19. Катаболизм серина через глицин.
биотиниллизина (коферментная форма витамина H) и обеспечивается энергией гидролиза АТФ. Далее щавелевоуксусная кислота преобразуется в малат (за счет обращения малатдегидрогеназной реакции), а малат выводится из митохондрии в цитозоль дикарбоксилатной транспортной системой локализованной во внутренней мембране органеллы. В цитозоле малат превращается в ЩУК и вступает в гликогенез или глюконеогенез.
Углеродные атомы серина также могут участвовать в синтезе липидов. В этом случае серин преобразуется до ацетил-КоА, а уже это соединение участвует в синтезе жирных кислот, холестерина и сложных липидов.
Задания к разделу «Обмен серина»
Задание 1
Напишите реакцию декарбоксилирования серина, получите из продукта декарбоксилирования серина, соединение используемое в фармакопее для лечения жировой инфильтрации печени.
Задание 2
Назовите мембранные липиды в состав которых могут попасть углеродные атомы серина. Получите из серина аминоспирт, входящий в состав гликолипидов.
Задание 3
Остатки серина в белках могут химически модифицироваться. Опишите два типа модификации остатка серина и роль этих процессов для клетки. Назовите фермент гликогенеза, модификация которого по остатку серина сопровождается угнетением его функции.
Обмен треонина
Треонин – незаменимая аминокислота смешанного типа, частично кетогенная и частично гликогенная, относится к группе аминокислот с полярным незаряженным радикалом.
 L-треонин
L-треонин
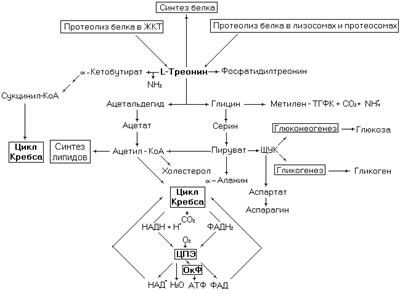
Рис. 20. Метаболические превращения треонина.
Треонин входит в состав многих белков. Как и остаток серина, остаток треонина в белках может фосфорилироваться и дефосфорилироваться. Через такую модификацию остатка треонина модулируется активность белков. Однако фосфорилирование по треонину встречается реже, чем по серину.
Катаболизм треонина в большинстве тканей осуществляется через альдольное расщепление. Треонинальдолаза расщепляет треонин до ацетальдегида и глицина. Ацетальдегид трансформируется до ацетил-КоА и поступает далее в цикл Кребса. Для глицина есть два альтернативных пути окисления (более подробно описанных в разделе обмена глицина). В одном из этих путей глицин трансформируется в серин, а далее в ПВК, который окисляется в ацетил-КоА поступающий в цикл Кребса. Биоэнергетика окисления треонина с учетом того, что обе половины его молекулы поступят в цикл Кребса в виде ацетил-КоА, и с учетом нейтрализации аммиака в орнитиновом цикле, соста-
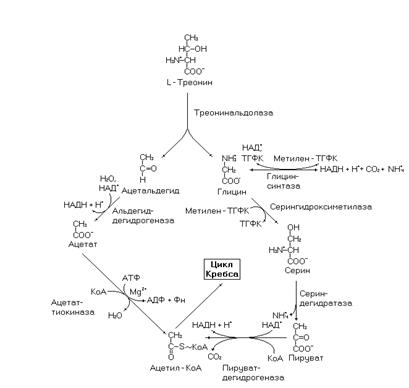
Рис. 21. Катаболизм треонина.
вит 19 молекул АТФ. В другом пути – 11,5 молекул АТФ.
В печени осуществляется неокислительное дезаминирование треонина. При этом образуется a-кетобутират и аммиак. a-Кетобутират может через несколько реакций превратиться в сукцинил-КоА и поступить в цикл Кребса в виде этого соединения (см. подробнее в разделе «Обмен метионина»).
Треонин используется в синтезе мембранного липида – фосфотидилтреонина. Промежуточный продукт катаболизма треонина (пируват) может использоваться в синтезе углеводов, аминокислот, жирных кислот и холестерина, а также в образовании производных перечисленных выше соединений. Это же соединение используется на синтез a-аланина через трансаминирование пирувата с глутаматом. Реакция катализируется аланинаминотрансферазой.
Из пирувата синтезируется щавелевоуксусная кислота (ЩУК). Реакция катализируется пируваткарбоксилазой, идет с участием АТФ и биотиниллизина в качестве кофермента. В свою очередь трансаминирование ЩУК с глутаматом (катализируется аспартатаминотрансферазой) приводит к образованию аспарагиновой кислоты. Аспартат используется на синтез аспарагина, мочевины и ряда других соединений. Синтез жирных кислот и холестерола идет из ацетил-КоА.
Задания к разделу «Обмен треонина»
Задание 1
Напишите реакции образования серина из треонина. Через этот процесс образуется малая часть эндогенно синтезируемого серина. Объясните, почему?
Задание 2
Напишите реакции образования аспарагина из треонина, подсчитайте биоэнергетику процесса. Можно ли треонин образовать из аспарагина?
Задание 3
Преобразуйте треонин до пировиноградной кислоты, а из неё получите глюкозу, подсчитайте биоэнергетику процесса.
Обмен цистеина
Цистеин – заменимая, гликогенная аминокислота с гидрофильным радикалом, поступает в организм с пищевыми белками, образуется при эндогенном протеолизе белков, синтезируется из серина и метионина.
 L-цистеин
L-цистеин
Высокое содержание цистеина в a-кератине (белок волос, ногтей и кожи). В глобулярных белках цистеин участвует в формировании третичной структуры за счет образования дисульфидных связей между остатками цистеина, расположенными в разных положениях полипептидной цепи. Дисульфидные связи преобладают во внеклеточных белках. По-видимому, это связано с тем, что изменения физико-химического состояния внеклеточной среды происходят в более широком диапазоне,
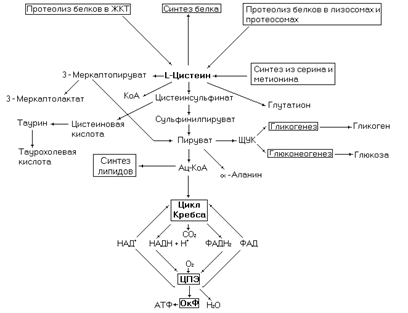
Рис. 22. Метаболические превращения цистеина.
чем в клетке. Дисульфидные связи, являясь ковалентными, делают третичную структуру белка более устойчивой к изменениям параметров внешней среды. В иммуноглобулинах дисульфидные связи связывают их легкие и тяжелые цепи. При гидролизе белков содержащих дисульфидные связи в гидролизате обнаруживается цистин – димер цистеина.
Метаболические превращения цистеина представлены на рисунке 22.
Остатки цистеина участвуют в формировании активного центра некоторых ферментов, принимая участие в кислотно-основном катализе, как донор протонов. Ионы тяжелых металлов, поступающие в организм из окружающей среды, могут вытеснять протон из сульфгидрильной группы остатков цистеина, что может привести к инактивации цистеинзависимых ферментов.
Мультиферментный комплекс синтазы жирных кислот содержит ацилпереносящий белок (АПБ) с остатком цистеина участвующим в синтезе жирной кислоты.
В организме человека из цистеина синтезируется таурин. В почках таурин выполняет функцию органического осмолита (наряду с глицерофосфохолином, сорбитолом, инозитолом, аминокислотами). Печень использует таурин на синтез таурохолевой кислоты, которая вместе с другими поверхностно активными компонентами желчи участвует в эмульгировании пищевых жиров и во всасывании продуктов их гидролиза.
Цистеин участвует в синтезе трипептида – глутатиона. Глутатион участвует в транспорте аминокислот через мембраны (транспорт с участием g-глутамилтрансферазы), в системе антиоксидантной защиты клеток и в ряде других клеточных функций.
Катаболизм цистеина представленный ниже может протекать по двум альтернативным путям. Биоэнергетика окисления цистеина по диоксигеназному пути составит 11 молекул АТФ (с учетом нейтрализации аммиака в орнитиновом цикле), а по альтернативному пути – 8,5 молекул АТФ.
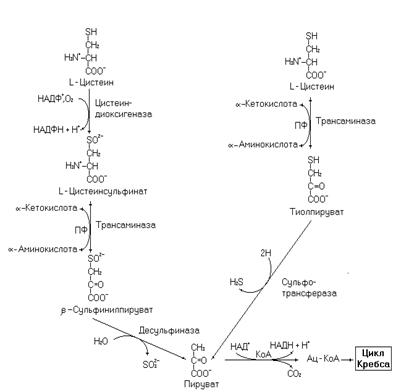
Рис. 23. Катаболизм цистеина.
Образующийся в десульфиназной реакции сульфит окисляется сульфитоксидазой до сульфата. Сульфат в организме (в виде своей активной формы – 3-фосфоаденозин-5-фосфосульфат – ФАФС) используется на сульфатирование гликозоаминогликанов, образования сульфолипидов, обезвреживания токсических продуктов в печени. Избыток сульфата выводится с мочой.
Цистеин синтезируется из серина и метионина как это показано на рисунке 24.
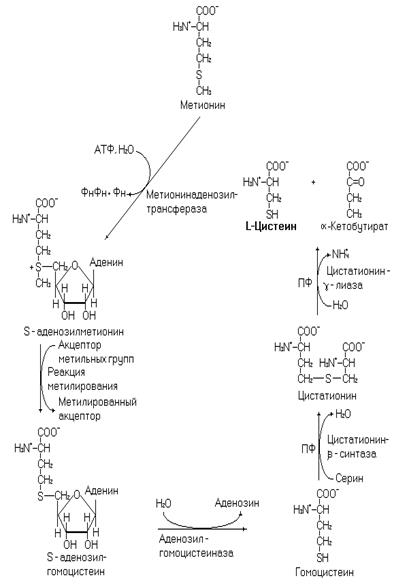
Рис. 24. Синтез цистеина.
Ещё одним направлением использования цистеина является синтез тиоэтаноламинового фрагмента кофермента-А.
Промежуточный продукт окисления цистеина – пируват может использоваться в синтезе глюкозы, гликогена, пентоз, a-аланина, аспартата, аспарагина и производных перечисленных соединений. Таким образом, углеродные атомы цистеина могут поступать в углеводный, белковый, нуклеиновый и липидный обмены. В липидный обмен цистеин поступает через ацетил-КоА.
К патологии обмена цистеина относят цистинурию. При этом наследственном заболевании повышается экскреция с мочой цистина, в 20-30 раз выше нормы. Это связано с нарушением реабсорбции цистина в нефроне. Кроме цистина при этом заболевании увеличивается экскреция лизина, аргинина и орнитина. В ряде случаев заболевание сопровождается образованием и отложением в канальцах цистиновых камней (в виду плохой растворимости цистина). Если камни не откладываются, то заболевание протекает без симптомов.
Задания к разделу «Обмен цистеина»
Задание 1
Напишите синтез цистеина из серина и метионина, подсчитайте биоэнергетику процесса. В процессе синтеза этой аминокислоты образуется a-кетобутират. Напишите схему возможных путей преобразования этого соединения.
Задание 2
В одном из путей катаболизма цистеина образуется b-сульфинилпируват (3-меркаптопируват). В реакции катализируемой десульфиназой из этого соединения образуются пируват и сульфит анион. Какова дальнейшая судьба сульфита и пирувата (схема).
Задание 3
Можно ли образовать цистеин на основе углеродных атомов глутамина и серы метионина, если это возможно, то синтезируйте!
Задание 4
Получите таурохолевую кислоту из цистеина и холевой кислоты. Объясните роль таурохолевой кислоты в организме. Какова судьба таурохолевой кислоты в организме?
Задание 5
Можно ли получить цистеин из глицина и метионина? Найдите такой путь и синтезируйте.
Задание 6
Цистеин относят к глюкогенным аминокислотам, однако его углеродные атомы могут участвовать и в синтезе липидов. Докажите, что это возможно, синтезировав пальмитиновую кислоту.
Обмен глутаминовой кислоты
Глутаминовая кислота (ионизированная форма в водном растворе – глутамат) заменимая, гликогенная аминокислота с отрицательно заряженным радикалом.
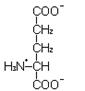 L-Глутамат
L-Глутамат
Превращения глутамата в организме можно представить в виде следующей схемы.
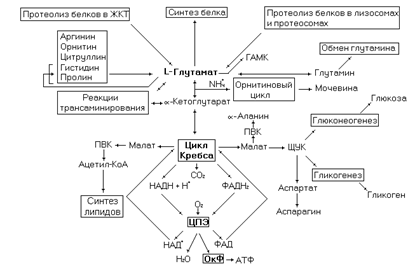
Рис. 25. Метаболические превращения глутамата.
Глутамат синтезируется в реакциях трансаминирования a-кетоглутарата с различными аминокислотами, через обращение глутаматдегидрогеназной реакции, при гидролитическом дезаминировании глутамина, в процессе распада белков и ряда аминокислот. Одно из основных направлений использования глутамата – синтез белка. В ряде белков остаток глутамата карбоксилируется с участием витамина К с образованием g-карбоксиглутамильного остатка, несущего два отрицательных заряда. В частности этот процесс осуществляется с рядом белков участвующих в свертывании крови. Недостаток в организме витамина или попадание в него его антивитамина (дикумарол) нарушает процесс карбоксилирования, а, следовательно, приводит к нарушению свертывания крови. g-Карбоксиглутамильный остаток может связывать ионы Са2+, что является необходимым для активирования некоторых факторов свертывания крови. Ряд белков осуществляющих минерализацию костей также карбоксилирован по остаткам глутамата.
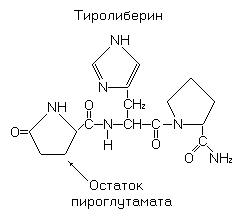
Ещё одной модификацией остатка глутамата в белках и пептидах является пироглутаминовая кислота. Она образуется за счет циклизации N-концевого остатка глутамата. В частности, остаток пироглутамата содержится на N-конце гормона тиролиберина (гормон гипоталамуса).
Остатки глутамата входят в состав каталитических участков активных центров ряда ферментов, обеспечивая кислотно-основной катализ. Наряду с радикалами аспартата, радикалы глутамата участвуют в формировании отрицательного заряда белка, в частности белков крови, где отрицательно заряженные радикалы количественно преобладают над положительно заряженными радикалами.
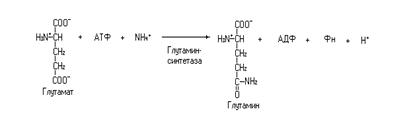
Из глутамата синтезируется его амид – глутамин в реакции катализируемой глутаминсинтетазой с участием АТФ и иона аммония.
Одной из важнейших реакций обмена аминокислот является реакция катализируемая глутаматдегидрогеназой.
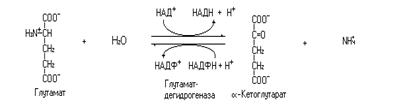
Это обратимая реакция, через неё аминный азот глутамата может поступить в синтез мочевины, а углеродный скелет аминокислоты на путь дальнейшего окисления до конечных продуктов. В прямой реакции в качестве кофермента участвует НАД+, а в обратной НАДФН, что дает возможность независимой регуляции прямой и обратной реакций. Образующийся в этой реакции a-кетоглутарат может участвовать в реакциях трансаминирования с аминокислотами выполняя функцию коллектора аминогрупп, как, например, в реакции катализируемой аспартатаминотрансферазой.

Кроме того, a-кетоглутарат может вступать на путь синтеза глюкозы и других соединений.
Через реакции трансаминирования с глутаматом идет взаимопревращение аминокислот, что позволяет обеспечивать потребности организма в недостающих ему заменимых аминокислотах, а также направлять углеродные скелеты аминокислот на путь катаболизма или синтеза небелковых продуктов. Реакции трансаминирования с глутаматом происходят в митохондриях и цитоплазме.
Глутамат участвует в работе аспартат-малатного челночного механизма транспорта протонов через митохондриальную мембрану, а также в синтезе биологически активного пептида – глутатиона. Синтез глутатиона осуществляется вне рибосомы. Для этого синтеза характерно образование необычной пептидной связи. Глутамат с цистеином взаимодействует через карбоксильную группу радикала, а не через карбоксил при a-углеродном атоме.
Глутамат – промежуточный продукт синтеза и распада пролина, катаболизма аргинина и гистидина.
Глутамат – нейромедиатор в головном мозге, кроме того, из этой аминокислоты в нейронах синтезируется ещё один нейромедиатор g-аминомасляная кислота (ГАМК) в метаболическом пути называемом ГАМК-шунт. Этот процесс интегрирует с циклом Кребса, как это представлено на схеме.

Рис. 26. Интеграция ГАМК-шунта с циклом Кребса (схема).
ГАМК – тормозной нейромедиатор, блокирующий возникновение потенциала действия на постсинаптической мембране.
Ресинтез глутамата из ГАМК осуществляется (в клетках нейроглии) через реакции его преобразования в сукцинат и последующих превращений в цикле Кребса.

Рис. 27. Образование и реутилизация ГАМК.
Катаболизм глутамата осуществляется через его превращение в a-кетоглутарат и последующего его окисления в цикле Кребса.
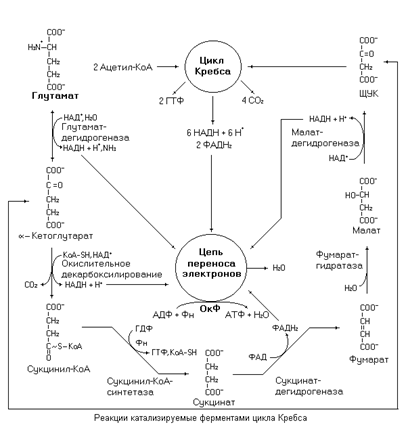
Рис. 28. Катаболизм глутамата.
Превращение глутамата в a-кетоглутарат может также идти через реакции трансаминирования. Щавелевоуксусная кислота (ЩУК) окисляется через два оборота цикла Кребса. Для полного окисления молекулы ЩУК необходимы две молекулы ацетил-КоА. Биоэнергетика окисления глутамата составляет 23,5 молекулы АТФ (с учетом затрат на нейтрализацию аммиака через орнитиновый цикл и использования глутаматдегидрогеназной реакции).
Задания к разделу «Обмен глутаминовой
Кислоты»
Задание 1
Назовите интермедиат цикла Кребса, через который в него поступает углеродный скелет глутамата. Метаболизируйте это соединение до метаболита транспортируемого из митохондрий в цитозоль (участвует далее в синтезе глюкозы).
Задание 2
Напишите реакцию карбоксилирования глутамата в белках.
1. Назовите витамин, участвующий в этой реакции.
2. Какая патология возникает при недостаточности в организме витамина участвующего в этой реакции?
Задание 3
Получите глутамат из другой протеиногенной аминокислоты в 1 реакцию. Объясните роль этой реакции в поддержании кислотно-основного равновесия в организме.
Задание 4
Напишите реакцию образования g-аминомасляной кислоты (ГАМК).
1. Назовите тип реакции и участвующие в ней фермент и кофермент.
2. Покажите связь между ГАМК шунтом и циклом Кребса.
Задание 5
Напишите реакции синтеза глюкозы из глутамата.
1. Сколько эквивалентов АТФ необходимо для этого синтеза?
2. Сколько молекул глутамата необходимо для синтеза 1 молекулы глюкозы?
Задание 6
Синтезируйте глутамат на основе углеродных атомов и аминогруппы a-аланина в 8 реакций. Все углеродные атомы и аминогруппа глутамата должны быть из молекулы a-аланина.
Обмен глутамина
Глутамин – заменимая, гликогенная аминокислота с гидрофильным радикалом.
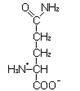 L-Глутамин
L-Глутамин
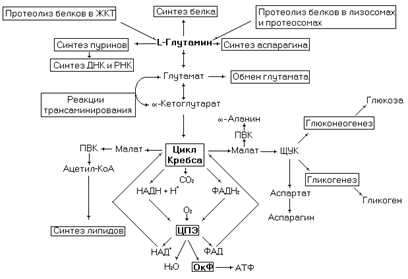
Рис. 29. Метаболические превращения глутамина.
Глутамин у человека синтезируется в реакции катализируемой глутаминсинтетазой из глутамата, а также образуется из белков при их гидролизе

Через синтез глутамина идет временная нейтрализация аммиака в нервной и других тканях, а также пополняется пул этой аминокислоты. Превращение глутамина в глутамат катализируется глутаминазой.
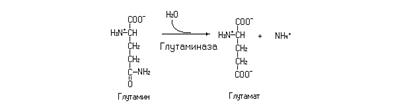
Реакция, катализируемая глутаминазой, наиболее активно протекает в печени и почках. В почках эта реакция способствует удалению аммиака с мочой в виде аммонийной соли, а также используется для удаления из организма избытка протонов. В печени аммиак, образующийся в глутаминазной реакции, вступает на путь синтеза мочевины.
Глутамин участвует в синтезе аспарагина.
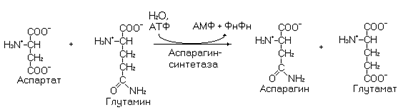
В синтезе пуриновых нуклеотидов используются два амидных азота глутамина, которые включаются в пуриновое ядро. Остатки глутамина и глутамата в белках могут взаимно превращаться, что, по-видимому, необходимо для регуляции активности некоторых белков.
Катаболизм глутамина идет через превращение в глутамат как это показано ниже.

Рис. 30. Катаболизм глутамина.
Образовавшийся из глутамина a-кетоглутарат окисляется через два с половиной оборота цикла Кребса. Биоэнергетика окисления глутамина составит 22 молекулы АТФ (с учетом нейтрализации 2 молекул аммиака в орнитиновом цикле).
Задания к разделу «Обмен глутамина»
Задание 1
В реакции катализируемой ферментом глутаминазой образуется аммиак.
1. Напишите реакцию катализируемую глутаминазой.
2. Напишите реакцию временного обезвреживания аммиака с участием НАДФН в качестве кофермента.
Задание 2
Напишите процесс катаболизма глутамина до СО2, Н2О и мочев<




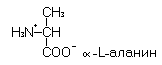



 Глицин
Глицин





 L-серин
L-серин




 L-треонин
L-треонин

 L-цистеин
L-цистеин


 L-Глутамат
L-Глутамат







 L-Глутамин
L-Глутамин







