Катаболизм протеиногенных аминокислот (20 аминокислот участвующих в биосинтезе белка) начинается, как правило, с утраты аминогрупп в реакциях дезаминирования или трансаминирования. Дезаминирование осуществляется в четырех вариантах: окислительное, восстановительное, гидролитическое и внутримолекулярное.
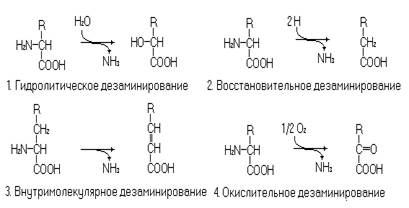
Рис. 3. Типы реакций дезаминирования.
Наиболее часто протекают реакции окислительного дезаминирования. В пероксисомах печени и почек имеются ферменты оксидазы L- и D-аминокислот. Оксидазы L-аминокислот катализируют реакцию.

Образовавшийся в реакции флавинмононуклеотид восстановленный (ФМНН2) вступает в реакцию с молекулярным кислородом с образованием перекиси водорода (Н2О2), которая разлагается на воду и молекулярный кислород в реакции, катализируемой каталазой. Оксидаза D-аминокислот в качестве кофермента содержит ФАД, а механизм её действия аналогичен действию оксидазы L-аминокислот.
К реакциям окислительного дезаминирования относится и реакция катализируемая глутаматдегидрогеназой.
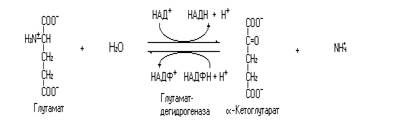
Это одна из важнейших реакций обмена аминокислот. Через эту реакцию аминогруппы аминокислот поступают в синтез мочевины, а за счет её обращения идет временная нейтрализация аммиака. Гистидин дезаминируется гистидазой (внутримолекулярное дезаминирование), а глутамин дезаминируется глутаминазой (гидролитическое дезаминирование).
Однако главенствующими для включения большинства аминокислот в катаболизм являются реакции трансаминирования. Реакции трансаминирования осуществляются аминотрансферазами – ферментами класса трансфераз, использующих в качестве кофермента производное витамина В6 – пиридоксальфосфат (ПФ). Трансаминазы присутствуют как в цитоплазме, так и митохондриях. Ферменты, расположенные в митохондриях отличаются по своим физико-химическим характеристикам от цитоплазматических.
Реакции трансаминирования обратимы, идут по механизму двойного замещения (см. тему «Ферменты» в учебнике). Наиболее высокая активность в тканях отмечена для аспартатаминотрансферазы и аланинаминотрансферазы. Определение активности этих ферментов в сыворотке крови диагностически ценно при инфаркте миокарда, гепатитах и ряде других заболеваний, сопровождающихся некрозом тканей. Как пример этих реакций можно рассмотреть аспартатаминотрансферазную реакцию.
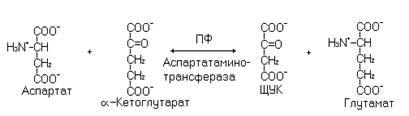
Суть реакции заключается в переносе аминогруппы от аминокислоты на кетокислоту с образованием новых аминокислоты и кетокислоты. Комплекс пиридоксальфосфат-фермент присоединяет аминокислоту по аминогруппе с образованием основания Шиффа 1, преобразующегося в основание Шиффа 2, при распаде которого образуется пиридоксамин-фермент и новая кетокислота. Далее аминогруппа от пиридоксамин-фермента переносится на изначально участвующую в реакции a-кетокислоту и образуется новая аминокислота. Наиболее часто используемыми в реакциях трансаминирования кетокислотами являются пируват, оксалоацетат, a-кетоглутарат. С a-кетоглутаратом трансаминируются такие аминокислоты как a-аланин, цистеин, тирозин, фенилаланин, аспартат, валин, лейцин, изолейцин.
Аспарагин и глутамин сначала дезаминируются по аминогруппе радикала (гидролитически) до аспарагиновой и глутаминовой кислот соответственно, и дальнейшему катаболизму подвергаются образовавшиеся аминокислоты.
Глицин превращается в серин, который дезаминируется с участием сериндегидратазы.
Аргинин, пролин и гистидин метаболизируют до глутамата, а далее могут подвергнуться окислительному дезаминированию или трансаминированию.
Дезаминирование аминокислот приводит к образованию токсического для клеток аммиака. Частично аммиак образуется в процессе гниения белков в толстом кишечнике, из которого он поступает в печень по воротной вене. Ещё одним источником аммиака в организме являются нуклеотиды, из которых он образуется при их деградации. В клетке аммиак подвергается протонированию с образованием иона аммония (при нейтральных значениях рН существующих в цитозоле).
NH3 + H+ ® NH4+
Ионы аммония, в отличие от аммиака, могут накапливаться в клетке. Накопление ионов аммония в клетке происходит в связи с плохой проницаемостью клеточных мембран для этих ионов. Токсичность аммиака для клеток (особенно чувствительны нейроны) определяется, по-видимому, несколькими причинами. Одна из них – участие аммиака в реакции катализируемой глутаматдегидрогеназой.

Высокая концентрация аммиака смещает равновесие реакции в сторону образования глутамата, обедняя при этом цикл Кребса a-кетоглутаровой кислотой. Это в конечном итоге снижает скорость не только цикла Кребса, но и скорость окисления глюкозы в целом, а, следовательно, образования АТФ. Энергетический голод в первую очередь сказывается на клетках нервной ткани – нейронах, в виду высокой потребности последних в энергии АТФ и зависимости от глюкозы как единственного энергетического субстрата (в норме). Кроме того, ионы аммония задерживают в клетке воду, что приводит к её набуханию. Набухание в свою очередь изменяет концентрацию метаболитов, нарушает регуляцию метаболизма, нарушает транспорт через клеточные мембраны и формирование потенциала действия и синаптической передачи.
Токсичность аммиака для клеток организма определяет потребность в его нейтрализации. Клетки разных тканей и органов решают эту проблему по разному. В большинстве органов осуществляется временная нейтрализация аммиака путем включения аммонийного азота в состав соединений нетоксичных для организма и последующей их передачи (через кровь) на пути окончательного обезвреживания, главным образом, синтеза мочевины в орнитиновом цикле. Окончательное обезвреживание осуществляется, главным образом в печени и в почках (95 и 3-4 % соответственно).
В головном мозге, для которого аммиак особенно токсичен (повышение концентрации аммиака свыше 0,6 ммоль вызывает судороги), обезвреживание осуществляется через включение его в состав a-кетоглутаровой кислоты (смотри выше). Из глутамата образуется глутамин в реакции катализируемой глутаминсинтетазой. Синтез глутамина осуществляется в митохондриях с использованием энергии гидролиза АТФ.
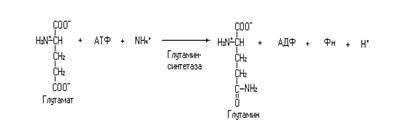
Глутамин из головного мозга поступает в кровь и доставляется в печень, почки и другие органы. В печени глутамин дезаминируется до глутамата, а далее до a-кетоглутарата.

Гидролитическое дезаминирование глутамина осуществляется с участием фермента глутаминазы, а окислительное дезаминирование глутамата в реакции катализируемой глутаматдегидрогеназой. Аммиак, образующийся в этих реакциях, участвует в синтезе мочевины в орнитиновом цикле.
Временное обезвреживание аммиака в мышцах осуществляется через глюкозо-аланиновый цикл.
Энергетические потребности мышц, главным образом, обеспечиваются окислением глюкозы (гликолиз) или гликогена (гликогенолиз). В аэробном варианте этих процессов конечным продуктом является пировиноградная кислота (пируват). С другой стороны, трансаминирование аминокислот с a-кетоглутаратом приводит к образованию глутаминовой кислоты (глутамата). В результате трансаминирования глутамата с пируватом (реакция катализируется аланинаминотрансферазой) образуется a-аланин, поступающий далее в кровь. С током крови a-аланин доставляется в печень, где трансаминируется с a-кетоглутаратом. Пируват, образующийся в этой реакции, идет в глюконеогенез и, в виде конечного продукта процесса – глюкозы, поступает в кровь, и, частично, возвращается в мышцы. Аминогруппа глутамата участвует в синтезе мочевины.
В почках аммиак, образованный при дезаминировании глутамина и/или глутамата, поступает в собирательные трубки, где

Рис. 4. Глюкозо-аланиновый цикл.
образует соли аммония, выводящиеся с мочой. Образование солей аммония в почках способствует также удалению избытка протонов, поддерживая тем самым кислотно-основное равновесие в организме. Ацидоз стимулирует образование глутаминазы в почке.
В клетках кишечника глутамин дезаминируется глутаминазой, а образовавшийся в этой реакции глутамат трансаминируется с пируватом, образуя a-кетоглутарат и a-аланин. Аланин и часть аммиака поступает по воротной вене в печень, а частично (5%) удаляется с фекалиями.
Временное обезвреживание аммиака в тканях может осуществляться за счет присоединения его к аспарагиновой кислоте. У человека и животных реакция катализируется аспарагинсинтетазой и идет с затратой энергии гидролиза АТФ. Источником аминогруппы для этой реакции является глутамин. Обезвреживание аммиака через синтез аспарагина энергетически менее выгодно, чем синтез глутамина, поэтому используется реже.

Вопросы к разделу
«Трансаминирование и дезаминирование аминокислот»
1. Напишите реакцию окислительного дезаминирования глутаминовой кислоты. Объясните роль этой реакции в обмене аминокислот.
2. Реакции трансаминирования, коллекторная функция a- кетоглутарата, механизм реакций. Медицинское значение определения активности трансаминаз.
3. Напишите аспартатаминотрансферазную реакцию. Назовите патологии, при которых активность аспартатаминотрансферазы в крови возрастает.
4. Напишите аланинаминотрансферазную реакцию. Назовите патологии, вызывающие повышение активности аланинаминотрансферазы в крови.
5. Причины токсичности аммиака для организма? Обезвреживание аммиака в нервной ткани.
6. Обезвреживание аммиака в мышцах – глюкозо-аланиновый цикл.
7. Особенности обезвреживания аммиака в почке.















