Закрепление
- Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
этан → этилен → этиловый спирт → уксусный альдегид → уксусная кислота → хлоруксусная кислота → аминоуксусная кислота → полипептид.
- Вычислите массу соли, которую можно получить при взаимодействии 150 г 5% -го раствора амииоуксусной кислоты с необходимым количеством гидроксида натрия. Сколько граммов 12%-го раствора щелочи потребуется для реакции?
посмотрите видеоурок https://www.youtube.com/watch?v=sjvYvmJmdcE
Аминокислота – это азотсодержащее органическое соединение, в составе которой есть как аминогруппа, так и карбоксильная группа.
Белки – органические полимеры, в состав которых входят остатки аминокислот, соединённые пептидной связью. Количество аминокислотных остатков в белках обычно более 50.
Биуретовая реакция – качественная цветная реакция на пептидные связи. При добавлении к белку раствора щёлочи и сульфата меди (II) раствор приобретает красно-фиолетовую окраску.
Гидролиз белка – распад белка на отдельные аминокислоты в водном растворе кислот или щелочей.
Денатурация белка – разрушение вторичной, третичной и четвертичной структуры белка при нагревании, действии растворов солей тяжёлых металлов, кислот и щелочей. При денатурации белок сворачивается и выпадает в осадок.
Ксантопротеиновая реакция – качественная цветная реакция концентрированной азотной кислоты с белками, содержащими остатки ароматических аминокислот. При добавлении концентрированной азотной кислоты к белку и нагревании сначала происходит денатурация белка, а затем появляется жёлтое окрашивание.
Олигопептиды – органические соединения, состоящие из 10–20 остатков аминокислот, связанных пептидными связями.
Пептидная группа – группа атомов в составе пептидов, состоящая из атомов углерода, кислорода, азота и водорода.
Пептидная связь – связь между атомами углерода и азота в пептидной группе.
Пептиды – органические соединения, состоящие из нескольких аминокислотных остатков, соединённых пептидной связью.
Полипептиды – макромолекулы, состоящие из 20–50 аминокислотных остатков, соединенных пептидной связью.
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Аминокислоты – это азотсодержащие органические соединения, в состав которых входят как аминогруппа, так и карбоксильная группа
Простейшим представителем аминокислот является глицин – аминоуксусная (аминоэтановая) кислота
По международной номенклатуре нумерация углеродных атомов начинается от углерода карбоксильной группы.
Достаточно часто в литературе можно встретить обозначения углеродных атомов в аминокислотах с помощью букв греческого алфавита. При этом атом углерода карбонильной группы не имеет обозначения.
Для некоторых аминокислот существуют тривиальные названия.
Изомеры аминокислот различаются строением углеводородного радикала и положением аминогруппы.
Все α-аминокислоты, кроме глицина, имеют в своем составе асимметрический атом, который следует сразу за карбоксильной группой. У этого атома углерода все заместители разные.
Благодаря этому атому, для α-аминокислот характерна оптическая изомерия. В природе распространены только L-α-аминокислоты.
Биологическое значение аминокислот
Из аминокислот наибольшее значение имеют α-аминокислоты, так как они входят в состав белковых молекул, из которых построено всё живое вещество.
Растения и бактерии способны самостоятельно синтезировать все необходимые для них аминокислоты. Млекопитающие, в том числе и человек, не могут синтезировать ряд аминокислот, они должны поступать в организм с пищей. К таким незаменимым аминокислотам относятся метионин, треонин, фенилаланин, лейцин, изолейцин, валин, лизин, триптофан.
α-Аминокислоты необходимы человеку для образования белков. Большую часть аминокислот для этих целей человек получает с пищей. Некоторые аминокислоты можно синтезировать. Для регулирования обменных процессов аминокислоты применяются как лекарства (например, глицин).
Получение аминокислот
В промышленности α-аминокислоты получают гидролизом белков.
Можно синтезировать аминокислоты из хлорпроизводных карбоновых кислот и аммиака.
Cl-CH2-COOH + 2NH3 → NH2-CH2-COOH + NH4Cl
Пептиды
Аминокислоты могут реагировать друг с другом, аминогруппа одной кислоты соединяется с карбоксильной группой другой кислоты, при этом происходит выделение воды.
Группа атомов СО-NH называется пептидной (или амидной) группой, а связь между атомами углерода и азота – пептидной (амидной) связью.
Соединения, образованные из нескольких аминокислот с помощью пептидной связи, называются пептидами.
Называют пептиды перечислением тривиальных названий аминокислот, входящих в состав пептида, начиная с аминокислотного остатка со свободной аминогруппой (N-конец), заменяя в названии аминокислот окончание «ин» на «ил». Последней называют аминокислоту со свободной карбоксильной группой (С-конец), её название не изменяется. Часто название пептида записывают с помощью трёхбуквенных латинских сокращённых наименований аминокислот.
Молекулы, в состав которых входит 10–20 остатков аминокислот, называют олигопептидами.
Макромолекулы, образованные 20–50 остатками аминокислот называют полипептидами.
Полипептиды входят в состав многих гормонов. Нейропептиды регулируют работу мозга, процессы сна, обучения, обладают обезболивающим эффектом.
Белки
Полипептиды, содержащие в своём составе более 50 остатков аминокислот, называются белками. Это природные полимеры, которые образуют клетки всех живых организмов. Без белков невозможны обмен веществ, размножение и рост живых организмов.
Белки образованы атомами углерода, водорода, кислорода и азота. Кроме этих атомов, макромолекулы белков могут содержать атомы фосфора, серы, железа и других элементов.
Относительная молекулярная масса белковых молекул может быть от нескольких десятков до сотен атомных единиц массы.
Структура белков
Последовательность остатков аминокислот в молекуле белка образует первичную структуру белка.
Между атомом кислорода в группе С=О и атомом водорода в амидной группе – NH – образуется водородная связь, в результате чего макромолекула белка закручивается в спираль. Образуется вторичная структура белка.
Функциональные группы, расположенные на внешней стороне спирали, могут взаимодействовать с другими функциональными группами этой же макромолекулы. Например, между атомами серы образуется сульфидный мостик, между карбоксильной и гидроксильной группами возникает сложноэфирный мостик.
В результате образуется третичная структура белка, которая определяет специфическую биологическую активность белков. Именно благодаря уникальной третичной структуре биологические катализаторы – ферменты обладают уникальной избирательностью.
Благодаря различным функциональным группам белковые молекулы могут соединяться друг с другом, в результате формируется четвертичная структура белка.
Химические свойства белков
В зависимости от молекулярной массы и функциональных групп белки могут как хорошо растворяться в воде, так и не растворяться в ней.
Под действием температуры, растворов солей тяжёлых металлов, кислот и щелочей происходит разрушение вторичной, третичной и четвертичной структуры белка, называемое денатурацией.
При нагревании в присутствии кислоты или щёлочи белки подвергаются гидролизу, распадаясь на исходные аминокислоты.
Белки в щелочной среде в присутствии сульфата меди (II) окрашивают раствор в красно-фиолетовый цвет. Это реакция на пептидную группу (биуретовая реакция).
Концентрированная азотная кислота при нагревании окрашивает белки в жёлтый цвет, если в состав белка входят остатки ароматических аминокислот, например, фенилаланина (ксантопротеиновая реакция).
Для обнаружения в составе белка атомов серы проводят реакцию с ацетатом свинца в щелочной среде при нагревании. В результате образуется чёрный осадок (цистеиновая реакция).
Основными структурными компонентами белков являются аминокислоты.
СН3— CH(NH2)— СООН Ala или Ала Алании
(СН3)2СН—CH(NH2>— СООН Val или Вал Валин*
(СН3)2СН—СН2— CH(NH2)—СООН Leu или Лей Лейцин*
СбН5—СН2—CH(NH2)—СООН Phe или Фен Фенилаланин*
НО—СН2—CH(NH2)— СООН Ser или Сер Серии
HS—CH2— CH(NH2)—СООН Cys или Цис Цистеин*
НООС—СН2— CH(NH2)— СООН Asp или Асп Аспарагинова
H2N—CO—CH2—CH(NH2)—СООН Asn или Асн Аспарагин
НООС—СН2—СН2—CH(NH2)—СООН Glu или Глу Глутаминовая кислота
H2N—CO—CH2—CH2—CH(NH2)—СООН Gin или Глн Глутамин
H2N—(CH2)4— CH(NH2)—СООН Lys или Лиз Лизин*
СН3— СН(ОН)— CH(NH2)— СООН Thr или Тре Треонин*
* Звездочками обозначены названия незаменимых аминокислот.
Остатки аминокислот соединены в белковых молекулах пептидными или амидными связями. На слайде приведены их тривиальные названия и показано химическое строение некоторых из них. В начале XX века Э. Фишеру удалось синтезировать соединение, в которое входило 18 остатков различных аминокислот, соединѐнных пептидными связями. Эти полипептиды напоминали белки. Отечественный основоположник теории строения белковых молекул - Александр Яковлевич Данилевский. В1888г. он указал на наличие пептидных групп в белковых молекулах. Экспериментально доказал, что под воздействием сока поджелудочной железы белки подвергаются гидролизу.
Последовательность чередования аминокислот очень строгая и замена хотя бы одной аминокислоты приводит к изменению свойств белка, а в некоторых случаях происходит потеря их биологических свойств. Поэтому, искусственно синтезированные полипептидные цепочки зачастую не обладают природными биологическими свойствами. Например, такое заболевание как серповидноклеточная анемия (демонстрация рисунка) связано с изменением формы эритроцита и невозможностью нормального транспорта кислорода. Причина же – одна единственная ошибка, когда из 146 аминокислотных фрагментов этого белка один – глутаминовая кислота заменяется на другой – валин. Многообразие белков можно объяснить практически безграничными возможностями перестановок остатков аминокислот относительно друг друга. (Демонстрация бумажной модели и нитки бус, состоящей из разных
Аналогично и в молекулах белков порядок чередования остатков аминокислот в полипептидной цепи определяет структуру белка. Эту структуру называют первичной.
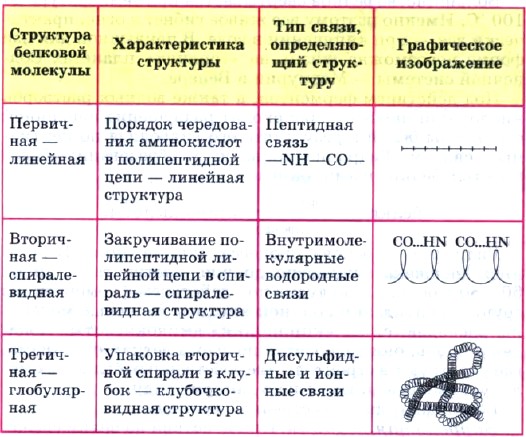
Помимо первичной структуры, белковые молекулы имеют вторичную и третичную структуры, характеристика которых дана в таблице 4.
Первичная структура - последовательность чередования аминокислотных остатков
(связи пептидные) (линейная цепь)
Вторичная структура белка- форма полипептидной цепи в пространстве. Белковая цепь закручена в спираль (за счет множества водородных связей) (спираль
Третичную структуру белка - реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль (за счет гидрофобных связей), у некоторых белков – S–S-связи (бисульфидные связи) (клубок),определяют следующие типы связи: – водородные связи; – ионное связывание; – дисульфидные мостики –S-S–
Четвертичная структура – соединенные друг с другом макромолекулы белков образуют комплекс. (Несколько цепей)
Из биологии: Ребята! У каждого из вас свой тип волос: у кого-то прямые, у кого-то вьющиеся. В чем же причина? Оказывается, виной всему являются дисульфидные мостики. На разрушении и образовании новых дисульфидных мостиков основана химическая завивка. Исходные дисульфидные мостики разрушаются при помощи пероксида водорода. Вот почему частое обесцвечивание волос и химическая завивка меняют структуру волос.
Большая заслуга в расшифровке структур белковых молекул принадлежит немецкому химику-органику Э. Г. Фишеру и русскому биохимику А. Я. Данилевскому.
Таблица 4
Характеристика трех структур белковых молекул
Запишите уравнение синтеза трипептида: гли – цис – вал..
Функции белков
1. Ферментативная или каталитическая функция. Ферменты - биологические катализаторы химических реакций организма. Более 2000 ферментов, обладающих уникальной активностью и селективностью (каталаза, амилаза). 2. Транспортная функция. Перенос молекул или ионов по тканям и органам. Например, гемоглобин крови, который обеспечивает перенос кислорода и углекислого газа. 3. Структурная функция. Белки - строительный материал почти всех тканей: мышечных, опорных, покровных. Белки — элементы плазматической мембраны, хрящей, костей, перьев, ногтей, волос, всех тканей и органов (коллаген, фибрин ). 4. Сократительная функция. Актин и миозин — белки, входящие в состав мышечных волокон и обеспечивающие их сокращение вследствие способности молекул этих белков к денатурации. 5. Двигательная функция. Передвижение ряда одноклеточных организмов, а также сперматозоидов при помощи ресничек и жгутиков, в состав которых входят белки. 6. Защитная функция. Белки – антитела. (Своеобразные «наручники» для проникающих в клетку «преступников» - бактерий, т.к. эти белки склеивают бактерии). И антитоксины (белки, нейтрализующие яды, образующиеся в результате жизнедеятельности бактерии). Антитела, фибриноген, тромбин — белки, участвующие в выработке иммунитета и свертывании крови (иммуноглобулины, интерферон).
7. Сигнальная функция. Белки – рецепторы воспринимают и передают сигналы, поступающие из соседних клеток или окружающей среды. Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином. 8. Запасающая или энергетическая функция. Белки семян бобовых растений и яйцеклеток животных организмов. Эти особые белки служат строительным материалам и обеспечивают энергией развитие новых организмов. Энергетическая ценность других белков невелика и уступает жирам и углеводам (альбумин ).
9. Регуляторная функция. Гормоны — вещества, обеспечивающие наряду с нервной системой гуморальную регуляцию функций организма. Например, роль гормона инсулина в регуляции содержания сахара в крови.
Учитель: И так делаем выводы о значении белкового питания. Выводы:
1 Физиологическая роль белков велика, поэтому они являются необходимой составной частью пищи. 2 Недостаток белка в пище вызывает тяжѐлые заболевания. Результат несбалансированного питания – плохое самочувствие, истощение, быстрая утомляемость. 3 Белки могут превращаться в жиры и углеводы, но те в свою очередь не могут. Поэтому белковое голодание особенно опасно для живого организма. Учитель биологии: Следует помнить, что продукты питания имеют разную химическую и биологическую ценность
Рассмотрим биологическое значение белков. или
Ферментативная функция. Большинство химических реакций в организме протекают в присутствии биологических катализаторов — ферментов, имеющих белковую природу. По сравнению с химическими катализаторами ферменты обладают уникальной активностью (увеличивают скорости реакций в миллиарды раз) и селективностью (каждый фермент катализирует одну реакцию или один тип превращений). В организме человека обнаружено более 2000 ферментов. Этим биологически активным веществам будет посвящен отдельный параграф учебника.
Транспортная функция. Белковые молекулы осуществляют перенос других молекул или ионов по тканям и органам. Важнейшим транспортным белком является гемоглобин крови, который переносит кислород.
Структурная функция. Белки — это строительный материал почти всех тканей: мышечных, опорных, покровных.
Защитная функция. Особые белки — антитела (своеобразные «наручники» для проникающих в клетку «преступников»-бактерий, так как эти белки склеивают бактерии) и антитоксины (белки, которые нейтрализуют яды, образующиеся в результате жизнедеятельности бактерий) определяют такое защитное свойство организмов, как иммунитет.
Сигнальная функция. Белки-рецепторы воспринимают и передают сигналы, поступившие от соседних клеток или окружающей среды. Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином, имеющим белковую природу.
Запасающая, или энергетическая, функция. Эту функцию в клетках живых организмов выполняют особые белки, например белки семян бобовых растений и яйцеклетки животных организмов. Они служат строительным материалом и обеспечивают энергией развитие новых организмов.
Рассмотрим химические свойства белков.
Большинство белков свертывается при температуре до 100.Именно поэтому все живое гибнет в огне, практически все — при кипячении в воде. В привычной для нас форме невозможна жизнь на «горячих» планетах Солнечной системы — Меркурии и Венере.
Под действием ферментов, а также водных растворов кислот или щелочей происходит разрушение первичной структуры белка в результате его гидролиза по пептидным связям. Гидролиз приводит к образованию более простых белков и аминокислот.
1. Гидролиз белков Гидролиз белков сводится к расщеплению полипептидных связей:
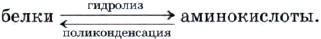
Гидролиз — основа процесса пищеварения. В организм человека ежедневно должно поступать с пищей 60—80 г белка. В желудке под действием ферментов (из группы пептидаз) и соляной кислоты белковые молекулы распадаются на «кирпичики»-аминокислоты. Попадая в кровь, они разносятся по всем клеткам организма, где участвуют в строительстве собственных белковых молекул, свойственных только данному виду.
2. Денатурация белков
Денатурация – нарушение природной структуры белка под действием нагревания и химических реагентов. а) высокая или низкая температура б) механическое воздействие; в) облучение; г) яды; д) действие спирта; б) действие солей тяжелых металлов (Pb, Hg и др.)
При нагревании, под действием сильных кислот или оснований, солей тяжелых металлов и некоторых других реагентов происходит необратимое осаждение (свертывание) белков, называемое денатурацией. Легкость денатурации многих белков очень затрудняет их изучение. При денатурации происходят изменения во вторичной и третичной структурах белка, а первичная структура сохраняется. При этом их биологические функции полностью теряются.
Денатурация имеет не только отрицательные стороны. Вспомните хотя бы сваренные вкрутую яйца (свертывание белка). Похожим образом сворачивается белок молока — казеин (так получают творог, богатый белком пищевой продукт).
Цветные качественные реакции белков а) Биуретовая реакция (Cu(OH)2); б) ксантопротеиновая реакция (HNO3 конц.); в) взаимодействие белка с ацетатом свинца при нагревании. г) горение белка
Белки дают две качественные реакции.
Биуретовая реакция. При действии на белки свеже-полученного осадка гидроксида меди (II) в щелочной среде возникает фиолетовое окрашивание (рис. 77).
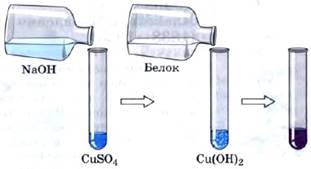
Рис. 77.Биуретовая реакция
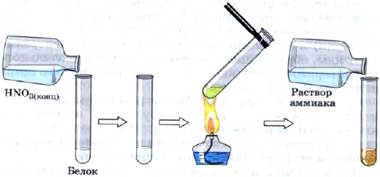
Ксантопротеиновая реакция. При действии на белки концентрированной азотной кислотой образуется белый осадок, который при нагревании желтеет, а при добавлении водного раствора аммиака становится оранжевым (рис. 78). Рис. 78.Ксантопротеиновая реакция
Качественное определение серы в белках. При горении белков ощущается характерный запах «жженого рога». В этом легко убедиться, если поджечь шерстяную нитку или пучок волос. В значительной степени этот запах определяется содержанием в белках серы.
Белки могут превращаться в жиры и углеводы, но те, в свою очередь, превращаться в белки не могут (подумайте почему). Поэтому белковое голодание особенно опасно для живого организма.
Поскольку физиологическая роль белков столь велика, они являются необходимой составной частью пищи.
При переваривании в желудочно-кишечном тракте органических соединений, входящих в состав пищевых продуктов, выделяется энергия. Энергетическая ценность белковой пищи невелика и уступает жирам и углеводам. Однако белки единственный источник незаменимых аминокислот в организме.
Недостаток белка в пище вызывает тяжелые заболевания. Результат несбалансированного питания — плохое самочувствие, истощение, быстрая утомляемость. Самые лучшие сорта пшеницы, и новые, которыми гордятся наши селекционеры, и старые, создавшие славу русскому хлебу, отличаются как раз высоким содержанием и уникальным составом белков.
Наиболее богаты белком мясо, рыба, молочные продукты, яйца и некоторые зернобобовые продукты.
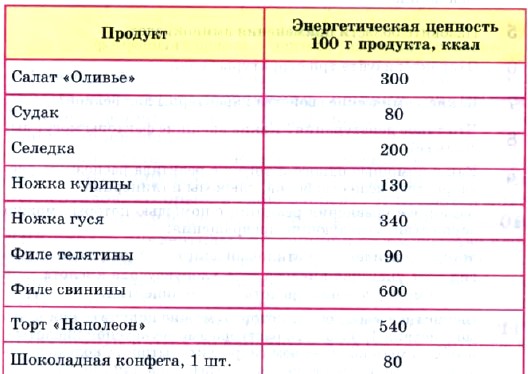
В сутки человеку необходимо потреблять такое количество пищи, которое дает 1500—2000 килокалорий энергии. В настоящее время контроль за этой цифрой установили для себя многие: спортсмены, артисты, модницы, люди, страдающие различными заболеваниями или избыточным весом. Поэтому на этикетках пищевых продуктов часто указана их энергетическая ценность, А если это продукты без упаковки? Или наши кулинарные способности позволяют приготовить из набора продуктов новое блюдо? Существует несметное число таблиц и памяток, позволяющих рассчитать число «съеденных» калорий. Краткая выдержка из них представлена в таблице 5.
Учитель: И так делаем выводы о значении белкового питания. Выводы:
1 Физиологическая роль белков велика, поэтому они являются необходимой составной частью пищи. 2 Недостаток белка в пище вызывает тяжѐлые заболевания. Результат несбалансированного питания – плохое самочувствие, истощение, быстрая утомляемость. 3 Белки могут превращаться в жиры и углеводы, но те в свою очередь не могут. Поэтому белковое голодание особенно опасно для живого организма. Из биологии следует помнить, что продукты питания имеют разную химическую и биологическую ценность
Таблица 5
Энергетическая ценность некоторых продуктов
Большая часть полученной энергии расходуется на совершение работы, остальная часть — на протекание эндотермических реакций в организме и поддержание температуры тела. Около 55 ккал в час расходуется, когда мы спим, 75 — когда сидим, 200 — когда ходим, 500 — когда поднимаемся или спускаемся по лестнице Мы уже говорили о том, что белки в живом организме «собираются» из аминокислот. «Инструкция по сборке» зашифрована еще в одном виде природных биополимеров — молекулах ДНК, о которых и пойдет речь в следующем параграфе.
Значение белков( в виде схемы) Отдельные белки находят применение в народном хозяйстве, например белки шерсти, шелка, кожи и рогов животных. Выяснение структуры белков, их многообразных функций в организме позволяет понять механизм наследственности, что в свою очередь, имеет большое значение для выведения высокопродуктивных пород животных и сортов растений. Изучение белков важно и для выяснения природы заболеваний, наблюдаемых у человека и животных
Закрепление
- Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
этан → этилен → этиловый спирт → уксусный альдегид → уксусная кислота → хлоруксусная кислота → аминоуксусная кислота → полипептид.
- Вычислите массу соли, которую можно получить при взаимодействии 150 г 5% -го раствора амииоуксусной кислоты с необходимым количеством гидроксида натрия. Сколько граммов 12%-го раствора щелочи потребуется для реакции?
посмотрите видеоурок https://www.youtube.com/watch?v=sjvYvmJmdcE
Аминокислота – это азотсодержащее органическое соединение, в составе которой есть как аминогруппа, так и карбоксильная группа.
Белки – органические полимеры, в состав которых входят остатки аминокислот, соединённые пептидной связью. Количество аминокислотных остатков в белках обычно более 50.
Биуретовая реакция – качественная цветная реакция на пептидные связи. При добавлении к белку раствора щёлочи и сульфата меди (II) раствор приобретает красно-фиолетовую окраску.
Гидролиз белка – распад белка на отдельные аминокислоты в водном растворе кислот или щелочей.
Денатурация белка – разрушение вторичной, третичной и четвертичной структуры белка при нагревании, действии растворов солей тяжёлых металлов, кислот и щелочей. При денатурации белок сворачивается и выпадает в осадок.
Ксантопротеиновая реакция – качественная цветная реакция концентрированной азотной кислоты с белками, содержащими остатки ароматических аминокислот. При добавлении концентрированной азотной кислоты к белку и нагревании сначала происходит денатурация белка, а затем появляется жёлтое окрашивание.
Олигопептиды – органические соединения, состоящие из 10–20 остатков аминокислот, связанных пептидными связями.
Пептидная группа – группа атомов в составе пептидов, состоящая из атомов углерода, кислорода, азота и водорода.
Пептидная связь – связь между атомами углерода и азота в пептидной группе.
Пептиды – органические соединения, состоящие из нескольких аминокислотных остатков, соединённых пептидной связью.
Полипептиды – макромолекулы, состоящие из 20–50 аминокислотных остатков, соединенных пептидной связью.
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Аминокислоты – это азотсодержащие органические соединения, в состав которых входят как аминогруппа, так и карбоксильная группа
Простейшим представителем аминокислот является глицин – аминоуксусная (аминоэтановая) кислота
По международной номенклатуре нумерация углеродных атомов начинается от углерода карбоксильной группы.
Достаточно часто в литературе можно встретить обозначения углеродных атомов в аминокислотах с помощью букв греческого алфавита. При этом атом углерода карбонильной группы не имеет обозначения.
Для некоторых аминокислот существуют тривиальные названия.
Изомеры аминокислот различаются строением углеводородного радикала и положением аминогруппы.
Все α-аминокислоты, кроме глицина, имеют в своем составе асимметрический атом, который следует сразу за карбоксильной группой. У этого атома углерода все заместители разные.
Благодаря этому атому, для α-аминокислот характерна оптическая изомерия. В природе распространены только L-α-аминокислоты.











