Запишем предполагаемые уравнения последовательных электрохимических реакций
Ме ⇄ Ме+ + е (24)
Ме+ ® Ме2+ + е. (25)
Такой механизм может иметь место в том случае, если i0,1 >> i0,2.
(i0,i - ток обмена соответствующей стадии). В этом случае первая стадия является быстрой по отношению ко второй и, благодаря наличию последующей медленной реакции, равновесной или точнее квазиравновесной, что находит отражение в записи уравнения реакции. Это значит, что в исследуемой области потенциалов вблизи поверхности электрода величина СМе+ является близкой к равновесной.
Одновременно подобная запись уравнений (24) и (25) указывает, что продукты реакции и частицы рабочего раствора не адсорбируются на поверхности электрода и не принимают участия в реакции ионизации металла. Такие условия, в частности, реализуются при анодном растворении меди в кислых перхлоратных растворах, в которых и было показано наличие для нее такого механизма (В.В.Лосев, А.И.Молодов).
Получим для этого механизма процесса кинетическое уравнение. С этой целью для второй лимитирующей скорость процесса стадии запишем кинетическое уравнение:
i25 = k25 СМе+ е 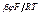 .
.
Концентрацию однозарядных ионов меди (СМе+), выступающих в роли промежуточного продукта и часто называемых низковалентными частицами (НВЧ), можно выразить из первого уравнения. Так как первая стадия (уравнение (24)) является электрохимической (наличие переноса заряда через границу раздела фаз) и квазиравновесной, то для нее справедливо уравнение Нернста (n = 1):
φ 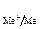 = φ
= φ  +
+  ln СМе+ (26)
ln СМе+ (26)
При дальнейшем рассмотрении индексы при φ опущены. Решим уравнение в явном виде относительно СМе+:
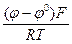 lnСМе+; СМе+ = е
lnСМе+; СМе+ = е 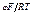 е
е 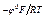 .
.
Примем
е 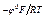 = k1
= k1
Тогда получим
СМе+ = k1 е 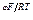 .
.
Подставим последнее уравнение в кинетическое уравнение лимитирующей стадии:
i25 = k25 k1 е φF/RT е bφF/RT;
i25 = k е φF(1 + b)/RT = k ехр[(φF(1 + b)/RT].
Тафелевский наклон анодной поляризационной кривой в этом случае равен
bа = (2,3RT)/(1 + b)F.
Приняв β = 0,5, получим:
bа = 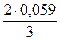 = 0,040 В.
= 0,040 В.
Легко видеть, что по сравнению с предыдущим случаем (bа = 0,060 В) меняется величина bа и эти случаи легко различимы. Если в подобном процессе лимитирует стадия (24), то кинетическое уравнение принимает вид
iа = k е bφF/RT = k ехр(bφF/RT),
что также легко дифференцируется (рис. 11), т.к. при b = 0,5
bа = 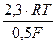 = 0,116 В
= 0,116 В

Рис. 11. Тафелевы участки анодных поляризационных кривых, характеризующиеся различными величинами тангенса угла наклона к оси абсцисс. bа, мВ: 1 – 40; 2 – 60; 3 – 120.
Если процесс ионизации металла протекает через три последовательные одноэлектронные стадии без участия частиц раствора и последняя стадия является лимитирующей, то механизм ионизации можно записать следующим образом:
Ме «Ме+ + е; (27)
Ме+ «Ме2+ + е; (28)
Ме2+ «Ме3++ е. (29)
Получим кинетическое уравнение этого процесса. Для лимитирующей стадии (29) имеем:
i29 = k29 Cме2+ е bFφ/RT.
Для второй квазиравновесной стадии действительно уравнение Нернста:
φ 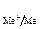 = φ
= φ 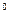 +
+ 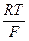 ln
ln  ;
;
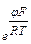 ×
× 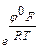 =
=  ;
;
откуда имеем:
Cме2+ = k28 Cме+ е Fφ/RT
Найдем величину Cме+. Для этого используем квазиравновесие первой стадии. Для нее также справедливо уравнение Нернста:
φ 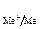 = φ
= φ  +
+ 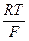 ln СМе+
ln СМе+
Откуда
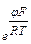 ×
× 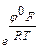 = СМе+; СМе+ = k27 е φF/RT
= СМе+; СМе+ = k27 е φF/RT
Подставим последнее выражение в концентрационную зависимость, полученную за счет квазиравновесия стадии (28):
СМе2+ = k28 k27 е φF/RT е φF/RT = k’ е 2φF/RT
И, наконец, величину СМе2+ подставим в кинетическое уравнение лимитирующей стадии:
i29 = k29 k’Cме2+ е 2φF/RT е bFφ/RT и окончательно
i = k exp[(2+β)φF/RT], a
bа = 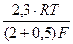 = 0,024 В
= 0,024 В
где 2 - число предшествующих лимитирующей одноэлектронных квазиравновесных стадий. В общем случае для т предшествующих квазиравновесных стадий кинетическое уравнение имеет вид:
i29 = k е φF(m+b)/RT
Величина m+b называется кажущимся коэффициентом переноса, а тафелевский наклон при b = 0,5 определяется зависимостью:
bа = 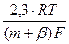 =
= 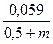 В
В



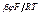 .
.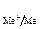 = φ
= φ  +
+  ln СМе+ (26)
ln СМе+ (26)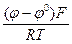 lnСМе+; СМе+ = е
lnСМе+; СМе+ = е 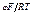 е
е 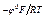 .
.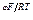 .
.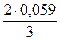 = 0,040 В.
= 0,040 В.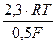 = 0,116 В
= 0,116 В
 +
+ 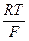 ln
ln  ;
;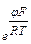 ×
× 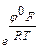 =
= 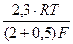 = 0,024 В
= 0,024 В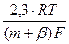 =
= 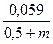 В
В


