

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
Топ:
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Глава 13
| СПИРТЫ |
Спиртами называются соединения, которые содержат одну или несколько гидроксильных групп у атомов углерода, находящихся в sp 3 -гибридизации. Гидроксильная группа (ОН) является функциональной группой и определяет свойства, характерные для данного класса соединений. Количество гидроксильных групп определяет атомность спиртов. Строение радикала влияет на скорость, с которой спирт вступает в некоторые реакции, а иногда и на характер реакции.
13.1. Классификация, номенклатура и Строение спиртов
Классификация спиртов
| По природе радикала | ||||
| насыщенные спирты | ненасыщенные спирты | ароматические спирты | ||
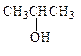 пропанол-2
изопропиловый спирт
пропанол-2
изопропиловый спирт
|
CH2=CHCH2ОН пропен-2-ол
аллиловый спирт |  бензиловый спирт
бензиловый спирт
| ||
| По количеству гидроксильных групп | ||||
| одноатомные спирты | двухатомные спирты | трех- и многоатомные спирты | ||
|
CH3CH2ОН
этанол
этиловый спирт | НОCH2CH2ОН этиленгликоль |
глицерин | ||
| По природе атома углерода с гидроксильной группой | ||||
| первичные спирты | вторичные спирты | третичные спирты | ||
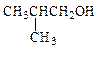 2-метилпропанол-1
изобутиловый спирт
2-метилпропанол-1
изобутиловый спирт
|
бутанол-2
втор-бутиловый спирт |  2-метилпропанол-2
трет-бутиловый спирт
2-метилпропанол-2
трет-бутиловый спирт
| ||
Номенклатура спиртов
· Тривиальная номенклатура. Для ряда простых спиртов иногда используют тривиальные названия: СН3ОН – древесный спирт, С2Н5ОН – винный спирт, С5Н11ОН – амиловый спирт, С16Н33ОН – цетиловый спирт и т. д.
· Рациональнаяноменклатура. В этой устаревшей номенклатуре в качестве основы используется родоначальник гомологического ряда – спирт СН3ОН, который называют карбинолом. Более сложные спирты рассматриваются как продукты замещения одного или нескольких атомов водорода в метильном радикале этого спирта. Например:
|
|

| триэтилкарбинол | втор -бутилкарбинол |
В настоящее время эта номенклатура не рекомендуется для употребления.
v Номенклатура ИЮПАК.
· Заместительная номенклатура. Гидроксильная группа в заместительной номенклатуре обозначается суффиксом -ол, если она является главной группой, и префиксом гидрокси-, если эта функциональная группа находится в боковой цепи или в соединении есть более старшая группа.
§ Гликоли и многоатомные спирты. При наличии двух и более гидроксильных групп за основу выбирается самая длинная цепь, содержащая максимальное количество гидроксилов, а в названии этих соединений перед суффиксом –ол добавляют числовой префикс ди -, три - и т. д.
 4-бром-2-метилциклогексанол
4-бром-2-метилциклогексанол
| 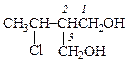 2-(1-хлорэтил)пропандиол-1,3
2-(1-хлорэтил)пропандиол-1,3
|
| Нумерация от гидроксильной группы (старшая функциональная группа) в направлении ближайшего заместителя. | За основу берется цепь с максимальным количеством гидроксильных групп. |
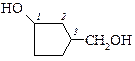 3-гидроксиметициклопентанол
3-гидроксиметициклопентанол
| 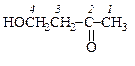 4-гидроксибутанон-2
4-гидроксибутанон-2
|
| За основу берется пятичленный цикл. Гидроксильная группа в боковой цепи называется с помощью префекса гидрокси-. | Старшая функциональная группа – кетон, она и определяет нумерацию соединения. |
§ Недопустимы названия изопропанол и ему подобные, так как не существует углеводорода изопропан. Следует называть это соединение пропанол-2 или по радикально-функциональной номенклатуре – изопропиловый спирт.
· Радикально-функциональная номенклатура. Большое количество традиционных названий спиртов построено по принципам радикально-функциональной номенклатуры (в некоторых пособиях такие названия неправильно относят к так называемой “спиртовой номенклатуре”). Название спиртов состоит из названия радикала и названия функции – спирт. Примеры таких названий приведены курсивом в разделе “Классификация”.
|
|
В этой номенклатуре положение заместителя в алкильной группе спирта можно обозначить не только цифрой, но и буквой греческого алфавита. Греческая буква ω указывает на наличие заместителя на самом удаленном по отношению к функциональной группе атоме углерода.
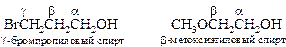
§ Двухатомные спирты. Название этих соединений составляют из названий двухвалентных углеводородных радикалов с добавлением названия функции - гликоль. Например, НО(СН2)2ОН – этиленгликоль, НО(СН2)4ОН – тетраметиленгликоль и т. д.
· Тривиальная номенклатура. Ряд тривиальных названий спиртов рекомендован ИЮПАК в качестве родоначальных названий, например: этиленгликоль, глицерин, пинакон, ментол, пентаэритрит.
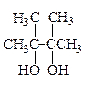
| 
| 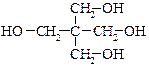
|
| пинакон | ментол | пентаэритрит |
Строение спиртов
В насыщенных спиртах связи Н-О и О-С расположены по отношению друг к другу под углом ~106°. Связь Н-О поляризована из-за большей, чем у атома водорода, электроотрицательности атома кислорода. Алкильные радикалы, обладающие +I-эффектом, подают электронную плотность на атом кислорода, частично компенсируя его электроноакцепторные свойства. Поэтому в спиртах связь Н-О поляризована меньше, чем в воде, в которой атом водорода не обладает индукционным эффектом. Следовательно, спирты обладают более слабыми кислыми свойствами по сравнению с водой (соответственно рКа ~17 и 15,7), но значительно более сильными, чем ранее изученный ацетилен (рКа ~25).
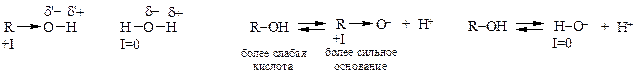
Иначе кислотные свойства спиртов и воды можно оценить, сравнив основность сопряженных оснований. В алкоголятах +I-эффект радикала увеличивает отрицательный заряд на атоме кислорода, тогда как атом водорода в гидроксид-анионе никак не влияет на него. Алкоголят-анионы являются более сильными основаниями по сравнению с гидроксид-анионом, а значит спирты, как сопряженные кислоты, соответственно слабее по кислотным свойствам, чем вода.
Изомерия
Очевидно, что для метана и этана, в которых все атомы водорода равноценны, путем замещения одного водорода на гидроксил можно получить по единственному спирту: это метиловый СН3ОН и этиловый СН3СН2ОН спирты. У пропана имеются уже две возможности – замещение на гидроксил одного из водородов метильных групп и одного из водородов метиленовой группы. И, действительно, существуют два пропиловых спирта: первичный, в котором гидроксил связан с первичным атомом углерода (пропиловый спирт или пропанол-1), и вторичный – с гидроксилом у вторичного атома углерода (изопропиловый спирт или пропанол-2).
|
|
| СH3CH2CH2OH | CH3CH(OH)CH3 |
| первичный спирт (пропанол-1) | вторичный спирт (пропанол-2) |
Таким образом, изомерия спиртов, как и вообще изомерия замещенных углеводородов, носит двоякий характер – изомерия углеводородного скелета, уже знакомая нам по алканам, и изомерия положения гидроксильной функции в данном скелете. Действительно для четвертого члена гомологического ряда алканов – бутана – спирты происходят от двух разных углеводородных цепей: от н -бутана и изобутана.
| Структурная изомерия | |||||
| изомерия углеродного скелета | изомерия положения функции | межклассовая изомерия | |||
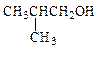 2-метилпропанол-1
изобутиловый спирт
2-метилпропанол-1
изобутиловый спирт
|
бутанол-2 втор-бутиловый спирт |
СН3СН2СН2СН2ОН
бутанол-1 н - бутиловый спирт | СН3СН2ОСН2СН3 этоксиэтан диэтиловый эфир | ||
Для спиртов возможны и все основные виды стереоизомерии.
| Стереоизомерия | |||
| энантиомерия | s -диастереомерия | ||
 (R)- бутанол-2
(R)- бутанол-2
|  (S)- бутанол-2
(S)- бутанол-2
| 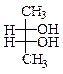 эритро- бутандиол-2,3
эритро- бутандиол-2,3
| 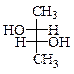 трео- бутандиол-2,3
трео- бутандиол-2,3
|
13.2. Физические свойства спиртов
Из сравнения температур кипения спиртов сходной структуры видно, что при переходе от одного члена гомологического ряда к другому повышение температуры кипения составляет примерно 20 °С. Разветвление цепи, так же как и в углеводородах, повышает температуру плавления (особенно сильно для третичных спиртов, в которых «разветвленный» атом углерода примыкает к функциональной группе) и понижает температуру кипения. По сравнению с углеводородами спирты кипят при значительно более высокой температуре.
Для объяснения аномалий в температурах кипения было использовано понятие водородной связи. Можно считать, что в спиртах атом водорода гидроксильной группы служит мостиком между двумя электроотрицательными атомами кислорода, причем с одним из них он связан ковалентной связью, а с другим – электростатическими силами притяжения. Энергия водородной связи в спиртах около 20 кДж/моль (для большинства ковалентных связей она равна 210-420 кДж/моль).
|
|
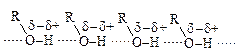
Молекулы, которые удерживаются вместе водородными связями, называются ассоциированными; их аномально высокие температуры кипения обусловлены дополнительной энергией, необходимой для разрушения водородных связей. Подробнее о водородной связи см. Главу 3 «Основы теории электронного строения органических молекул».
Существенное отличие спиртов от углеводородов состоит в том, что низшие спирты смешиваются с водой в любом соотношении. Вследствие наличия ОН-группы, молекулы спирта удерживаются вместе такими же межмолекулярными силами взаимодействия, какие существуют в воде. В результате возможно смешивание двух типов молекул, причем энергия, требуемая для отрыва молекул воды или спирта друг от друга, берется за счет образования аналогичных связей между молекулами воды и спирта. Однако это справедливо только для низших спиртов, в которых ОН-группа составляет значительную часть молекулы. Длинная алифатическая цепь с небольшой ОН-группой в значительной степени сходна с алканами, и физические свойства таких соединений отражают это. Уменьшение растворимости в воде с увеличением числа атомов углерода происходит постепенно: первые три первичных спирта неограниченно смешиваются с водой; растворимость н -бутилового спирта составляет 8 г на 100 г воды, н -пентилового – 2 г, н -гексилового – 1 г, а высших спиртов еще меньше.
Согласно величине дипольных моментов (μ=1,6-1,8D) спирты – полярные вещества, которые имеют слабые электронодонорные или нуклеофильные свойства, обусловленные наличием неподеленной пары электронов атома кислорода.
13.2.1. Спектроскопия спиртов
· УФ-спектроскопия. Спирты практически не поглощают в УФ-диапазоне. Имеющаяся слабая полоса с lмакс 180-185 нм соответствует n →σ* переходу электрона неподеленной пары атома кислорода.
· ИК-спектроскопия. В ИК-спектре спиртов наблюдаются сильные валентные колебания νОН при 3635-3615 см-1 и 3600-3200 см-1, соответственно, для сильноразбавленных и концентрированных с водородными связями растворов. Кроме того, деформационные колебания δОН проявляется при 1410-1250 см-1, а валентные колебания νС-О при 1150-1050 см-1 в зависимости от строения спиртов.
· Масс-спектрометрия. Для спиртов, начиная с бутилового, характерна малая интенсивность пика молекулярного иона. Она уменьшается с ростом молекулярной массы спиртов, а также при переходе от первичного спирта ко вторичному. Для третичных спиртов пик молекулярного иона практически отсутствует. Для первичных и вторичных спиртов основная фрагментация начинается с отщепления молекулы воды. В случае третичных спиртов первоначально под электронным ударом происходит отщепление наиболее длинного углеродного радикала с образованием осколочного иона, содержащего гидроксильную группу.
|
|
· Спектроскопия ПМР. В ПМР-спектрах сигнал протона гидроксила проявляется в диапазоне от 1,0 до 5,5 м.д., в зависимости от концентрации и природы растворителя.
13.3. Получение одноатомных спиртов в промышленности
Требования к промышленным синтезам иные, чем к лабораторным методам. В частности, крупнотоннажные производства экономичнее осуществлять непрерывным способом с многократной рециркуляцией больших масс реагирующих веществ. Поэтому для таких производств предпочтительнее газофазные процессы.
Для промышленного получения спиртов наиболее широко используют два основных метода: гидратация алкенов, полученных при крекинге нефти, и ферментативный гидролиз углеводов. Кроме этих двух методов существуют и некоторые другие, имеющие более ограниченное применение.
v Гидратация алкенов. Известно, что алкены, содержащие до пяти атомов углерода, могут быть выделены из смеси, полученной при крекинге нефти. Эти алкены легко превращаются в спирты в результате либо непосредственного присоединения воды, либо присоединения серной кислоты с последующим гидролизом образовавшихся алкилсульфатов. Подробнее см. Главу 8 «Алкены».
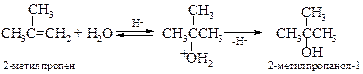
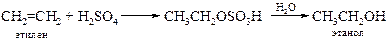
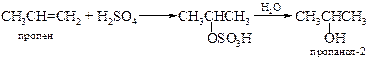

Таким путем могут быть синтезированы лишь те спирты, которые образуются по правилу Марковникова: например, изопропиловый, но не пропиловый; втор -бутиловый, но не н -бутиловый, трет -бутиловый, но не изобутиловый. Этими методами можно получить лишь один первичный спирт – этиловый. Кроме того, данный метод лишен стереоспецифичности, а в процессе гидратации возможны перегруппировки. Эти проблемы можно обойти двухстадийным синтезом спиртов через оксиран, приводящим в итоге к анти-гидратации (см. далее).
В промышленности кислотнокатализируемая гидратация алкенов лежит в основе производства этанола из этилена и пропанола-2 из пропена:
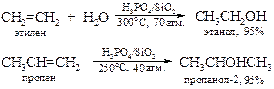
Для получения других спиртов этот метод имеет весьма ограниченную область приложения, поскольку гидратация алкенов часто сопровождается изомеризацией углеродного скелета за счет перегруппировок карбкатионов. Это обстоятельство сильно сужает синтетические возможности на первый взгляд простого способа получения вторичных и третичных спиртов. В лаборатории он вытеснен другим методом, основанном на реакции гидроксимеркурирования-демеркурирования алкенов. Подробно о нем несколько позже.
v Ферментативный гидролиз углеводсодержащего сырья (виноград, ягоды, пшеница, картофель и т. д.) имеет огромное практическое значение особенно для получения этилового спирта:
C6H12O6 → 2C2H5OH + 2CO2
Основная его масса идет на приготовление алкогольных напитков. Отсюда и название “винный или пищевой спирт”. При использовании крахмала в качестве исходного материала кроме этилового спирта образуются сивушные масла, представляющие собой смесь пентиловых спиртов, а также пропилового и изобутилового спиртов, обладающих токсичным действием.
Для промышленных целей применяют этанол, полученный гидролизом и брожением древесины, отходов целлюлозно-бумажной промышленности (гидролизный спирт).
§ Интересной является реакция Вейцмана [1] – ферментативный гидролиз углеводов под действием бактерий Clostridium acetobutylicum, в результате которого образуется смесь н -бутилового спирта (60%), этилового спирта (10%) и ацетона СН3СОСН3 (30%).
v Гидролиз алкилгалогенидов. Реакция не имеет существенного значения, т.к. сами галогенпроизводные алканов чаще получают из спиртов. Тем не менее, в промышленности хлорированием смеси н -пентана и изопентана и последующим гидролизом галогеналканов получают смесь пяти изомерных спиртов, которая используется в качестве растворителя. Из нее перегонкой получают малодоступный чистый пентанол-1.
v Оксосинтез. Нагревание смеси оксида углерода(II) и водорода над катализаторами дает различные спирты, состав которых зависит как от условий проведения реакции, так и соотношения реагирующих веществ, например:
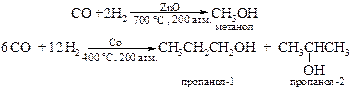
§ Карбонилирование спиртов позволяет удлинить углеродную цепь.
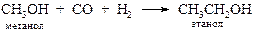
· Гидроформилирование алкенов. Присоединение оксида углерода(II) и водорода к алкенам в присутствии катализатора дает альдегиды и кетоны, которые могут быть восстановлены в спирты.

Оксосинтез, открытый в США (Т. Ройлен, 1938 г.) и первоначально получивший свое развитие в Германии, приобретает в настоящее время все большое значение в химической промышленности. Например, для получения н -бутилового спирта из пропилена и н -пропилового спирта из этилена.
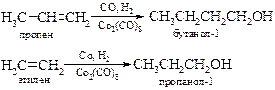
v Альфол-процесс. Основную конкуренцию предыдущему методу составляет альфол-процесс – способ получения н -алканолов путем теломеризации этилена в присутствии катализатора на основе хлорида титана и триэтилалюминия по Циглеру (подробнее см. главу 8 «Алкены») с последующим окислением продуктов теломеризации. В частности, этим методом синтезируют первичные спирты С12-С18.

v Окисление алканов. При окислении высших алканов молекулярным кислородом в основном получают вторичные спирты С12-С20, использующиеся для получения поверхностно-активных веществ. Реакция катализируется солями или комплексами переходных металлов: кобальта, меди, железа, марганца и протекает через разложение гидропероксидов. Подробнее см. главу 7 «Алканы».
13.4. Методы синтеза одноатомных спиртов в лаборатории
v Гидролиз алкилгалогенидов. Обычно спирты получают гидролизом хлоралканов при нагревании с водой или водным раствором щелочей. В первом случае реакция обратима, а во втором она часто сопровождается элиминированием галогеноводородов, например:

Во избежание побочных процессов первоначально из хлоралканов предпочтительно синтезировать сложные эфиры, которые затем омыляют до спиртов.

Для лучшей гомогенизации реакционной смеси в нее добавляют некоторое количество смешивающегося с водой растворителя, например, диоксана.
v Гидроборирование-окисление алкенов. Алкены реагируют с дибораном (ВН3)2, образуя первоначально алкилбораны, которые при окислении превращаются в спирты.

Реакцию проводят в тетрагидрофуране. Диборан получают реакцией между двумя коммерческими реагентами: боргидридом натрия и фторидом бора, часто in situ (в реакционной смечи в присутствии алкена) или восстанавливают хлорид бора(III) водородом.

Алкилбораны не выделяют, а обрабатывают их в том же реакционном сосуде щелочным раствором пероксида водорода. Как видно из приведенных реакций, они протекают против классического правила Марковникова и без перегруппировок.
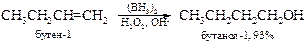
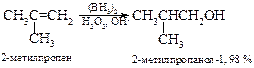

Следует отметить, что в реакции участвует не диборан, а его мономер, образующийся в растворе:
 .
.
Наряду с дибораном в органическом синтезе применяют комплекс борана в тетрагидрофуране.

§ Механизм реакции гидроборирования можно представить как типичное электрофильное присоединение гидрида бора по двойной связи, в котором электрофилом является атом бора. С современной точки зрения эту реакцию рассматривают как процесс, протекающий через четырехцентровый промежуточный комплекс.
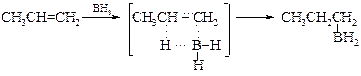
По-видимому, реакция гидроборирования алкенов начинается с электрофильной атаки атома бора. В образовавшемся p-комплексе на атоме бора увеличивается отрицательный заряд с тенденцией образования вторичного карбкатиона. Однако последний не образуется, потому что приобретающий отрицательный заряд атом бора легко теряет атом водорода в виде гидрид-иона с синхронным образованием продукта цис -присоединения.
Реакция окисления алкилборанов протекает следующим образом. На первой стадии гидропероксид-анион атакует электронодефицитный атом бора.

Образовавшийся интермедиат перегруппировывается благодаря миграции алкильной группы со своими электронами к атому кислорода по схеме, сходной с перегруппировкой карбкатионов.
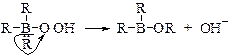
Взаимодействие с гидропероксидом в щелочной среде протекает быстро и с выделением тепла.
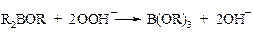
Образовавшийся эфир борной кислоты легко разлагается в условиях реакции с высвобождением спирта.
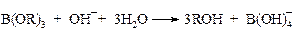
Чтобы предотвратить дальнейшее окисление продуктов реакции до альдегидов и кислот, процесс проводят в атмосфере азота в присутствии борной кислоты (А. Башкиров), которая образует со спиртами стойкие к окислению эфиры борной кислоты В(ОR)3. Последние затем легко гидролизуются щелочами. Таким путем в промышленности, в частности, получают цетиловый спирт С16Н33ОН.
Реакция гидроборирования проста и удобна, выходы очень высоки, и ее можно использовать для синтеза соединений, которые трудно получить из алкенов каким-либо другим способом. Для ациклических, моно- и дизамещенных алкенов гидроборирование–окисление дает уникальную возможность синтеза первичных спиртов с суммарным выходом 80-95%.
v Алкилборирование оксида углерода(II). Дальнейшее развитие методов получения спиртов из алкилборанов получило в работах Г. Брауна и М. Рашке, которые предложили в качестве акцептора алкилборана оксид углерода(II). Реакция протекает при температурах 100-125 °С. В промежуточном комплексе происходит последовательная миграция алкильных групп с атома бора на атом углерода.
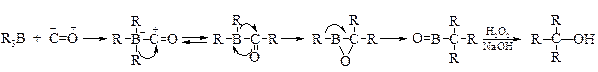
Этим методом в зависимости от условий проведения реакции можно получить с высоким выходом первичные, вторичные и третичные спирты.
v Гидроксимеркурирование-демеркурирование алкенов приводит к образованию спиртов и не сопровождается перегруппировкой. Направление реакции соответствует правилу Марковникова; она протекает в мягких условиях, а выходы близки к теоретическим.
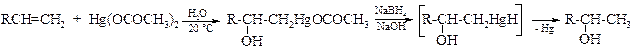 Механизм этой реакции может быть представлен следующим образом. Первоначально происходит диссоциация ацетата ртути(II) с образованием иона СН3СООНg+. Ацетоксимеркурат-катион реагирует с двойной связью С=С алкена подобно протону. Далее карбокатион взаимодействует с водой, образуя алкилртутную соль.
Механизм этой реакции может быть представлен следующим образом. Первоначально происходит диссоциация ацетата ртути(II) с образованием иона СН3СООНg+. Ацетоксимеркурат-катион реагирует с двойной связью С=С алкена подобно протону. Далее карбокатион взаимодействует с водой, образуя алкилртутную соль.
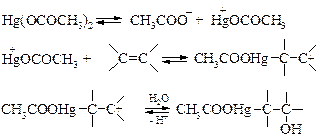
Демеркурирование образующихся меркурированных спиртов протекает количественно при обработке их боргидридом натрия.

Например:
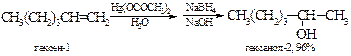
Замена воды на спирт или карбоновую кислоту приводит к получению простых или сложных эфиров. В лаборатории этот метод полностью вытеснил реакцию гидратации алкенов.
v Восстановление сложных эфиров и карбоновых кислот приводит к первичным спиртам.
§ Каталитическое гидрирование сложных эфиров обычно проводят над платиновыми катализаторами, никелем Ренея или меднохромитовым катализатором.

§ В лабораторных условиях в качестве восстановителя значительно чаще используется алюмогидрид лития.
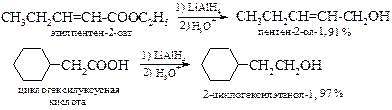
§ Большие количества спиртов с неразветвленной углеродной цепью, содержащих четное число атомов углерода, ранее получали в чистом виде восстановлением натрием в этиловом или бутиловом спирте сложных эфиров жирных кислот или жиров по методу Буво [2] -Блана [3].
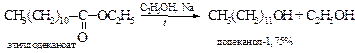
v Восстановление оксосоединений до спиртов можно проводить водородомв присутствии катализаторов, таких как никель Ренея или платина, а также алюмогидридом лития или боргидридом натрия. При этом из альдегидов получаются первичные спирты, а из кетонов – вторичные.
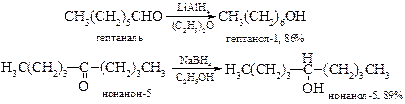
Следует отметить, что боргидрид натрия в отличие алюмогидрида лития не восстанавливает карбоксильную и сложноэфирную группы, что позволяет восстанавливать карбонильную группу в их присутствии.
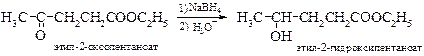
Алкил- и арилзамещенные боргидриды наряду с селективностью восстановления обеспечивают и стереоселективность.
v Синтезы на основе реактива Гриньяра. Реактивы Гриньяра легко вступают во взаимодействие с карбонильными соединениями. Формальдегид при этом образует первичный спирт, остальные альдегиды – вторичные, а кетоны – третичные спирты.

При взаимодействии реактива Гриньяра со сложными эфирами получают третичные спирты, за исключением эфиров муравьиной кислоты, дающих вторичные спирты.
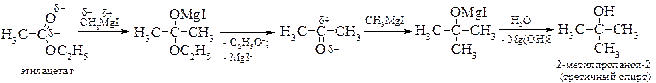 Образовавшийся кетон более активен, чем сложный эфир, и поэтому он в первую очередь реагирует с реактивом Гриньяра.
Образовавшийся кетон более активен, чем сложный эфир, и поэтому он в первую очередь реагирует с реактивом Гриньяра.
v Получение спиртов на основе оксиранов.
§ Органические a-оксиды (оксираны или эпоксиды) также вступают в реакции с алкилмагнийгалогенидами, образуя первичные спирты.

§ Эпоксиды при действии алюмогидрида лития превращаются в спирты. Реакция состоит в нуклеофильной атаке гидрид-аниона по наименее замещенному (менее экранированному) атому углерода с образованием вторичного или третичного спирта.
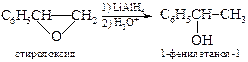
Ввиду того, что a-оксиды обычно получают из олефинов, то такой двухстадийный процесс можно рассматривать как альтернативу реакции гидратации алкенов. В отличие от последней реакции восстановление эпоксидов протекает регио- и стереоспецифично. В системах, для которых невозможно свободное вращение вокруг s-связей гидроксильная группа и атом водорода имеют анти -конфигурацию, отсюда и название этого процесса – анти-гидратация.

v Взаимодействие первичных аминов с азотистой кислотой приводит к образованию спиртов.
CnH2n+1NH2 + HONO → CnH2n+1OH + N2↑ + H2O
Реакция не имеет реальной синтетической значимости, т. к. сопровождается образованием большого количества побочных продуктов.
v Взаимодействие галогеналканов с супероксидом калия – один из самых современных методов синтеза спиртов.
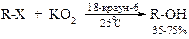
Замещение атома галогена у вторичных асимметрических атомов углерода на гидроксил сопровождается полным обращением конфигурации.
13.5. Химические свойства одноатомных спиртов
Реакции спиртов можно разделить на два типа: протекающие с разрывом связи С–ОН и СО–Н, в силу того, что спирты проявляют кислотно-основные свойства.
Разрыв связи С–ОН
v Замещение гидроксильной группы на галоген. Существует большое количество реакций замещения гидроксильной группы на галоген. Наиболее известные из них – взаимодействие спиртов с галогенводородными кислотами, а также галогенидами фосфора и серы. В зависимости от строения исходного спирта, реакция замещения может протекать по механизму SN1 или SN2.
· Взаимодействие спиртов с галогеноводородами. Успех реакции, кроме условий проведения, определяется природой спирта и кислотностью галогеноводорода. Реакционная способность последних уменьшается в ряду HI > HBr > HCl >> HF, а в ряду спиртов скорость замещения ОН-группы резко снижается при переходе от третичного спирта к первичному. Так, третичный спирт реагирует с галогенводородными кислотами, за исключением фтороводорода, уже на холоду. Первичные и вторичные спирты превращаются в галогеналканы при нагревании со смесью галогеноводородной и серной кислот в течение нескольких часов.
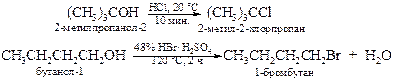
Иногда галогеноводородные кислоты получают в реакционной смеси из их натриевых и калиевых солей действием концентрированной серной кислоты.
§ Следует отметить, что хлорид-ион является весьма слабым нуклеофилом из-за высокой сольватации его в водных средах. Для увеличения скорости реакции добавляют хлорид цинка, который облегчает замещение на хлорид-ион.
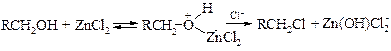
Так, т. е. по механизму SN2, реагируют метанол и большинство пространственно незатрудненных первичных спиртов. Протонирование спиртов превращает гидроксильную группу в хорошо уходящую группу.
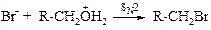
В реакциях SN2 реакционная способность первичных спиртов R – CH2OH ниже, чем для самого метанола. Это связано с увеличением пространственных затруднений для атаки протонированного спирта галогенид-ионом.
§ Третичные и частично вторичные спирты реагируют по механизму SN1, когда протонированный спирт легко и быстро выбрасывает молекулу воды, образуя карбокатион. Его дальнейшая стабилизация определяется атакой более сильным нуклеофилом – галогенид-анионом, чем вода.
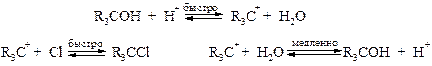
§ При этом следует учитывать, что образующийся из вторичных спиртов карбокатион способен за счет 1,2-гидридного или алкильного сдвига превращаться в третичный, например:
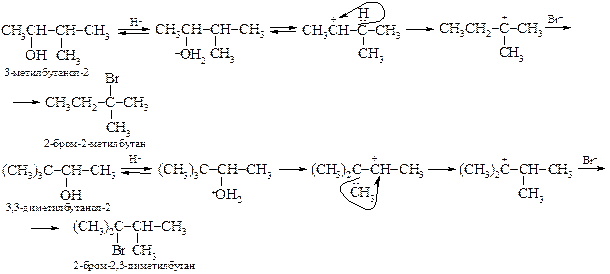
Последняя стадия осложняется побочной реакцией Е1 – отщеплением протона с образованием алкена.
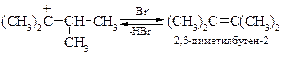
§ Некоторые пространственно затрудненные первичные спирты могут реагировать по механизму SN1, например, неопентиловый спирт. Образующийся первичный карбкатион быстро перегруппировывается в третичный карбкатион за счет 1,2-метильного сдвига:
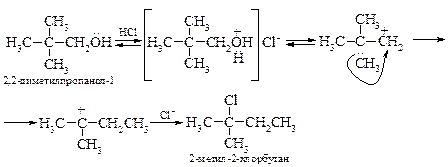
Вторичные спирты могут реагировать как по механизму SN1, так и SN2. Он определяется концентрацией спирта, кислоты, температурой проведения реакции и природой растворителя.
· ПробаЛукаса. Является ли спирт первичным, вторичным или третичным, можно установить с помощью пробы Лукаса, которая основана на различной реакционной способности трех классов спиртов по отношению к галогеноводородам. Третичные спирты реагируют с реактивом Лукаса (смесь концентрированной HCl с безводным ZnCl2) сразу же, о чем свидетельствует мгновенное помутнение реакционной смеси, вторичные – в течение 5 минут, а первичные спирты – при комнатной температуре заметно не реагируют. Третичные спирты легко образуют карбкатионы, вторичные – медленнее, а первичные не реагируют. Так как спирты растворимы в концентрированной соляной кислоте в присутствии хлорида цинка, а образованные из них галогениды – нет, то, соответственно, наблюдается помутнение. Исключением являются первичные аллиловый и бензиловый спирты, которые образуют устойчивые карбкатионы, и поэтому дают положительную реакцию.
· Взаимодействие спиртов сгалогенидами фосфора и серы. По сравнению с галогеноводородами более удобными реагентами для получения галогеналканов из спиртов является галогениды фосфора и серы, а также галогенангидриды некоторых неорганических кислот, например, SOCl2, PCl3, PCl5, POCl3, COCl2.
R-OH + PCl5 → R-Cl + POCl3 + HCl
3 R-OH + PBr3 → 3 R-Br + H3PO3
6 CH3OH + 2 P + 3 I2 → 6 CH3I + H3PO3 (P + 3 I2 → 2PI3)
§ Для реакций с тригалогенидами фосфора наиболее вероятен следующий механизм реакции. Первоначально образуется триалкилфосфит и, если процесс вести в присутствии оснований, это соединение может быть конечным продуктом реакции.

Если бромоводород не нейтрализовать, то промежуточное соединение триалкилфосфит легко протонизируется и алкильные группы превращаются в галогеналканы.

§ Реакции спиртов с пентагалогенидами фосфора обычно не сопровождаются перегруппировками и ведут к изменению конфигурации асимметрического атома углерода, связанного с гидроксильной группой.

§ В реакциях спиртов с тионилхлоридом сначала образуется хлорсульфитный эфир.
RОН + SOCl 2 → ROSOCl + HCl
Далее реакция может протекать по двум механизмам. В нуклеофильных растворителях, таких как диоксан, растворитель принимает участие в реак
|
|
|

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!