Содержание
· Спирты.
· Фенолы
· Альдегиды и кетоны
· Карбоновые кислоты.
· Соли карбоновых кислот
· Сложные эфиры.
Спирты
К спиртам относятся соединения, содержащие функциональную группу -OH, связанную с углеводородным радикалом.
Классификация спиртов
I. По типу атома углерода, связанного с функциональной группой –OH различают первичные, вторичные и третичные спирты, например:
Таблица 1 Классификация спиртов по строению.
| Класс спирта
| пример
|
| Первичный
пентанол - 1
| 
|
| Вторичный
пентанол - 2
| 
|
| Третичный
2-метилбутанол - 2
| 
|
II. По количеству гидроксильных групп различают одноатомные и многоатомные спирты, например:
Таблица 2 Классификация спиртов по количеству гидроксогрупп.
| Класс спирта
| пример
|
| Одноатомный
|  этанол
этанол
|
| Двухатомный
| 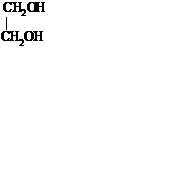 этандиол – 1,2
(этиленгликоль)
этандиол – 1,2
(этиленгликоль)
|
| Трехатомный
|  пропантриол – 1,2,3
(глицерин)
пропантриол – 1,2,3
(глицерин)
|
III. По природе углеводородного радикала.
Таблица 3 Классификация спиртов по природе радикала
| Предельный
| СН3 – ОН
метанол (метиловый спирт или карбинол или древесный спирт)
 этанол (этиловый спирт)
этанол (этиловый спирт)
|
| Непредельный
|  этенол[1]
(виниловый спирт)
этенол[1]
(виниловый спирт)
 пропен-3-ол-1
пропен-3-ол-1
|
| Ароматический
|  бензиловый спирт
бензиловый спирт
|
Номенклатура и изомерия спиртов.
По номенклатуре ИЮПАК в структурной формуле спирта находится самая длинная цепь из атомов углерода, обязательно включающая атом углерода, связанный с гидроксильной группой. Эта цепь нумеруется с той стороны, к которой ближе гидроксильная группа. Сначала называются алкильные радикалы с указанием их места положения в цепи, затем название углеводорода, соответствующего длине выбранной цепи, после чего добавляется окончание спиртов – «ол».
По рациональной номенклатуре атом углерода и связанный с ним гидроксил получают название «карбинол». Сначала называются алкильные радикалы, соединённые с упомянутым выше атомом углерода, а затем слитно слово «карбинол».
Также используется тривиальная номенклатура.
Таблица 4. Примеры названий изомерных спиртов.
| C5H12O
| Название по ИЮПАК
| Рациональное
название
| Тривиальное название
|
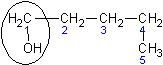
| Пентанол - 1
| н - Бутилкарбинол
| Амиловый спирт
|
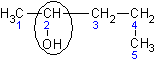
| Пентанол - 2
| Метилпропил-карбинол
| -
|

| Пентанол - 3
| Диэтилкарбинол
| -
|
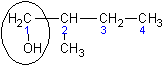
| 2 – метилбутанол - 1
| Втор - бутилкарбинол
| -
|
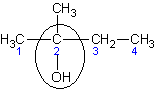
| 2 - метилбутанол - 2
| Диметилэтилкарбинол
| Трет – амиловый спирт
|
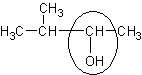
| 3 – метилбутанол - 2
| Метилизопропил-карбинол
| -
|
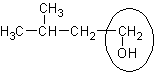
| 3 – метилбутанол - 1
| Изобутилкарбинол
| Изоамиловый спирт
|
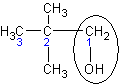
| 2,2 – диметил-
пропанол - 1
| Трет - бутилкарбинол
| Нео-пентиловый спирт
|
Способы получения спиртов
1. Гидратация алкенов: электрофильное присоединение воды к алкенам в присутствии каталитических количеств минеральных кислот. Присоединение воды к несимметричным алкенам протекает по правилу Марковникова: преимущественно (90%) водород присоединяется к наиболее гидрогенизинованному атому:

2. Гидратация алкадиенов. Алкадиены аналогично алкенам присоединяют в присутствии кислот воду.
Присоединение первого моля воды идёт преимущественно в положения 1 – 4. При присоединении второго моля воды образуются диолы. Ниже представлены примеры обоих случаев: 
3. Щелочной гидролиз галогеналканов. Галогеналканы вступают с водными растворами [2] щелочей в реакцию нуклеофильного замещения галогена на гидроксил:
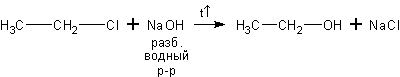
хлорэтан этанол
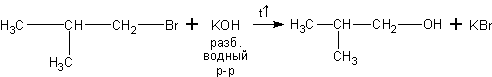
1-бром-2-метилпропан 2-метилпропанол-1
При действии водныхрастворов щелочей на дигалогеналканы получаются двухатомные спирты (или диолы):
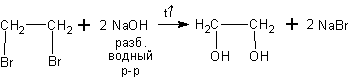
Как показано выше из 1,2-дибромэтана получается 1,2-этандиол (этиленгликоль).
Из 1,2,3-трихлорпропана, например, получают широко используемый глицерин (пропантриол - 1,2,3).
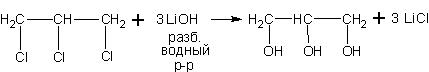
4. Гидролиз аминов. При нагревании с парами воды в присутствии катализатора протекает обратимая реакция, в которой конечными продуктами являются спирт с тем же строением углеродного скелета и аммиак.
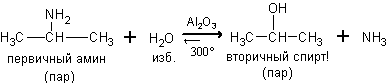
Первичные амины можно перевести в спирты так же действием нитританатрия в соляной кислоте при охлаждении до 2 – 5оС:

5. Гидрирование альдегидов и кетонов. Реакция гидрирования обратимо протекает на катализаторах – металлах платиновой группы: Ni, Pd, Pt:
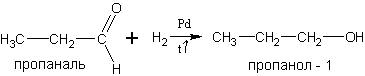
 пентандион-2,4 пентандиол-2,4
пентандион-2,4 пентандиол-2,4
6. Гидролиз алкоголятов. Алкоголяты практически нацело гидролизуются в воде при комнатной температуре:


7. Гидролиз сложных эфиров. Из сложных эфиров спирты наряду с карбоновыми кислотами могут быть получены путём кислотного гидролиза:

В щелочной среде реакция гидролиза сложных эфиров необратима:

8. Получение метанола. Специфический способ получения метанола – окисление метана на гетерогенном катализаторе – серебре – расчётным количеством кислорода до метанола:
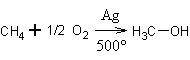
Современный промышленный метод получения метанола – каталитический синтез из оксида углерода (II) и водорода:

9. Получение этанола. Промышленный способ получения этанола – гидратация этилена (260-300оС, 10Мпа, в присутствии сильных кислот, на алюмосиликате с добавками солей кадмия, меди, кобальта), см. п.1.
Этанол образуется при брожении сахаров в присутствии дрожжей:
С6Н12О6 → 2С2Н5ОН + 2СО2
Химические свойства спиртов
1. Кислотные свойства. Спирты являются очень слабыми кислотами, их [3]pKa=16-18. Однако, они гораздо более сильные кислоты, чем ацетилен (рКа=22) и аммиак (рКа=35). Кислотные свойства спиртов убывают по гомологическому ряду. Эти свойства проявляются в реакциях с активными – щелочными и щелочноземельными металлами с образованием солей – алкоголятов:
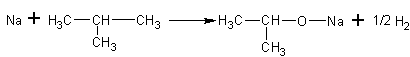
изопропилат натрия
С менее активными металлами, такими как Al, Zn, Fe спирты не реагируют.
Получить алкоголяты взаимодействием спиртов с водными растворами щелочей нельзя, т.к. полученные соли нацело гидролизуются водой.
2. Основные свойства спиртов. Спирты проявляют слабые осн о вные свойства, присоединяя катион водорода:

Образуется связь по донорно-акцепторному механизму: спирт, за счет атома кислорода является донором электронной пары, а катион водорода - акцептором
3. Реакции нуклеофильного замещения гидроксогруппы.
1) Реакция с галогеноводородами. Спирты могут реагировать с концентрированными галогеноводородными кислотами в присутствии ZnCl2 (реакция Лукаса):
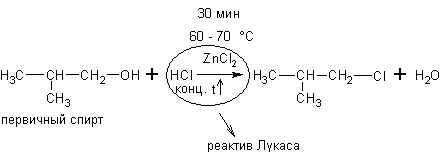


Эти реакции – хороший пример для иллюстрации положения теории А.М.Бутлерова о влиянии строения на химические свойства. Как видно скорость реакции с одним и тем же реагентом в случае третичных спиртов намного выше, чем вторичных, а те в свою очередь реагируют быстрее первичных.
2) Реакция с аммиаком и аминами.
Спирты реагируют с аммиаком. Реакция обратима. Равновесие в ней смещают вправо избытком аммиака в соответствии с принципом Ле-Шателье:
 Аналогично спирты реагируют с аминами.
Аналогично спирты реагируют с аминами.
 вторичный амин
вторичный амин
4. Нуклеофильные свойства спиртов. Вследствие наличия у атома кислорода неподеленной электронной пары спирты являются нуклеофильными реагентами – в реакциях атакуют атом, имеющий частичный положительный заряд – δ+.
1) Реакция этерификации. Спирты реагируют с кислородсодержащими кислотами с образованием сложных эфиров.
а) с минеральными кислотами:


Практически важной является реакция получения сложного эфира глицерина и азотной кислоты - нитроглицерина. Моно- и динитроглицерин используются в медицинской практике как сосудорасширяющие средства. Тринитроглицерин, уравнение реакции получения которого приведено ниже, является детонирующей основой динамита[4].
 Нитроэфиры по составу и свойствам отличаются от нитросоединений:
Нитроэфиры по составу и свойствам отличаются от нитросоединений:
| НИТРОСОЕДИНЕНИЯ
| НИТРОЭФИРЫ
|

| 
|
б) с карбоновыми кислотами:

2) Реакция переэтерификации. Спирты могут взаимодействовать также со сложными эфирами. Получается новый спирт и новый сложный эфир. Реакция носит обратимый характер катализируется кислотами. Она очень широко применяется для синтеза душистых веществ, которые используются в парфюмерных композициях.

3)  Реакция спиртов с альдегидами и кетонами. Продуктами этой реакции являются полуацетали:
Реакция спиртов с альдегидами и кетонами. Продуктами этой реакции являются полуацетали:
При реакции спиртов с полуацеталями получаются ацетали:
Полуацетали и ацетали как правило, обладают хорошим запахом, выделяются из растений и часто служат компонентами парфюмерных композиций.
Реакция спиртов с кетонами аналогична их взаимодействию с альдегидами, но проходит в более жестких условиях.

4) М ежмолекулярная дегидратация спиртов. В результате реакции образуются простые эфиры. При дегидратации в газовой фазе на гетерогенном катализаторе – оксиде алюминия равновесие смещают вправо, понижая давление, так как в реакции из одного моля газа получается два (в соответствии с принципом Ле-Шателье). В этой реакции одна молекула спирта является нуклеофильным реагентом, а другая – объектом нуклеофильной атаки:

Получить простые эфиры можно также взаимодействием алкоголятов с галогеналканами (лучший способ получения несимметричных простых эфиров):

5. Внутримолекулярная дегидратация. В результате этой реакции образуются алкены.
В соответствии с правилом Зайцева водород преимущественно отщепляется от менее гидрогенизированного атома углерода из двух соседних с тем атомом углерода, который связан с гидроксогруппой:

6. Окисление спиртов. Спирты могут окисляться в различных условиях до различных продуктов.
а) Реакция горения:
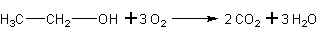
б) Реакция мягкого окисления.
Окисление паров первичных и вторичных спиртов оксидом медиприводит к получению, соответственно, альдегидов и кетонов, например:


Третичные спирты не окисляются оксидом меди.
в) Дегидрирование спиртов. При дегидрировании спиртов на катализаторах платиновой группы первичные спирты окисляются до альдегидов, а вторичные - до кетонов:


г) Реакции жесткого окисления. При окислении спиртов в жидкой фазе в кислой среде сильными окислителями, такими как перманганат калия, дихромат калия первичные спирты окисляются до карбоновых кислот. Вторичные – до кетонов. Например, этанол до уксусной кислоты:

Изопропиловый спирт окисляется до кетона (пропанона)

 Окисление третичных спиртов идет только при нагревании с разрывом C - C связи. Получается сложная смесь карбоновых кислот, кетонов и углекислый газ:
Окисление третичных спиртов идет только при нагревании с разрывом C - C связи. Получается сложная смесь карбоновых кислот, кетонов и углекислый газ:
ЗНАЧЕНИЕ СПИРТОВ.
Простейший спирт – метанол очень широко применяется как исходное сырьё в многочисленных органических синтезах. Например, для синтеза формальдегида, метилмеркаптана, метиламина, сложных эфиров многих карбоновых кислот, которые в свою очередь применяются как пластификаторы, растворители, душистые вещества в парфюмерии и компоненты пищевых эссенций. Очень важным является синтез уксусной кислоты из метанола и угарного газа:

Этот способ производства уксусной кислоты вытеснил вредный с позиции экологии способ её синтеза из ацетилена через ацетальдегид по методу Кучерова, так как в нём получается большое количество ртутьсодержащих сточных вод.
Не менее важным является использование метанола в синтезе метилакрилата из ацетилена, угарного газа и этого спирта:

Метанол используется также как растворитель, антифриз и моторное топливо. Им растворяют пробки, образующиеся из замёрзшего конденсата в газопроводах на крайнем севере.
Метанол чрезвычайно токсичен. 7- 10 мл его достаточно для того, чтобы мужчина с массой тела около 70 кг ослеп. Выпитые по ошибке 25 – 30 мл приводят к летальному исходу. Важно знать, что токсичен не сам метанол, а продукты его окисления под действием ферментов – формальдегид и муравьиная кислота. Поэтому, если занять ферменты окислением гораздо менее опасного для человека этанола (в виде водки, принимаемой постоянно в течение трёх суток), то пациента можно спасти.
В мире производится около 30 миллионов тонн метанола в год.
Этанол или этиловый спирт применяется в производстве ацетальдегида, хлороформа, диэтилового эфира, этилацетата, уксусной кислоты, дивинила, многих душистых веществ для парфюмерии. Кроме того он применяется как растворитель лакокрасочных материалов, взрывчатых и лекарственных веществ.
Этанол – метаболит многих живых организмов, в том числе и человека, образуется
Этиловый спирт, получаемый путём брожения пищевого сырья, применяется при изготовлении алкогольных напитков, растворения и перекристаллизации лекарственных препаратов. Этанол – наркотик, возбуждающе действующий на организм; его постоянное (важно знать любителям пива) или периодическое, но неумеренное употребление ведёт к алкоголизму – тяжёлой болезни, заканчивающейся циррозом печени и полной деградацией личности. В мире производится около 3 миллионов тонн этанола в год.
Пропанол-1 широко применяется как растворитель для восков, природных и синтетических смол. Как исходное вещество в синтезе лекарственных препаратов, душистых веществ для парфюмерных композиций, сложных эфиров – растворителей лакокрасочных материалов, пестицидов.
Пропанол-2 широко применяется как растворитель ацетатов целлюлозы, этилцеллюлозы, целлофана, эфирных масел, алкалоидов. Как исходное вещество он применяется в синтезах ацетона, изорпопиламина, изопропилацетата, косметических, моющих и лекарственных средств.
Изопропиловый спирт входит в состав жидкостей для размораживания замков и в состав «жидкого ключа», помогающего отворачивать гайки, например, на колёсах автомобилей.
Бутанол-1 применяется как растворитель лакокрасочных материалов, как исходное вещество в синтезе душистых веществ для парфюмерных композиций, пластификаторов для полимерных материалов, гербицидов.
Бутанол-2 применяется как высокооктановый компонент моторных топлив, как исходное вещество в синтезах. В мире производится около 1 миллиона тонн бутанола-2 в год.
Изобутиловый спирт (2-метилпропанол-1) применяется как растворитель лакокрасочных материалов и азотнокислых эфиров целлюлозы (взрывчатые вещества, ракетное топливо). Он используется так же в синтезах душистых веществ, пластификаторов для полимеров, гербицидов.
Трет -бутиловый спирт (2-метипропанол-2) в огромных масштабах используется для получения путём дегидратации изобутилена (2-метилпропена), который идёт как мономер для производства полиизобутилена. Последний с малой степенью полимеризации (15 – 50) служит как присадка к моторным маслам, а с большой (десятки тысяч) как материал для защиты от коррозии аппаратов большого объёма в химической промышленности. Трет -бутиловый спирт используется так же в производстве инициаторов полимеризации.
Высшие спирты (С6 – С20) применяются по-разному в зависимости от длины углеродной цепи. Спирты, содержащие 6-8 атомов углерода, используются как флотореагенты, как экстрагенты солей кобальта, ванадия и урана; как растворители для синтетических смол, как сырьё в производстве пластификаторов. Спирты, содержащие 10-20 атомов углерода, являются компонентами пеногасителей, смазочно-охлаждающих жидкостей, текстильно-вспомогательных веществ, косметических составов. Метакриловые эфиры спиртов(С7 – С9) как депрессорные присадки к моторным топливам и маслам. Натровые и аммонийные соли сернокислых эфиров спиртов(С10 – С20) как синтетические моющие средства, способные стирать в жёсткой и морской воде.
Этиленгликоль (1,2-этандиол) очень широко применяется как компонент антифризов для охлаждения двигателей внутреннего сгорания. Эти антифризы обеспечивают хороший отвод тепла на рабочих режимах двигателя и не замерзают при отрицательных температурах, как вода. Отечественная промышленность выпускает антифризы «Тосол –А 40» и «Тосол –А 60». Первый содержит 40% этиленгликоля и 60% воды и предназначен для работы в средней полосе России, а второй содержит 60% этиленгликоля и 40% воды и используется на крайнем севере. Кроме того, этиленгликоль широко применяется в синтезе полиэтилентерефталата, из которого производят волокно лавсан (который за границей имеет названия терилен, дакрон, ямболен и другие). Из этиленгликоля получают так же многочисленные сложные эфиры. Этиленгликоль входит так же в состав гидравлических, тормозных и закалочных жидкостей. В мире производится около 20 миллионов тонн этиленгликоля в год.
Глицерин (пропантриол - 1,2,3) применяется для производства тринитрата пропантриола-1,2,3, называемого также нитроглицерином. Нитроглицерин одновременно является взрывчатым веществом и препаратом для снятия сердечных приступов.
Глицерин является сырьём в производстве алкидных смол, акролеина, полиуретанов. Он входит в состав эмульгаторов, моющих средств, антифризов, косметических и парфюмерных препаратов, медицинских мазей и растворов, кремов для обуви. В некоторых алкогольных напитках до 15% глицерина. Глицерин абсолютно не токсичен. В виде фрагмента он входит в состав всех жиров и фосфолипидов липидов.
Поливиниловый спирт применяется в производстве волокон для хирургии, как компонент кровезаменяющих составов и некоторых готовых выпускных форм, например, «йодинола», как эмульгатор. В мире производится около 1 миллиона тонн поливинилового спирта в год.
[1] Спирты, содержащие гидроксогруппу, связанную непосредственно с ненасыщенным фрагментом, неустойчивы, самопроизвольно изомеризуются в альдегиды или кетоны.
[2] При взаимодействии галогеналканов со спиртовым раствором щелочи образуются алкены.
[3] рК=-lgK, где К – константа диссоциации кислоты. Поскольку логарифм отрицательный, чем меньше рК, тем сильнее кислота.
[4]Нобель Альфред запатентовал динамит в 1867 г. Всего Нобелю принадлежат 350 патентов (среди них патенты на водомер, барометр, холодильный аппарат, газовую горелку, усовершенствованный способ получения серной кислоты и многое другое). Продукция его динамитных заводов быстро завоевала международный рынок и приносила огромные доходы. Почти всё своё состояние Нобель завещал специально учреждённому фонду, чтобы тот ежегодно присуждал премии лицам, чья деятельность принесла человечеству наибольшую пользу.
Содержание
· Спирты.
· Фенолы
· Альдегиды и кетоны
· Карбоновые кислоты.
· Соли карбоновых кислот
· Сложные эфиры.
Спирты
К спиртам относятся соединения, содержащие функциональную группу -OH, связанную с углеводородным радикалом.
Классификация спиртов
I. По типу атома углерода, связанного с функциональной группой –OH различают первичные, вторичные и третичные спирты, например:
Таблица 1 Классификация спиртов по строению.
| Класс спирта
| пример
|
| Первичный
пентанол - 1
| 
|
| Вторичный
пентанол - 2
| 
|
| Третичный
2-метилбутанол - 2
| 
|
II. По количеству гидроксильных групп различают одноатомные и многоатомные спирты, например:
Таблица 2 Классификация спиртов по количеству гидроксогрупп.
| Класс спирта
| пример
|
| Одноатомный
|  этанол
этанол
|
| Двухатомный
|  этандиол – 1,2
(этиленгликоль)
этандиол – 1,2
(этиленгликоль)
|
| Трехатомный
|  пропантриол – 1,2,3
(глицерин)
пропантриол – 1,2,3
(глицерин)
|
III. По природе углеводородного радикала.
Таблица 3 Классификация спиртов по природе радикала
| Предельный
| СН3 – ОН
метанол (метиловый спирт или карбинол или древесный спирт)
 этанол (этиловый спирт)
этанол (этиловый спирт)
|
| Непредельный
|  этенол[1]
(виниловый спирт)
этенол[1]
(виниловый спирт)
 пропен-3-ол-1
пропен-3-ол-1
|
| Ароматический
|  бензиловый спирт
бензиловый спирт
|






 этанол
этанол
 этандиол – 1,2
(этиленгликоль)
этандиол – 1,2
(этиленгликоль)
 пропантриол – 1,2,3
(глицерин)
пропантриол – 1,2,3
(глицерин)
 этенол[1]
(виниловый спирт)
этенол[1]
(виниловый спирт)
 пропен-3-ол-1
пропен-3-ол-1
 бензиловый спирт
бензиловый спирт

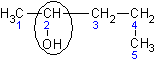




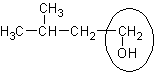

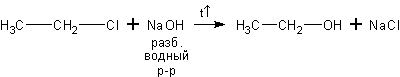
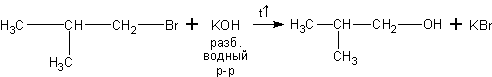
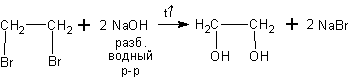
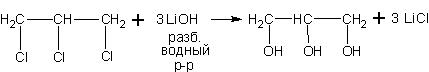
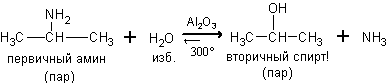
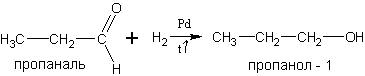
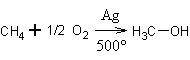

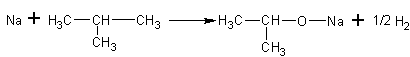




 Аналогично спирты реагируют с аминами.
Аналогично спирты реагируют с аминами. вторичный амин
вторичный амин

 Нитроэфиры по составу и свойствам отличаются от нитросоединений:
Нитроэфиры по составу и свойствам отличаются от нитросоединений:



 Реакция спиртов с альдегидами и кетонами. Продуктами этой реакции являются полуацетали:
Реакция спиртов с альдегидами и кетонами. Продуктами этой реакции являются полуацетали:


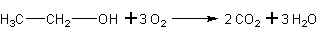





 Окисление третичных спиртов идет только при нагревании с разрывом C - C связи. Получается сложная смесь карбоновых кислот, кетонов и углекислый газ:
Окисление третичных спиртов идет только при нагревании с разрывом C - C связи. Получается сложная смесь карбоновых кислот, кетонов и углекислый газ:

