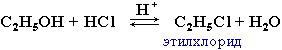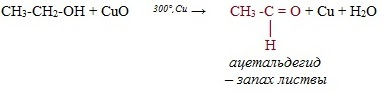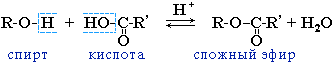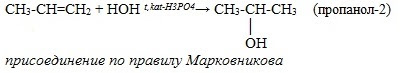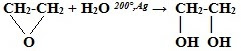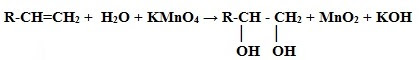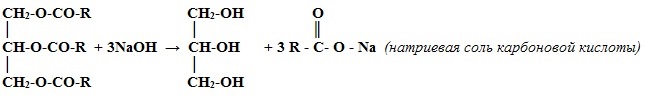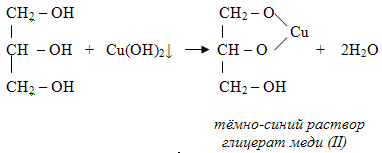Тема 4.3. Кислородсодержащие органические соединения. Спирты: получение, химические свойства, применение. Фенол.
Цель занятия:
- Методическая:
- усовершенствовать методику актуализации опорных знаний
- Дидактическая:
- систематизировать и расширить знания о кислородсодержащих органических соединениях;
- ознакомить с классификацией спиртов, их номенклатурой и изомерией;
- рассмотреть влияние строения спиртов на их свойства;
- совершенствовать умения анализировать, делать выводы.
- Воспитательная:
- достичь понимания важности изучения дисциплины;
- развивать аккуратность, внимательность, настойчивость при выполнении заданий;
- прививать интерес к предмету.
Вид занятия: комбинированное занятие.
Тип занятия: приобретение новых знаний.
Ход занятия
Организационный момент
- проверка присутствия студентов;
- записи в журнале;
- проверка подготовки к занятию студентов.
Сообщение темы, цели и основных задач занятия.
Мотивация к изучению материала
Сегодня мы начинаем изучать органические соединения, которые будут отличаться от ранее изученных органических веществ – углеводородов, составом и свойствами.
В состав многих органических соединений входят атомы кислорода. Первыми кислородсодержащими соединениями нами будут изучены спирты.
Но прежде чем мы начнем изучать спирты по известному плану: состав, строение, номенклатура, гомологический ряд, изомерия, физические и химические свойства, мне бы хотелось познакомить вас с интересными историческими сведениями.
Этанол (метилкарбинол, этиловый или винный спирт) известен человеку с глубокой древности. В те давние времена его называли и водой горючей, и водой жизни, и духом воина.
Ещё в IV веке до нашей эры люди умели приготавливать напитки, содержащие этиловый спирт. Вино получали сбраживанием фруктовых и ягодных соков.
В 11 веке алхимики обнаружили, что при нагревании вина, образуются пары летучего вещества, которые при охлаждении конденсируются в бесцветную жидкость со жгучим вкусом.
В 13 веке этанол стали использовать в медицине под названиями “мать”, “государыня”, “царица всех лекарств”.
В средние века этиловый спирт считался одним из сильнейших лекарственных, одно из первых его названий “жизненная сила”.
Потребление алкоголя в средние века было дурной привычкой, поэтому обычно употребляли пиво, и называли его “жидким хлебом”.
Впервые в XV веке слово алкоголь применялся к этанолу знаменитый немецкий врач, естествоиспытатель Теофраст Парацельс. Только в 1780 году (18 век) А.Лавуазье установил, что в состав этилового спирта входят углерод, водород, кислород, а молекулярную формулу С2Н6О определил в 1833 году Берцеллус.
Актуализация опорных знаний
1) Какие элементы входят в состав органических веществ?
2) Приведите общие формулы гомологического ряда алканов, алкенов, алкинов.
Изучение нового материала
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Классификация спиртов
1) По числу гидроксильных групп спирты подразделяются на:
- одноатомные (одна группа -ОН).
Например, СH3 – OH метанол, CH3 – CH2 – OH этанол
- многоатомные (две и более групп -ОН).
Примеры:
ü двухатомный спирт – этиленгликоль (этандиол) HO–СH2–CH2–OH
ü трехатомный спирт – глицерин HO–СH2–СН(ОН)–CH2–OH
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O.
Спирты R–C(OH)3 не существуют.
2) В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты:
- первичные R–CH2–OH,
- вторичные R2CH–OH,
- третичные R3C–OH.
3) По строению радикалов, связанных с атомом кислорода, спирты подразделяются на:
- предельные (например, СH3 – CH2–OH)
- непредельные (CH2=CH–CH2–OH)
- ароматические (C6H5CH2–OH)
Кислотные свойства
- С активными щелочными металлами:
2C2H5OH + 2 Na → 2C2H5ONa + H2
Основные свойства
- С галогенводородными кислотами:
C2H5OH + HBr H2SO4( конц ) ↔ C2H5Br+ H2O
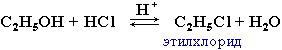
Лёгкость протекания реакции зависит от природы галогенводорода и спирта – увеличение реакционной способности происходит в следующих рядах:
первичные < вторичные < третичные
II. Окисление
1) В присутствии окислителей [ O ] – K 2 Cr 2 O 7 или KMnO 4 спирты окисляются до карбонильных соединений:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.

При окислении вторичных спиртов образуются кетоны.

Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов.
2) Качественная реакция на первичные спирты!
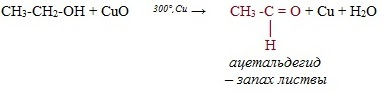
3) Горение (с увеличением массы углеводородного радикала – пламя становится всё более коптящим)
CnH2n+1-OH + O2 t → CO2 + H2O + Q
III. Реакции отщепления
1) Внутримолекулярнаядегидратация
- CH3-CH2-CH(OH)-CH3 t>140,H2SO4( к ) → CH3-CH=CH-CH3 + H2O
2) Межмолекулярная дегидратация
- 2C2H5OH t<140,H2SO4( к ) → С2H5-O-C2H5 + H2O
3) Реакция дегидрирование и дегидратация предельных одноатомных спиртов – реакция С.В. Лебедева
- 2C2H5OH 425,ZnO,Al2O3 → CH2=CH-CH=CH2 + H2 + 2H2O
IV. Реакции этерификации
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
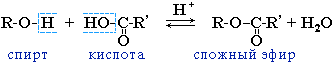
Получение спиртов
I. В промышленности
1) Из водяного газа (получение метанола – древесный спирт)
CO + 2H2 t , p → CH3OH
2) Брожение глюкозы (получение этанола)
C6H12O6 дрожжи → 2C2H5OH + 2CO2
3) Гидратация алкенов
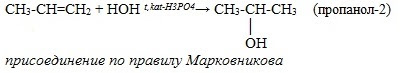
II. В лаборатории
1) Взаимодействие галогеналканов R -Г с водными растворами щелочей
CH3Cl + NaOH t , водн.р-р.→ CH3OH + NaCl (р. обмен)
Применение
Метанол СН3ОН – используют как растворитель, в производстве муравьиной кислоты, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь – 100 мл.
Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство.
Многоатомные спирты
Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом.
Гликоли (диолы)

Триолы

Получение многоатомных спиртов
В промышленности
1) Каталитическая гидратация оксида этилена (получение этиленгликоля):
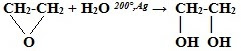
2) Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:

3) Из синтез-газа:
2CO + 3H2 250°,200МПа, kat → CH2(OH)-CH2(OH)
В лаборатории
1) Окисление алкенов:
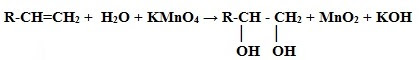
II. Получение трёхатомных спиртов (глицерина)
В промышленности
Омыление жиров (триглицеридов):
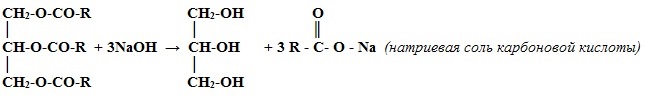
Химические свойства многоатомных спиртов
Кислотные свойства
1) С активными металлами:
HO-CH2-CH2-OH + 2Na → H2↑+ NaO-CH2-CH2-ONa (гликолят натрия)
2) С гидроксидом меди(II) – качественная реакция!
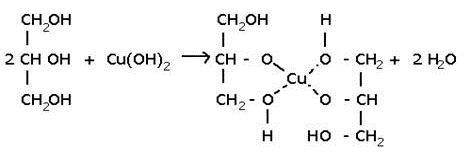
Упрощённая схема
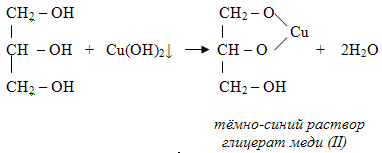
Основные свойства
1) С галогенводородными кислотами
HO-CH2-CH2-OH + 2HCl H + ↔ Cl-CH2-CH2-Cl + 2H2O
2) С азотной кислотой
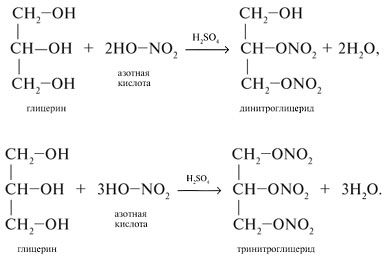
Фенолы
Фенолы - производные ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.
Классификация фенолов
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
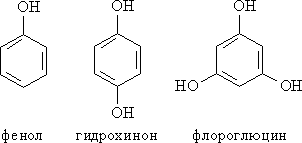
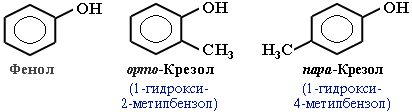
Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга:
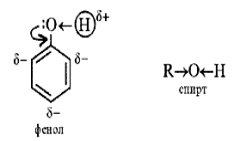
Неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь О–Н еще сильнее поляризуется. Фенол - более сильная кислота, чем вода и спирты.
В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6. Это делает более реакционноспособными связи С-Н в положениях 2, 4, 6 и – связи бензольного кольца.
Химические свойства фенола
Подведение итогов
Обсуждение изученного материла. Выставление оценок за работу студента.
8. Домашнее задание
§ 19-22. Выполнить задание: с. 93 № 1, 5; с. 98 № 5; с.104 № 4; с. 110 № 5.
Тема 4.3. Кислородсодержащие органические соединения. Спирты: получение, химические свойства, применение. Фенол.
Цель занятия:
- Методическая:
- усовершенствовать методику актуализации опорных знаний
- Дидактическая:
- систематизировать и расширить знания о кислородсодержащих органических соединениях;
- ознакомить с классификацией спиртов, их номенклатурой и изомерией;
- рассмотреть влияние строения спиртов на их свойства;
- совершенствовать умения анализировать, делать выводы.
- Воспитательная:
- достичь понимания важности изучения дисциплины;
- развивать аккуратность, внимательность, настойчивость при выполнении заданий;
- прививать интерес к предмету.
Вид занятия: комбинированное занятие.
Тип занятия: приобретение новых знаний.
Ход занятия
Организационный момент
- проверка присутствия студентов;
- записи в журнале;
- проверка подготовки к занятию студентов.