Глобулярный белок плазмы крови, синтезируется исключительно в печени. Хотя по классификации его относят к простым белкам, отмечается широкая микрогетерогенность молекул альбумина, что связано с количеством и качеством агрегированных с альбумином молекул.
Значение альбумина в плазме крови заключается:
1. В поддержании коллоидно-осмотического (онкотического) давления крови (благодаря высокой гидрофильности);
2. Транспортная – благодаря большому количеству заряженных и гидрофобных участков альбумин переносит
- пигменты – (билирубин), одна молекула альбумина может одновременно связать 25-50 молекул билирубина,
- длинноцепочечные жирные кислоты – основная физиологическая функция, 6-8 штук на одну молекулу альбумина,
- катионы (например, Ca2+ и Mg2+) благодаря большому количеству глутамата, другие металлы (Hg+) также способен связать анионы (Cl–),
- соли желчных кислот,
- витамины,
- гормоны (альдостерон, прогестерон, гидрокортизон),
- органические красители,
- лекарственные вещества (дигоксин, барбитураты, пенициллин, ацетилсалициловая кислота, сердечные гликозиды).
Изменения количества белка в крови могут иметь как абсолютный (истинный), так и относительный характер. Сдвиги абсолютного характера являются следствием колебаний содержания белка в крови. В свою очередь, относительные изменения зависят от объема крови, т.е. наблюдаются при обезвоживании или гипергидратации.
2.
При попадании в желудок под действием HCl желудочного сока железо высвобождается из элементов пищи.
Всасывание происходит в проксимальном отделе тонкого кишечника в количестве около 1,0-2,0 мг/день (10-15% пищевого железа). При этом железо должно быть в виде двухвалентного иона, в то же время с пищей поступает преимущественно трехвалентное железо. Для восстановления Fe3+ в Fe2+ используется аскорбиновая кислота и соляная кислота. Только железо мясных продуктов находится в двухвалентной гемовой форме, и поэтому хорошо всасывается.
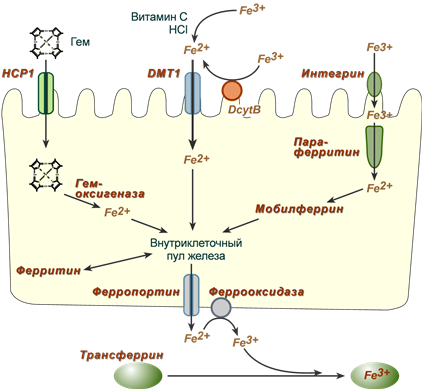
Три пути всасывания железа в кишечнике
Регуляция всасывания
Транскрипционные факторы, от активности которых зависит экспрессия DMT и HCP1, чувствительны к содержанию железа в энтероците и к степени внутриклеточной гипоксии. Больные с выраженной железодефицитной анемией способны повышать абсорбцию железа до 20-40 мг/сут.
Останется железо в энтероците или будет выводиться в кровь зависит от насыщенности им трансферрина. При "пустом" трансферрине железо будет более активно переноситься через базолатеральные мембраны наружу и присоединяться к трансферрину.
Значительно лучше железо всасывается из мясных продуктов – на 20-30%, из яиц и рыбы – на 10-15%, меньше всего железо всасывается из растительных продуктов – на 1-5%.
Наличие в пище фитиновой кислоты (сухие завтраки, растительные продукты), кофеина и танина (чай, кофе, напитки), фосфатов, оксалатов (растительные продукты) ухудшает всасывание железа, т.к. они образуют нерастворимые комплексы.
3.Задача.ОТВЕТ: а), в) Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7и Гис F8 присоединяется гем.
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.

В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
б) Эти изменения могут быть результатом точечных мутаций

1.
Ферменты сыворотки крови
I. Ферменты, секретируемые в плазму, и выполняющие в ней специфические функции – истинноплазменные ферменты. В плазме их активность много больше, чем в органах (церулоплазмин, псевдохолинэстераза, липопротеинлипаза, белковые факторы систем свертывания крови, фибринолиза и кининогенеза, ренин).
Снижение активности этих ферментов в плазме будет свидетельствовать о снижении синтетической способности клеток или о накоплении ингибиторов в плазме крови.
II. Ферменты, не характерные для плазмы – органоспецифичные. Именно определение активности этих ферментов чаще всего используют для верификации диагноза и контроля лечения. Выделяют две группы органоспецифичных ферментов:
1.Ферменты клеточного метаболизма (индикаторные) – их активность резко повышается в плазме крови в случае нарушения проницаемости клеточных мембран или их альтерации:
Например,
· при изменениях со стороны сердечной мышцы происходит повышение активности сердечного изофермента креатинкиназы (КК-MB), изоферментов лактатдегидрогеназы 1 и 2 (ЛДГ-1 и ЛДГ-2), аспартатаминотрансферазы,
· нарушения скелетных мышц – мышечного изофермента креатинкиназы (КК-MM), алкогольдегидрогеназы,
· костной ткани – щелочной фосфатазы (ЩФ), альдолазы (АЛД),
· предстательной железы – кислой фосфатазы,
· гепатоцитов – аланинаминотрансферазы, глутаматдегидрогеназы, холинэстеразы, сорбитолдегидрогеназы,
· желчевыводящих путей – щелочной фосфатазы, γ-глутамилтранспептидазы (γ-ГТП).
2. Ферменты, экскретируемые в выводные протоки желчных путей, панкреатические и слюнные протоки. В норме активность таких ферментов в плазме намного ниже, чем в клетках и имеет постоянное значение (α-амилаза, липаза поджелудочной железы). Изучение активности этих ферментов позволяет судить о функционировании соответствующего органа.
2.

Рефлекторный (кратковременный) спазм сосудов, который возникает при травме. Он значительно уменьшает объем кровотока через поврежденный сосуд или даже прекращает в нем движение крови. Затем спазм сосудов поддерживается действием серотонина, адреналина, тромбоксана, эндотели- нов, которые выделяются из тромбоцитов или клеток поврежденных сосудов
Продукцией под влиянием мембранной фосфолипазы и фермента тромбоксан-синтетазы мощного вазодилататора и ингибитора агрегации тромбоцитов – простагландина (простациклина) 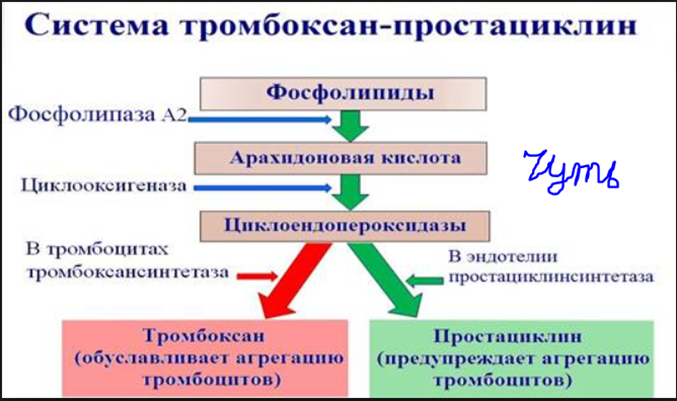

3.Задача.Ответ: а)Заболевание – серповидноклеточная анемия.
б) В гемоглобине S мутантными оказались 2β-цепи, в которых Глу, высокомолекулярная отрицательно заряженная аминокислота в положении 6, была заменена Вал, содержащим гидрофобный радикал.
HbS 2β-цепь Вал-Гли-Лей-Тре-Про-Вал-Глу-Лиз
в) Гемоглобин S
В дезоксигемоглобине S имеется участок, комплиментраный другому участку таких же молекул, содержащему изменённую. В результате молекулы дезоксигемоглобина начинают слипаться, образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
Нарушение доставки кислорода в ткани вызывает боли и даже некроз клеток в данной области.

1.



2.
Обнаружены три способа перемещения железа из просвета кишечника в энтероциты:
1. Негемовое железо (III) захватывается интегрином, восстанавливается до Fe (II) параферритином, и при помощи мобилферрина перемещается к месту использования, роль этого пути невысока.
2. Негемовое железо (III) восстанавливается до Fe (II) при помощи аскорбиновой кислоты, соляной кислоты или при участии ферроредуктазы (DcytB, дуоденального цитохрома B) и далее переносится внутрь белком DMT-1 (divalentmetalion transporter-1).
3. Гемовое железо связывается с белком НСР1 (hemecarrierprotein 1), и в цитозоле высвобождается из гема при действии гемоксигеназы, и далее переносится по клетке.
















