Методы оценки качества спермы
Методические указания
Новосибирск 2009
УДК
Составитель:
В.М. Сороколетова, В.А. Напримеров
Рецензенты:
Методы оценки качества спермы: метод. указ. / Новосиб. гос. аграр. ун-т.
Ин-т. вет. мед.; сост.: В.М. Сороколетова, В.А. Напримеров. – Новосибирск, 2009. – 27 с.
Методические указания предназначены для студентов ветеринарного и биологотехнологического институтов очной и заочной форм обучения, а также могут быть полезны для слушателей курсов специализации «Ветеринарный врач – гинеколог» и зооветспециалистам, решающим вопросы воспроизводства животных на сельскохозяйственных предприятиях.
© Новосибирский государственный аграрный университет, 2009
СОДЕРЖАНИЕ
.
1. Введение……………………………………………………....4
2. Физиология и биохимия спермы…………………………….4
3. Макроскопическая оценка спермы…………………………..9
4. Микроскопическая оценка спермы…………………………11
5. Влияние условий внешней среды на спермии……………..24
6. Библиографический список…………………………………27
ВВЕДЕНИЕ
Полученную от производителей сперму используют для искусственного осеменения самок только после предварительной всесторонней оценки ее качества. Это позволяет определить пригодность производителя к использованию для искусственного осеменения самок.
Качество спермы подвержено резким изменениям в зависимости от условий кормления, содержания и половой эксплуатации производителя, а также от состояния его здоровья. Болезни органов половой и других систем организма оказывают большое влияние на количество и качество спермы, выделяемой производителем.
По отклонениям показателей качества спермы от средней нормы судят о нарушении условий кормления и содержания производителя или режима его полового использования. Это дает возможность быстро исправлять допущенные погрешности и сохранять нормальную плодовитость производителя на длительный срок.
Высокая оплодотворяющая способность или импотенция производителей, а также плодовитость или бесплодие осемененных их спермой самок находятся в прямой зависимости от качества спермы. Поэтому в искусственном осеменении оценка качества спермы имеет чрезвычайно важное значение.
МАКРОСКОПИЧЕСКАЯ ОЦЕНКА СПЕРМЫ
Свежеполученную сперму всегда оценивают вначале по внешним признакам, а затем качество ее определяют другими специальными методами исследования. Оценка спермы по внешним признакам, называемая иногда санитарной (макроскопической или глазомерной), позволяет судить о качестве данного эякулята и целесообразности дальнейшего его исследования.
Порядок работы
Свежеполученную сперму оценивают по следующим внешним признакам: а) объему эякулята, б) цвету, в) запаху, г) консистенции.
Объем эякулята определяют по делениям на спермоприемнике. Если спермоприемник не градуирован, то для определения объема эякулят переливают в градуированный цилиндр или мензурку, предварительно нагретые до 25-50°, свежеполученная сперма очень чувствительна к колебаниям температуры, и поэтому резкое охлаждение ее не допускается.
Объем эякулята быка и барана можно определять при помощи теплой стерильной пипетки или шприца.
Для определения объема эякулята жеребца полученную сперму процеживают через сложенную вдвое или вчетверо стерильную марлевую салфетку из спермоприемника в теплую мензурку и накрывают стеклянной крышкой или чашкой Петри. На марле обычно остается густой, тягучий секрет пузырьковидных желез, объем которого учитывают отдельно. Так как этот секрет снижает жизнеспособность спермиев при хранении, затрудняет работу со спермой и при искусственном осеменении вообще не нужен, то его выбрасывают. Салфетки можно выстирать в содовом растворе и, проутюжив, использовать повторно.
Аналогично определяют, и объем эякулята хряка. Если сперму от хряка получают в спермоприемник с делениями, то объем устанавливают по отсчетам на шкале. Особенно удобны в этом отношении спермоприемники из прозрачной пластмассы. Если спермоприемник был без фильтра, сперму процеживают через марлю в мензурку с делениями; если с фильтром, то сперму не процеживают, а оставляют в спермоприемнике, закрыв лишь трубку колпака марлевой салфеткой. Слизь, оставшаяся на фильтре предохраняет сперму в стакане спермоприемника от проникновения в нее микробов (А. В. Квасницкий). Сперму для исследования или осеменения свиноматок наливают через тонкую трубку-патрубок стакана.
У самцов сельскохозяйственных животных объем эякулята значительно различается по величине. У животных с влагалищным типом естественного осеменения (барана, быка, козла) объем эякулята мал и измеряется миллилитрами. У животных с маточным типом естественного осеменения (жеребца, хряка) объем эякулята большой и измеряется десятками и сотнями миллилитров. Объем эякулята зависит от степени разбавления густой массы спермиев секретами придаточных половых желез.
У производителей одного и того же вида животных и даже у одного и того же самца объем эякулята подвержен колебаниям (табл. 2), связанным с условиями кормления, ухода, содержания и режима полового использования.
В практике встречаются расстройства рефлекса эякуляции с резким уменьшением объема эякулята. Их можно расценивать как симптом нарушения половой деятельности производителей. Различают два вида нарушения динамики выделения эякулята: олигосперматизм и асперматизм.
Таблица 2
Объем эякулята самцов сельскохозяйственных животных
| Производитель
| Объем эякулята (в мл)
|
| минимальный
| средний
| максимальный
|
| Баран
| 0,6
| 1-1,5
| 3-4
|
| Бык
| 2
| 4-6
| 10-15
|
| Жеребец
| 40-50
| 60-80
| 200-300
|
| Хряк
| 150
| 250-400
| 600-1000
|
| Кролик
| -
| 0,5-4
| -
|
| Кобель
| -
| 10-40
| -
|
| Кот
| -
| 0,2-0,5
| -
|
| Петух
| -
| 0,2-0,5
| -
|
Олигосперматизм (Озм)— выделение слишком малого количества спермы, значительно меньше минимального объема эякулята. Это явление часто свидетельствует не только о нарушениях динамики рефлекса эякуляции, но и о серьезных погрешностях в кормлении, содержании или эксплуатации производителя.
Асперматизм (Азм)— отсутствие спермы (при поражении половых органов, заращении семяпроводов и т. д.) или же вследствие рефлекторной задержки эякуляции (при болевых ощущениях в области конечностей, таза, поясницы).
У некоторых производителей с повышенной нервной возбудимостью при хорошем появлении других половых рефлексов эякуляция иногда не происходит из-за спазматического сокращения выводных протоков половых органов (А. П. Студенцов).
Цвет спермы характерен для производителей каждого вида сельскохозяйственных животных. Он зависит главным образом от насыщенности спермы спермиями.
В норме сперма барана белая с желтоватым оттенком; сперма быка белая, иногда желтоватая; сперма жеребца серовато-белая (наподобие цвета сильно разбавленного водой молока); сперма хряка сходна по цвету со спермой жеребца.
Изменение обычного цвета спермы свидетельствует о наличии в ней примесей, снижающих ее качество. Если сперма имеет розовый или красноватый цвет (примесь крови), то это говорит о наличии свежей травмы половых органов самца (при травме давнего происхождения цвет спермы будет буро-красный).
Иногда у производителей во время эрекции могут происходить разрывы мелких капилляров уретрального канала, сперма в этих случаях бывает окрашена, свежей кровью в темно-красный цвет.
Зеленоватый цвет спермы указывает на наличие в ней гноя. Хлопья в сперме бывают при воспалении пузырьковидных желез. Интенсивно желтый цвет спермы бывает при попадании в нее мочи.
Запах спермы. Обычно нормальная сперма не имеет особого, специфического запаха, лишь у быка она иногда имеет запах парного молока, а у барана — жиропота. Наличие несвойственного сперме запаха (гнилостного) указывает па какой-либо патологический процесс в мужских половых органах.
Консистенция спермы. В норме сперма барана сметанообразной консистенции; быка — сливкообразной; жеребца—водянистая, часто с примесью слизи; хряка — водянистая, со студенисто-клейкими зернами (секрет куперовых желез).
Если внешние признаки эякулята характеризуются значительными отклонениями от нормальных показателей, то такую сперму не используют. Производитель, выделяющий не нормальную сперму, должен быть всесторонне клинически исследован, ему назначают соответствующее лечение или особый режим содержания и использования.
Порядок работы
На чистое предметное стекло глазной пипеткой наносят каплю свежеполученной спермы быка, барана или птицы и другой пипеткой добавляют каплю 0,01%-го раствора метиленовой сини, приготовленного на физиологическом растворе; капли быстро смешивают и набирают в стеклянную трубочку (капилляр), чтобы столбик был длиной около 2 см. Трубочку кладут на лист белой бумаги и определяют по секундомеру время, в течение которого голубой столбик обесцвечивается. Пробу ставят при температуре 20...22º С (табл.5).
Таблица 5
Оценка качества спермы по времени обесцвечивания метиленовой сини
| Производитель
| Время обесцвечивания спермы, мин
|
| хорошей
| среднего качества
| плохой (непригодной для искусственного осеменения)
|
| Бык
| 5…10
| 11…30
| Более 30
|
| Баран
| 3…7
| 8…12
| Более 12
|
| Петух
| 3…4
| -
| -
|
| Гусак
| 7…9
| -
| -
|
| Индюк
| 4…5
| -
| -
|
Чем интенсивнее поглощается кислород, тем быстрее обесцвечивается краситель, тем выше выживаемость и оплодотворяющая способность спермиев. У жеребца и хряка реакция длится до 60 мин, поэтому спермии у данных животных этим способом не оценивают.
Определение рН спермы.
Концентрацию водородных ионов – рН, определяют электрометрическим методом или универсальными (бумажными) индикаторами по изменению их цвета в зависимости от кислотности среды. Методика изложена в инструкциях по работе с индикаторами. Изменение рН спермы быка и барана в щелочную сторону (рН 7,1) указывает на плохое качество спермы, в кислую (рН 6,5) – на накопление в ней молочной кислоты, pH 6,9-7,0 спермы жеребца и хряка свидетельствуют о хорошем качестве спермы, рН 7,8-8,0 – о низкой жизнеспособности спермиев.
Порядок работы
На обезжиренное спиртом и эфиром стекло наносят небольшую каплю спермы, добавляют к ней каплю 5%-го водного раствора эозина, в течение 1-2 с. смешивают и делают тонкий мазок на предметном стекле. Мазок быстро высыхает на воздухе. Краску готовят на 3%-м растворе цитрата натрия. Для спермы жеребца можно использовать 1%-й Конго-рот, приготовленный на 7%-м растворе глюкозы. Высохший мазок просматривают под микроскопом при увеличении в 400-600 раз. Спермии, бывшие в момент смешивания с краской живыми, хорошо выделяются на розовом фоне своей белой головкой. Мертвые спермии окрашиваются в розовый цвет. Подсчитывают 500 спермиев подряд, отмечая число окрашенных, и вычисляют процент живых и мертвых по формуле:
П = Ж × 100 / 500,
где П – процент живых спермиев; Ж – число живых спермиев; 100 – пересчет на проценты; 500 – общее число посчитанных спермиев. Полученный результат выражают по активности спермиев в баллах.
Порядок работы
Сперму разбавляют следующим образом. Берут одиннадцать пронумерованных пробирок. В первую вносят 0,5 мл неразбавленной спермы, в остальные десять – по 0,5 мл разбавителя. Затем во вторую пробирку наливают 0,5 мл неразбавленной спермы. Перемешав содержимое второй пробирки, из нее берут 0,5 мл смеси и переносят в третью пробирку. Перемешав, 0,5 мл смеси из третьей пробирки переносят в четвертую пробирку и так продолжают до последней. В первой пробирке остается неразбавленная сперма, а в остальных – разбавленная в 2, 4, 8, 16, 32, 64, 128, 256, 512, и 1024 раза (из последней, 11-й пробирки 0,5 мл смеси убирают).
В пробирках сразу и в последующие дни ежедневно под микроскопом оценивают подвижность спермиев (в одно и то же время) при температуре 40° С, смешивая при этом каплю спермы (смеси) из пробирки с каплей 2,9%-го раствора цитрата натрия
Результаты записывают в таблицу и оценивают подвижность спермиев до полного прекращения их поступательного движения.
Абсолютный показатель выживаемости вычисляют по формуле:
S = ∑ at; t = T n +1 – T n -1
2
где S – абсолютный показатель выживаемости спермиев; а – активность спермиев; t – показатель времени, вычесленный по формуле; Тn+1 – время в часах от начала опыта до последующего определения активности; Тn-1 - время в часах от начала опыта до предыдущего определения активности.
Чем выше абсолютный показатель живучести спермы, тем выше качество спермы и разбавителя.
Высокое качество спермы характеризуется следующими требованиями:
- подвижность спермиев в течение 2 – 3 суток должна быть 0,7 – 0,8 балла (при начальной оценке спермы 1 – 0,9);
- оптимум разбавления спермы не менее 8 – 16 раз;
- резистентность не ниже 10 000;
- абсолютный показатель живучести не ниже 120 (он может достигать и до 400);
- продолжительность жизни спермиев при 0º должна сохраняться 10 – 14 суток (до прекращения не только прямолинейно-поступательного, но и колебательного движения спермиев).
Однако следует иметь в виду, что, несмотря на способность спермиев сохранять жизнь до 10 – 14 суток, оплодотворяющую способность они теряют значительно раньше. Поэтому при искусственном осеменении обычно допускается хранение разбавленной спермы при 0º не более 3 суток.
Аналогично можно определять живучесть спермы жеребца и хряка.
Изучение выживаемости спермиев жеребца проводят только в разбавленной сперме, так как в неразбавленной сперме вследствие пагубного действия секретов придаточных желез они прекращают движение через 3-4 часа. Абсолютный показатель живучести спермы у жеребца при правильном его использовании и кормлении в среднем равен 12 – 20, а продолжительность жизни спермиев при 0º обычно колеблется от 36 до 72 часов; если менее 24 часов, то это указывает на их низкую оплодотворяющую способность.
Хорошая сперма быка и барана, разбавленная в 16-32 раза, должна иметь показатель абсолютной выживаемости не ниже 1400, что во времени выражается 8-9 суток (иногда этот показатель достигает 4000). После 3-4 суток хранения подвижность спермиев должна быть не менее 7 баллов.
Хорошая сперма жеребца должна иметь показатель выживаемости не менее 450, или не менее 150 часов, а подвижность спермиев не ниже 5 баллов через 3 суток. У хорошей спермы хряка показатель выживаемости не менее 900 и подвижность спермиев не ниже 6 баллов через 3 суток.
Порядок работы.
Исследуемую свежеполученную сперму, особенно быка и барана, для уменьшения концентрации спермиев и удобства их подсчета в мазке необходимо разбавить 1%-ным раствором хлористого натрия. Сперму барана разбавляют в 20—30, а сперму быка — в 10—15 раз. Для этого к 1 мл (или капле) спермы градуированной или глазной пипеткой прибавляют соответствующее число миллилитров (или капель) 1%-ного раствора хлористого натрия. Сперму жеребца и хряка разбавляют в 2—3 раза или используют для приготовления мазков без разбавления.
Мазок делают с помощью покровного стекла или методом стекающей капли, держа стекло под углом 40—50°. Изменения форм спермиев при этом не наблюдается.
Приготовленный мазок высушивают на воздухе и затем фиксируют. Подсушивать мазки над пламенем спиртовки не рекомендуется, так как при этом спермин деформируются.
Фиксация мазков преследует цель закрепить спермин в таком виде, в каком они выделились из половых путей самца, и не допустить изменения их форм. Для этого предметное стекло с мазком кладут горизонтально на специальные подставки над кюветкой или стеклянной чашкой и непосредственно на мазок с помощью глазной пипетки на 1—2 минуты наслаивают 96° спирт-ректификат. Мазки можно фиксировать и 5%-ным раствором хлористого аммония (нашатыря) в течение часа.
Зафиксированный мазок споласкивают водой и окрашивают.
Окраску мазков проводят фуксином Пфейфера, 0,1 %-ным раствором метиленовой синьки, 1— 2%-ным раствором эозина, фиолетовыми чернилами или какой-либо другой краской. Глазной пипеткой краску толстым слоем наносят на поверхность мазка на 3—5 минут; по истечении указанного времени краску смывают дистиллированной или просто кипяченой водой. Мазок высушивают на воздухе, поставив его вертикально, или подсушивают фильтровальной бумагой.
Микроскопирование и подсчет спермиев проводят при увеличении в 400—600 раз. Передвигая мазок, подсчитывают в каждом поле зрения всех спермиев, учитывая отдельно нормальные и патологические формы спермиев, после чего вычисляют процент патологических. Общее количество подсчитанных спермиев должно быть не менее 500.
Процент патологических форм определяют по формуле:
Пр = Пф * 100
n
где Пр – процент патологических форм спермиев; Пф – количество подсчитанных патологических спермиев; n – общее количество подсчитанных спермиев.
Например: подсчитано всего 500 спермиев, в том числе 50 патологических форм.
Пр = 50*100 ; Пр= 10%
500
Чем меньше в эякуляте производителя патологических спермиев, тем выше оплодотворяющая способность спермы.
При нормальном состоянии и функционировании половых органов производителя количество патологических форм спермиев редко достигает у барана 10—14%, быка 14— 18%, жеребца и хряка 16—20% общего числа их.
Следует учитывать, что чем больше патологических спермиев, тем меньше должна быть степень разбавления спермы.
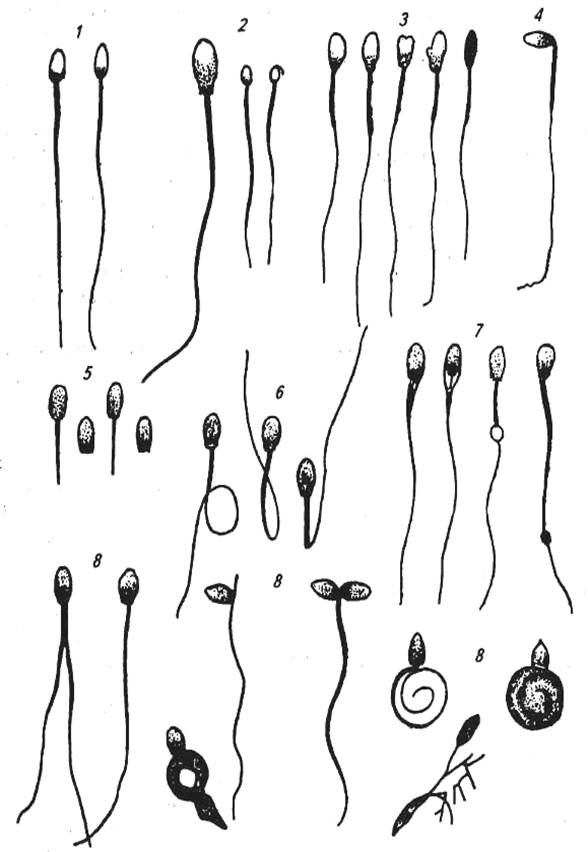
Рис. 10 Нормальные и патологические формы спермиев:
1- нормальные; 2- гигантские и карликовые; 3- с деформацией головки; 4- с надломом шейки; 5- свободные (но ненормальные по форме) головки и бесхвостые спермии; 6- с закручиванием и ненормальным искривлением хвостов; 7- спермии и с каплей и утолщением хвоста; 8- прочие патологические формы.
Порядок работы
На предметное стекло наносят каплю исследуемой спермы, накрываютпокровным стеклом и оценивают на подвижность спермиев в баллах. Вначале каплю просматривают при обычной температуре в лаборатории (18—25°), а затем активность спермиев определяют при более высокой температуре (38—40°), поместив предметное стекло с раздавленной каплей на обогревательный столик Морозова или в термостат.
После этого предметное стекло переносят на 1 – 2 минуты в чашку с тающим льдом или снегом так, чтобы вода не попадала на поверхность стекла. Протерев нижнюю поверхность стекла фильтровальной бумагой, помещают его на столик микроскопа и наблюдают за состоянием спермиев; в дальнейшем проверяют сперму при температуре 18 – 25º, а затем на столике Морозова или в термостате при температуре 38 - 40º.
В результате проведенных опытов устанавливают, что повышение температуры спермы до 38—40° усиливает подвижность спермиев, а понижение до 0° через одну минуту приводит к прекращению их движения. При постепенном повышении температуры охлажденной до 0° спермы подвижность части спермиев восстанавливается, но большинство спермиев погибает от холодового удара. Холодовому удару наиболее подвержена свежеполученная сперма.
Осмотическое давление. Под воздействием гипотонических растворов наблюдают набухание головки спермия, закручивание хвоста, манежное движение и быструю гибель, особенно в дистиллированной воде (хорошо видно под микроскопом, если на предметное стекло нанести каплю спермы и рядом каплю воды). Поэтому при работе со спермой нужно предупреждать попадание в нее воды.
Гипертонические растворы также отрицательно влияют на спермиев. Под действием 3%-го раствора хлорида натрия наступает быстрая гибель спермиев из-за обезвоживания.
Изотонические растворы влияют благоприятно, если их готовят на дистиллированной воде из химически чистых веществ: 0,9... 1%-й раствор хлорида натрия, 2,8...2,9%-й цитрата натрия, 6...6,5%-й глюкозы и др. Концентрация растворенных веществ в сперме животных разных видов несколько колеблется.
При работе со спермой следует учитывать ее буферность и реакцию.
Давление растворенного вещества называется осмотическим и исчисляется в атмосферах. Осмотическое давление увеличивается параллельно с повышением процента растворенных веществ в жидкости.
Сперма животных имеет относительно постоянное осмотическое давление, величина которого составляет около 7 атмосфер, причем осмотическое давление сыворотки спермы и протоплазмы спермиев примерно одинаковое, так как для жизни спермиев требуется/чтобы в жидкой части спермы было растворено столько веществ, сколько их находится внутри спермиев.
В том случае, когда осмотическое давление окружающей жидкости будет равно осмотическому давлению спермиев, такой раствор будет называться изотоническим. Если растворенных веществ в окружающем растворе меньше или больше, чем в протоплазме, то раствор будет гипотоническим или гипертоническим, что губительно влияет на жизнь спермиев. И. И. Иванов установил, что спермин лучше переносят слегка гипертонические растворы, чем гипотонические.
Порядок работы
Перед проведением опытов исследуемую сперму оценивают на подвижность, после чего изучают влияние на спермиев изотонического, гипотонического и гипертонического растворов хлористого натрия, Для этого к каплям спермы добавляют соответственно каплю 1%-ного раствора хлористого натрия, каплю дистиллированной или кипяченой воды или 0,5%-ного раствора NaCl и каплю 3%-ного раствора хлористого натрия.
Наблюдая за результатами действия вышеуказанных растворов на спермиев под микроскопом при увеличении в 120—280 раз, устанавливают следующее.
1. При добавлении к сперме 1%-го раствора хлористого натрия движение спермиев не только не прекращается, а даже несколько активизируется. Однако, при длительном нахождении спермиев в данном растворе под влиянием ионов хлора липоидная оболочка набухает и разрушается. Поэтому 1%-ый раствор хлористого натрия не применяют в качестве разбавителя спермы.
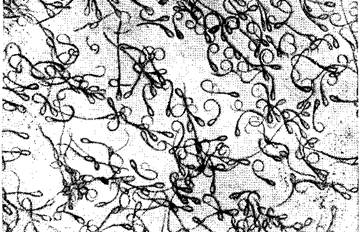
2. От прибавления к сперме воды, спермии вследствие проникновения воды внутрь клетки набухают и погибают. У части спермиев можно наблюдать закручивание хвостов (рис.11)
3. Под влиянием 3%-го (гипертонического) раствора хлористого натрия происходит обезвоживание спермиев, в результате чего они в течение 1 – 2 минут погибают.
Рис. 11 Закручивание хвостов спермиев при воздействии дистиллированной воды (по В.К. Милованову)
Влияние химических веществ и медикаментов. На спермин губительно действуют все дезинфицирующие вещества (их растворы, пары, соединения) — йод, эфир, скипидар, нашатырный спирт, креолин, лизол, кислоты, щелочи и соли тяжелых металлов: ртути, меди, свинца, железа и др. Поэтому при работе со спермой запрещается их использовать даже в минимальных концентрациях. В помещениях, предназначенных для работы со спермой, нельзя хранить медикаменты, дезинфицирующие вещества, курить. Инструменты, посуду содержат в чистоте. В качестве дезинфицирующих и моющих средств рекомендованы спирт-ректификат, бикарбонат натрия и кальцинированная сода, растворы фурацилина (1:5000), фуразолидона (1:10000). Нельзя использовать спиртовые суррогаты (спирт технический, денатурат и др.).
Посуду, приборы и инструменты стерилизуют кипячением, сухим жаром, фламбированием, текучим паром, автоклавированием.
Чтобы подавить развитие микрофлоры в сперме, в разбавители (среды) можно добавлять антибиотики (пенициллин, стрептомицин и др.), сульфаниламиды (белый стрептоцид и др.), а также их смеси (спермосан, поливен, полиген), которые в определенных концентрациях не оказывают вредного влияния на спермиев.
Порядок работы
После оценки спермы на подвижность выявляют действие на спермиев различных химических веществ. Для этого каждый, раз на чистое предметное стекло наносят новую каплю спермы и действуют на нее тем или иным испытуемым раствором (1%-ым раствором молочной кислоты, 1%-ым раствором лизола; 2%-ным раствором двууглекислой соды, раствором фурацилина 1: 5000, раствором марганцовокислого калия 1: 2000 и 65° спиртом). Капли перемешивают стеклянной палочкой, накрывают покровным стеклом, просматривают под микроскопом иустанавливают время, через которое наступит прекращение движения спермиев.
Действие на спермиев йода определяют так: на предметное стекло вокруг капли спермы наносят несколько капель настойки йода, которые можно соединить сплошным кольцом; не накрывая каплю спермы покровным стеклом, ее просматривают под микроскопом через 1, 2 и 3 минуты. В процессе проведения опытов устанавливают:
1. Растворы молочной кислоты, лизола, марганцовокислого калия, 65º спирт вызывает гибель спермиев в течение 1 – 2 минут, а раствор фурацилина за 2 – 3 минуты.
2. 2%-ый раствор двууглекислой соды вызывает резкое снижение активности спермиев, а через 2 – 4 минуты наступает полное прекращение движение и гибель спермиев.
3. Улетучивающиеся из настойки йода свободный йод губительно действует на спермиев. В результате подвижность их прекращается, быстро наступает гибель. Проникновение и накопление йода в сперме подтверждается пожелтение капли.
Свет. Рассеянный свет не оказывает вредного влияния на спермиев, в отличие от прямого солнечного, который за счет воздействия ультрафиолетовых и инфракрасных лучей вызывает гибель спермиев в течение 20...30 мин. Поэтому всю работу со спермой выполняют в помещениях с занавешенными окнами. При осеменении самок на улице инструменты (приборы) со спермой закрывают матерчатыми салфетками или чехлами.
Библиографический список
1. Гончаров В.П. Акушерство, гинекология и биотехника размножения животных / В.П. Гончаров, Д.А. Черепахин. – М.: Колос, 2004.
2. Заянчковский И.Ф. Практикум по искусственному осеменению сельскохозяйственных животных/ И.Ф. Заянчковский, В.Г. Мартынов, Е.И. Селунская. – М.: Сельхозиздат, 1961.
3. Михайлов Н.Н. Акушерство, гинекология и искусственное осеменение сельскохозяйственных животных / Н.Н. Михайлов, Г.В. Паршутин, Н.Е.Козло и др. – М.: Агропрмиздат, 1990.
4. Небогатиков Г.В. Практикум по акушерству, гинекологии и биотехнике размножения животных. – М.: Мир, 2005.
5. Никитин В.Я. Практикум по акушерству, гинекологии и биотехнике размножения животных/ В. Я. Никитин, М.Г. Миролюбов, В.П. Гончаров и др. - М.: Колос, 2003. – 208 с.
6. Студенцов А.П. Ветеринарное акушерство и гинекология / А.П. Студенцов, В.С. Шипилов, Л.Г. Субботина и др. – 6-е изд., испр. И доп. – М: Агропромиздат, 1986. – 480 с.
7. Студенцов А.П. Ветеринарное акушерство и гинекология / А.П. Студенцов. – 3-е изд. - М.: Сельхозиздат, 1961. – 524 с.
8. Храмцов В.В. Акушерство и гинекология сельскохозяйственных животных / В.В. Храмцов, Т.Е. Григорьева, В.Я Никитин и др. – М: Колос, 2007. – 197 с.
9. Шипилов В.С. Практикум по акушерству, гинекологии и искусственному осеменению сельскохозяйственных животных/ В.С. Шипилов. Г.В. Зверева, И.И. Родин, В. Я. Никитин. - М.: Агропромиздат, 1979 (изд. 2-е), 1988 (изд. 3-е).
Методы оценки качества спермы
Методические указания
Новосибирск 2009
УДК
Составитель:
В.М. Сороколетова, В.А. Напримеров
Рецензенты:
Методы оценки качества спермы: метод. указ. / Новосиб. гос. аграр. ун-т.
Ин-т. вет. мед.; сост.: В.М. Сороколетова, В.А. Напримеров. – Новосибирск, 2009. – 27 с.
Методические указания предназначены для студентов ветеринарного и биологотехнологического институтов очной и заочной форм обучения, а также могут быть полезны для слушателей курсов специализации «Ветеринарный врач – гинеколог» и зооветспециалистам, решающим вопросы воспроизводства животных на сельскохозяйственных предприятиях.
© Новосибирский государственный аграрный университет, 2009
СОДЕРЖАНИЕ
.
1. Введение……………………………………………………....4
2. Физиология и биохимия спермы…………………………….4
3. Макроскопическая оценка спермы…………………………..9
4. Микроскопическая оценка спермы…………………………11
5. Влияние условий внешней среды на спермии……………..24
6. Библиографический список…………………………………27
ВВЕДЕНИЕ
Полученную от производителей сперму используют для искусственного осеменения самок только после предварительной всесторонней оценки ее качества. Это позволяет определить пригодность производителя к использованию для искусственного осеменения самок.
Качество спермы подвержено резким изменениям в зависимости от условий кормления, содержания и половой эксплуатации производителя, а также от состояния его здоровья. Болезни органов половой и других систем организма оказывают большое влияние на количество и качество спермы, выделяемой производителем.
По отклонениям показателей качества спермы от средней нормы судят о нарушении условий кормления и содержания производителя или режима его полового использования. Это дает возможность быстро исправлять допущенные погрешности и сохранять нормальную плодовитость производителя на длительный срок.
Высокая оплодотворяющая способность или импотенция производителей, а также плодовитость или бесплодие осемененных их спермой самок находятся в прямой зависимости от качества спермы. Поэтому в искусственном осеменении оценка качества спермы имеет чрезвычайно важное значение.