

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Введение
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. Почти в 5 раз легче меди, в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния.
Плавится магний при температуре 651 оС, но в обычных условиях расплавить его довольно трудно: нагретый на воздухе до 550 оС он вспыхивает и мгновенно сгорает ослепительно ярким пламенем. Полоску магниевой фольги легко поджечь обыкновенной спичкой, а в атмосфере хлора магний самовозгорается даже при комнатной температуре. При горении магния выделяется большое количество ультрафиолетовых лучей и тепла - чтобы нагреть стакан ледяной воды до кипения, нужно сжечь всего 4 г. магния.
Магний расположен в главной подгрупп второй группы периодической системы элементов Д.И. Менделеева. Порядковый номер его - 12, атомный вес - 24,312. Электронная конфигурация атома магния в невозбужденном состоянии 1S22S2P63S2; валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность II. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации; поэтому магний в химическом отношении очень активен.
На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. Нормальный электронный потенциал магния в кислой среде равен -2,37в, в щелочной - 2,69в. В разбавленных кислотах магний растворяется уже на холоде. Во фтористоводородной кислоте не растворим вследствие образования пленки из труднорастворимого в воде фторида MgF2; в концентрированной серной кислоте почти не растворим. Магний легко растворяется при действии растворов солей аммония. Растворы щелочей на него не действуют. Магний поступает в лаборатории в виде порошка или лент. Если поджечь магниевою ленту, то она быстро сгорает с ослепительной вспышкой, развивая высокую температуру. Магниевые вспышки применяют в фотографии, в изготовлении осветительных ракет. Температура кипения магния 1107 оС, плотность = 1,74 г/см3, радиус атома 1,60 НМ.
|
|
Описание химико-технологической схемы производства магния
В настоящее время наряду с развитием электролитического способа совершенствуются силикотермический и карботермический способы получения магния. На первой стадии развития магниевой промышленности в качестве сырья применяли хлористые соли карналлит, природные рассолы, хлоромагниевые щёлочи калийной промышленности.
Основной способ производства магния - электролитический. Электролитическое получение магния из водных растворов невозможно, так как электрохимический потенциал магния значительно более отрицательный, чем потенциал разряда ионов водорода на катоде. Поэтому электролиз магния ведут из его расплавленных солей.
Mg2+ 2Cl-
К -) А +)
Mg2+ +2e Mg0 2Cl- -2e Cl20
ЭЛЛЕКТРОЛИ3
MgCl2 2Mg + 2Cl2
Магний твердый отход хлор
Основная составляющая электролита - хлористый магний МgCl2, а для снижения температуры плавления электролита и повышения его электропроводности в него вводят NаСl, СаСl2, КСl и небольшие количества NaF и СаF2.
Основным сырьем для получения магния являются карналлит (МgСl2•КСl•6Н2О), магнезит (МgСО3), доломит (СаСО3•МgСО3), бишофит (МgСl2•6Н2О). Наибольшее количество магния получают из карналлита. Обогащение карналлита является первой стадией его переработки. Сущность процесса обогащения сводится к отделению КСl и нерастворимых примесей путем перевода в водный раствор МgСl2 и КСl. При охлаждении полученного раствора в вакуум-кристаллизаторах выпадают кристаллы искусственного карналлита МgСl2•КСl•6Н2О, которые отделяют фильтрованием.
|
|
Карналлит обезвоживают в две стадии. Первую стадию проводят в трубчатых печах или печах кипящего слоя при 550-600° С. Под действием теплоты нагретых газов карналлит обезвоживается и после такой обработки содержит 3-4% влаги. Вторую стадию обезвоживания осуществляют либо плавкой полученного после первой стадии карналлита в электропечах с последующим отстаиванием окиси магния, либо хлорированием карналлита в расплавленном состоянии.
Электролитическое получение магния. Для этой цели применяют электролизер, который изнутри футерован шамотным кирпичом. Анодами служат графитовые пластины, а катодами - стальные пластины, расположенные по обе стороны анода. Для электролитического разложения хлористого магния через электролит пропускают ток под напряжением 2,7-2,8 В. В результате электролитического разложения хлористого магния образуются ионы хлора, которые движутся к аноду и после разряда создают пузырьки хлора, выходящие из электролита. Ионы магния движутся к катоду и после разряда выделяются на поверхности, образуя капельки жидкого магния.
Магний имеет меньшую плотность, чем электролит, поэтому он всплывает на его поверхность в катодном пространстве, откуда периодически удаляется с помощью вакуумного ковша. В процессе электролиза в электролите повышается концентрация других хлоридов за счет расходования МgСl2. Поэтому периодически часть отработанного электролита удаляют из ванны и вместо него заливают расплав МgСl2 или карналлита. В результате частичного разложения примесей на дне ванны образуется шлам, который регулярно удаляют из ванны. Кроме магния при электролизе получают также Cl2.
Разработан и другой способ получения магния - термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс или кремний.
+ C = Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
·MgCO3 = CaO + MgO + 2CO2,
2MgO + 2CaO + Si = Ca2SiO4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.
|
|
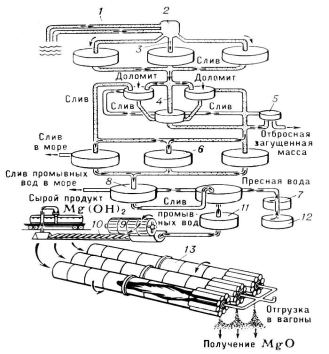
Рис.1
2. Вредные вещества, образующиеся в результате получения магния:
Cl2
CO2
СО
NaF
CaF2
Паспорта загрязнителей
Профилактика:
· Работы осуществлять в хорошо проветриваемых помещениях
· Проверять открытие заслонок при использовании в домах печей и каминов
· За качество сжатого воздуха в аквалангах <http://ru.wikipedia.org/wiki/%D0%90%D0%BA%D0%B2%D0%B0%D0%BB%D0%B0%D0%BD%D0%B3> отвечает компрессорщик <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%BC%D0%BF%D1%80%D0%B5%D1%81%D1%81%D0%BE%D1%80>. Опасно принимать на эту работу никотино <http://ru.wikipedia.org/wiki/%D0%9D%D0%B8%D0%BA%D0%BE%D1%82%D0%B8%D0%BD>-зависимых, страдающих табакокурением <http://ru.wikipedia.org/wiki/%D0%A2%D0%B0%D0%B1%D0%B0%D0%BA%D0%BE%D0%BA%D1%83%D1%80%D0%B5%D0%BD%D0%B8%D0%B5> людей. Курить поблизости от компрессора строго запрещается. Компрессор ни в коем случае не должен стоять рядом с автомобилями и работающими двигателями внутреннего сгорания.
14. Первая помощь: Лечение: Необходимо немедленно устранить источник загрязненного воздуха и обеспечить дыхание чистым кислородом под повышенным парциальным давлением 2,5-3 атм.
· Убрать пострадавшего из помещения с высоким содержанием угарного газа (заменить дыхательный аппарат).
· При слабом поверхностном дыхании или его остановке начать искусственное дыхание.
· Способствуют ликвидации последствий отравления: растирание тела, прикладывание грелки к ногам, кратковременное вдыхание нашатырного спирта. Больные с тяжёлым отравлением подлежат госпитализации, так как возможны осложнения со стороны лёгких и нервной системы в более поздние сроки.
· Для купирования судорог и психомоторного возбуждения можно применять нейролептики, например аминазин (1-3 мл 2,5% раствора внутримышечно, предварительно разведя в 5 мл 0,5% стерильного раствора новокаина) или хлоралгидрат в клизме. Противопоказаны: бемегрид, коразол <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%B0%D0%B7%D0%BE%D0%BB>, аналептическая смесь, камфара, кофеин.
· При нарушении дыхания - по 10 мл 2,4% раствора эуфиллина в вену повторно.
· При резком цианозе (посинении), в 1-й час после отравления показано внутривенное введение 5% раствора аскорбиновой кислоты (20-30 мл) с глюкозой. Внутривенное вливание 5% раствора глюкозы (500 мл) с 2% раствором новокаина (50 мл), 40% раствор глюкозы в вену капельно (200 мл) с 10 единицами инсулина под кожу.
|
|
15. Средства защиты: CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) - гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух.
16. Другие показатели: Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв монооксид углерода выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа. В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена). Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (недостаточно кислорода для окисления CO в CO2.
Выводы
При выполнении курсовой работы была определена номенклатура отходов производства магния, которые являются основной причиной негативного воздействия данного производства на среду обитания человека. Были составлены паспорта загрязнителей отходов и паспорт опасности основных твердых отходов, которые позволяют получить достоверную информацию обязательного характера, необходимую для принятия решений любого уровня о порядке обращения с отходами в зависимости от вида и степени их опасности для здоровья и жизни людей, для обеспечения требований охраны окружающей среды, а также о необходимых и целесообразных способах их использования и обезвреживания.
В условиях дефицита магния также актуальной является задача более рационального использования имеющихся ресурсов металла, сокращение потерь его на всех этапах переработки и использования. Например, более эффективно может быть использован вторичный магниевый сплав типа МА9С6 для легирования алюминиевых сплавов взамен первичного металла. Предпочтительнее выглядит и прямое использование отходов из магниевых сплавов в виде брикетов стружки взамен чушкового металла, например, для десульфурации или модифицирования чугуна, производстве модификаторов типа железо-кремний-магний. Использование магния в аппаратах космической и авиационной техники, автомобилестроении, различных агрегатах и ответственных приборах предъявляя особые требования к технологии производства литья из магниевых сплавов. Потребность народного хозяйства в магнии и магниевых сплавах значительно превышает возможность их производства. Это ставит перед металлургами, технологами и разработчиками новые проблемы повышения качества литья, использования лома и стружки, создание безотходных и малоотходных технологий производства. Обостряются вопросы экологии.
|
|
Литература
1. Вредные вещества в промышленности т 1,2. Справочник/Под ред. В.Н. Лазарева.-М.:Химия,1976(77).
2. Кирюшкин А.А., Капитоненко З.В., Петров С.И. Определение номенклатуры отходов промышленного производства, составление паспортов загрязнителей и опасности отходов: Методические оказания к курсовой работе. СПб.: СПбГТИ (ТУ), 2003.
3. Справочник химика,т.2.М.:Химия,1966.
4. ГОСТ 12.1.005-88 ССБТ Общие санитарно-гигиенические требования к воздуху рабочей зоны.
. ГОСТ 30774-2001 Паспорт опасности отходов.
6. Беспамятнов Г.П., Кротов Ю.А. Предельно допустимые концентрации химических веществ в окружающей среде.- Л.:Химия, 1985-528с
Ено н
Введение
Магний - серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества. Почти в 5 раз легче меди, в 4,5 раза легче железа; даже алюминий в 1,5 раза тяжелее магния.
Плавится магний при температуре 651 оС, но в обычных условиях расплавить его довольно трудно: нагретый на воздухе до 550 оС он вспыхивает и мгновенно сгорает ослепительно ярким пламенем. Полоску магниевой фольги легко поджечь обыкновенной спичкой, а в атмосфере хлора магний самовозгорается даже при комнатной температуре. При горении магния выделяется большое количество ультрафиолетовых лучей и тепла - чтобы нагреть стакан ледяной воды до кипения, нужно сжечь всего 4 г. магния.
Магний расположен в главной подгрупп второй группы периодической системы элементов Д.И. Менделеева. Порядковый номер его - 12, атомный вес - 24,312. Электронная конфигурация атома магния в невозбужденном состоянии 1S22S2P63S2; валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность II. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации; поэтому магний в химическом отношении очень активен.
На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. Нормальный электронный потенциал магния в кислой среде равен -2,37в, в щелочной - 2,69в. В разбавленных кислотах магний растворяется уже на холоде. Во фтористоводородной кислоте не растворим вследствие образования пленки из труднорастворимого в воде фторида MgF2; в концентрированной серной кислоте почти не растворим. Магний легко растворяется при действии растворов солей аммония. Растворы щелочей на него не действуют. Магний поступает в лаборатории в виде порошка или лент. Если поджечь магниевою ленту, то она быстро сгорает с ослепительной вспышкой, развивая высокую температуру. Магниевые вспышки применяют в фотографии, в изготовлении осветительных ракет. Температура кипения магния 1107 оС, плотность = 1,74 г/см3, радиус атома 1,60 НМ.
Описание химико-технологической схемы производства магния
В настоящее время наряду с развитием электролитического способа совершенствуются силикотермический и карботермический способы получения магния. На первой стадии развития магниевой промышленности в качестве сырья применяли хлористые соли карналлит, природные рассолы, хлоромагниевые щёлочи калийной промышленности.
Основной способ производства магния - электролитический. Электролитическое получение магния из водных растворов невозможно, так как электрохимический потенциал магния значительно более отрицательный, чем потенциал разряда ионов водорода на катоде. Поэтому электролиз магния ведут из его расплавленных солей.
Mg2+ 2Cl-
К -) А +)
Mg2+ +2e Mg0 2Cl- -2e Cl20
ЭЛЛЕКТРОЛИ3
MgCl2 2Mg + 2Cl2
Магний твердый отход хлор
Основная составляющая электролита - хлористый магний МgCl2, а для снижения температуры плавления электролита и повышения его электропроводности в него вводят NаСl, СаСl2, КСl и небольшие количества NaF и СаF2.
Основным сырьем для получения магния являются карналлит (МgСl2•КСl•6Н2О), магнезит (МgСО3), доломит (СаСО3•МgСО3), бишофит (МgСl2•6Н2О). Наибольшее количество магния получают из карналлита. Обогащение карналлита является первой стадией его переработки. Сущность процесса обогащения сводится к отделению КСl и нерастворимых примесей путем перевода в водный раствор МgСl2 и КСl. При охлаждении полученного раствора в вакуум-кристаллизаторах выпадают кристаллы искусственного карналлита МgСl2•КСl•6Н2О, которые отделяют фильтрованием.
Карналлит обезвоживают в две стадии. Первую стадию проводят в трубчатых печах или печах кипящего слоя при 550-600° С. Под действием теплоты нагретых газов карналлит обезвоживается и после такой обработки содержит 3-4% влаги. Вторую стадию обезвоживания осуществляют либо плавкой полученного после первой стадии карналлита в электропечах с последующим отстаиванием окиси магния, либо хлорированием карналлита в расплавленном состоянии.
Электролитическое получение магния. Для этой цели применяют электролизер, который изнутри футерован шамотным кирпичом. Анодами служат графитовые пластины, а катодами - стальные пластины, расположенные по обе стороны анода. Для электролитического разложения хлористого магния через электролит пропускают ток под напряжением 2,7-2,8 В. В результате электролитического разложения хлористого магния образуются ионы хлора, которые движутся к аноду и после разряда создают пузырьки хлора, выходящие из электролита. Ионы магния движутся к катоду и после разряда выделяются на поверхности, образуя капельки жидкого магния.
Магний имеет меньшую плотность, чем электролит, поэтому он всплывает на его поверхность в катодном пространстве, откуда периодически удаляется с помощью вакуумного ковша. В процессе электролиза в электролите повышается концентрация других хлоридов за счет расходования МgСl2. Поэтому периодически часть отработанного электролита удаляют из ванны и вместо него заливают расплав МgСl2 или карналлита. В результате частичного разложения примесей на дне ванны образуется шлам, который регулярно удаляют из ванны. Кроме магния при электролизе получают также Cl2.
Разработан и другой способ получения магния - термический. В этом случае для восстановления оксида магния при высокой температуре используют кокс или кремний.
+ C = Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции:
·MgCO3 = CaO + MgO + 2CO2,
2MgO + 2CaO + Si = Ca2SiO4 + 2Mg.
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырье, но и морскую воду.

Рис.1
2. Вредные вещества, образующиеся в результате получения магния:
Cl2
CO2
СО
NaF
CaF2
Паспорта загрязнителей
|
|
|

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!