

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Теория МОЛКАO
бор аппроксимация комптоновский нитрид
Метод молекулярных орбиталей (МО) представляет собой применение одноэлектронной модели в теории атомов и многоатомным системам. Идея одноэлектронного приближения состоит в следующем.
Одноэлектронная модель основана на допущении, что действие на данный электрон всех ядер и всех остальных электронов системы приближённо можно заменить действием некоторого усредненного «эффективного поля», потенциальная энергии электрона в котором - так называемый «эффективный одиоэлектронный потенциал»
V=V(r)=V (x, y, z)  (1.1)
(1.1)
Зависит только от координат этого электрона.
Стационарные состояния электрона характеризуются определённым во всём трехмерном пространстве одноэлектронными волновыми функциями
 (1.2)
(1.2)
В теории атомов одноэлектронные функции называются орбиталями.
Стационарным состоянием атома соответствуют определённые энергетические уровни. Таким образом, последовательности одноэлектронных орбиталей  (1..1) соответствует последовательность одноэлектронных уровней
(1..1) соответствует последовательность одноэлектронных уровней  (1.4) или одноэлектронный энергетический спектр системы.
(1.4) или одноэлектронный энергетический спектр системы.
Одноэлектронные уровни и орбитали определяются из одноэлектронного уравнения Шрёдингера для стационарных состояний. В атомной системе единиц  это уравнение имеет вид:
это уравнение имеет вид:
 (1.5)
(1.5)
или  (1.6)
(1.6)
 (1.7)
(1.7)
Таким образом, в одноэлектронном приближении любая задача теории атомов, молекул или кристаллов сводится к решению уравнения (1.5).
Метод молекулярных орбиталей (МО) предполагает два дополнительных допущения.
. Адиабатическое приближение (приближение Борна-Оппенгеймера). В многотомной системе креме движения электронов необходимо учитывать относительное движение ядер. Однако в виду того, что ядра в 
 раз тяжелее электронов, при изучении движения электронов ядра в большинстве случаев можно считать неподвижными.
раз тяжелее электронов, при изучении движения электронов ядра в большинстве случаев можно считать неподвижными.
|
|
. Валентное приближение. Считается, что заметное участие в связи принимают не все электроны атомов, составляющих молекулу или кристалл, а только валентные электроны.
Таким образом, в адиабатическом и валентном приближениях основной задачей теории химической связи является нахождение одноэлектронных уровней и одноэлектронных орбиталей системы путём решения уравнения Шредингера (1.5). Здесь эффективный одноэлектронный потенциал (1.1) действующий на каждый валентный электрон, считается суммой потенциалов атомных остовов плюс результирующий потенциал всех остальных валентных электронов системы. Под решением уравнения (1.5) подразумевается приближённое решение, так как потенциал (1.1) для молекулы или кристалла более сложен, чем для атома.
Разумно предположить, что в районе любого данного атома потенциал V всей системы близок к потенциалу именно одного атома тогда можно считать, что каждое решение уравнения Шрёдингера для всей системы в районе данного атома также близко к решению уравнения для этого атома, то есть к какой-либо его атомной орбита (АО). Наиболее простым и удобным с математической точки зрения способом получения одноэлектронной функции является линейная комбинация АО всех атомов, входящих в систему. Известно, что атомные функции экспоненциально убывают по мере удаления от ядра. Поэтому в районе каждого атома вклад АО других атомов мал и любая функция указанного вида сведется лишь к АО данного атома.
Данный метод, решения уравнения Шрёдингера для многоатомной системы путём разложения собственных функций эффективного одноэлектронного гамильтониана в сумму АО называется методом линейной комбинации атомных орбиталей (ЛKAO).
Рассмотрим метод ЛКАО подробнее. Допустим, мы имеем систему, состоящую из произвольного числа атомов, каждый из которых может иметь, любое число атомных орбиталей. Пусть  (1.8) - атомные орбитали всех этих атомов, пронумерованные в произвольном порядке от 1 до m. Тогда в методе ЛКАО любое решение уравнения Шрёдингера для нашей системы запишется в виде
(1.8) - атомные орбитали всех этих атомов, пронумерованные в произвольном порядке от 1 до m. Тогда в методе ЛКАО любое решение уравнения Шрёдингера для нашей системы запишется в виде
|
|
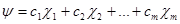 (1.9)
(1.9)
где  - неизвестные коэффициенты, значения которых определяют данное решение уравнения Шредингера (1.5) Чтобы их найти, подставим разложение (1.9) и уравнение (1.6):
- неизвестные коэффициенты, значения которых определяют данное решение уравнения Шредингера (1.5) Чтобы их найти, подставим разложение (1.9) и уравнение (1.6):

 (1.10)
(1.10)
Откуда получим:
 (1.11)
(1.11)
Будем последовательно умножать (1.11) на АО (1.8), интегрируя каждый раз полученное выражение но всему пространству. Считаем, что АО соседних атомов незначительно перекрываются. Соответствующие интегралы перекрывания
 (1.12)
(1.12)
малы и эти АО приближённо ортогональны. Тогда мы получим систему однородных алгебраических уравнении:
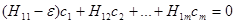
 (1.13)
(1.13)


где  - матричные элементы эффективного одноэлектронного гомельтониана
- матричные элементы эффективного одноэлектронного гомельтониана  системы в базисе из АО:
системы в базисе из АО:
 (1.14)
(1.14)
Они выражаются через известный гамильтониан системы  , и через АО (1.8), которые также известны.
, и через АО (1.8), которые также известны.
Узким образом, неизвестные коэффициенты  в разложении собственной функции (1.9) буду решениями системы уравнений с известными коэффициентами и могут быть определены, если найти предварительно неизвестные собственные значений
в разложении собственной функции (1.9) буду решениями системы уравнений с известными коэффициентами и могут быть определены, если найти предварительно неизвестные собственные значений  .Чтобы система (1.13) имела решения, необходимо выполнение следующего условие:
.Чтобы система (1.13) имела решения, необходимо выполнение следующего условие:






 (1.15)
(1.15)
Детерминант (1.15) называется вековым детерминантом.
Существующее вековое уравнение (1.15) является алгебраическим сравнением М-ой степени. Оно имеет М корней  , которые дают М возможных одноэлектронных уровнений нашей системы. Подставляя последовательно каждый из корней систем (1.13) и определяя из нее известные коэффициенты,
, которые дают М возможных одноэлектронных уровнений нашей системы. Подставляя последовательно каждый из корней систем (1.13) и определяя из нее известные коэффициенты,  мы каждый paз получаем собственную функцию, отвечающую данному уровню. Таким образом, вековое уравнение (1.15) в совокупности с системой (1.13) дает набор искомых одноэлектронных уровней вместе с соответствующими с одноэлектронными функциями.
мы каждый paз получаем собственную функцию, отвечающую данному уровню. Таким образом, вековое уравнение (1.15) в совокупности с системой (1.13) дает набор искомых одноэлектронных уровней вместе с соответствующими с одноэлектронными функциями.
Полученные решения уравнении Шрйдингера необходимо пронормировать, помножив на соответствующий нормировочный множитель, равный для каждой собственной функции (1.9) величине

Элемента матрицы в (1.15) считаются параметрами. Диагональные элементы называются кулоновскими интегралами. Считается, что кулоновский интеграл зависит только от вида атома, которому принадлежит орбитам. Величина кулоновского интеграла близка к энергии ионизации и соответствующего атома, взятой со шпаком минус Недиагональные элементы называют резонансными интегралами или интегралами взаимодействия атомных орбиталей. Они описывают взаимодействие АО различных параметров в молекуле или кристалле. Для орбиталей, принадлежащих непосредственно связанным атомам, резонансные интегралы обычно полагают равными нулю.
|
|
Рассмотрим для простоты гетероядерную молекулу всего лишь с двумя атомными орбиталями. Для коэффициентов МО
 (1.16)
(1.16)
имеем систему
 (1.17)
(1.17)
с нетривиальными решениями при

 (1.18)
(1.18)
откуда
 (1.19)
(1.19)
В пренебрежении перекрыванием и переносом 

 (1.20)
(1.20)
то есть энергии, уровней равны средним энергиям электрона в атомных (несвязанных) состояниях 1 и 2. Первый уровень характеризует отталкивает, и соответствующая орбиталь называется разрыхляющей. Второй уровень отвечает соединению атомов и образованию химической связи, поэтому вторая орбиталь называется связывающей.
В приближении с слабой ковалентностью

 (1.21)
(1.21)
при 
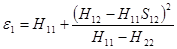 (1.22)
(1.22)
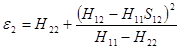 (1.23)
(1.23)
 (1.24)
(1.24)
 (1.25)
(1.25)
где  - параметр ковалентности для связывающей и разрыхляющей МО.
- параметр ковалентности для связывающей и разрыхляющей МО.
Приближение  -гибридизации
-гибридизации
Концепция гибридизации орбиталей - удобный математический, широко применяющийся при трактовке образования ковалентных связей.
При взаимодействии (перекрывании) атомных орбиталей, принадлежащих двум (или более) атомам, образуются молекулярные орбитали (МО) Причем их число равно числу исходных АО;

Молекулярные орбитали заселяются обобществленными электронами и таким образом осуществляй г ковалентную связь.
Образованию молекулярных орбиталей может предшествовать взаимодействие атомных орбигалей одного атома, приводящее к гибридизации (смешению) этих орбиталей возникновению гибридных АО Гибридные орбитали в свою очередь могут участвовать в образовании молекулярных орбиталей, неперекрываясь с атомными орбиталши других атомов. Гибридизация атомных орбиталей возможна лишь для атомов, образующих химические связи, но не для свободных атомов.
|
|
Итвестно, что атом кубического нитрида бора имеет четыре 2s2 р валетных электрона. Будем полагать, что атом кубического нитрида бора, образуя валентную химическую связь, переходит в возбужденное 2s 2p3 состояние. При этом одна s- и три р-орбитали смешиваются, и образуются четыре равноценные по форме и энергии sр3-гибридные орбитали. Используя квантовомеханический принцип суперпозиции - построим  -гибридные волновые функции.
-гибридные волновые функции.


 (2.1)
(2.1)

Здесь  ,
,  ,
,  ,
,  - волновые функции 2s- и 2 р электронов атома кубического нитрида бора.
- волновые функции 2s- и 2 р электронов атома кубического нитрида бора.
|
|
|

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!