

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Определенному значению n соответствует  различных состояний, отличающихся l и
различных состояний, отличающихся l и  . Так как
. Так как  может принимать лишь два значения (
может принимать лишь два значения ( ), то максимальное число электронов, находящихся в состояниях с данным n, будет равно
), то максимальное число электронов, находящихся в состояниях с данным n, будет равно 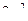 . Совокупность электронов в многоэлектронном атоме, имеющих одно и то же квантовое число n, называют электронной оболочкой. В каждой электроны распределяются по подоболочкам, соответствующих данному l. Максимальное число электронов в подоболочке с данным l равно
. Совокупность электронов в многоэлектронном атоме, имеющих одно и то же квантовое число n, называют электронной оболочкой. В каждой электроны распределяются по подоболочкам, соответствующих данному l. Максимальное число электронов в подоболочке с данным l равно  . Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам представлены в таблице.
. Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам представлены в таблице.
Периодическая система элементов Менделеева. С помощью принципа Паули можно объяснить Периодическую систему элементов. Химические и некоторые физические свойства элементов определяются внешними валентными электронами. Поэтому периодичность свойств химических элементов непосредственно связана с характером заполнения электронных оболочек в атоме.
Элементы таблице отличаются друг от друга зарядом ядра и количеством электронов. При переходе к соседнему элементу последние увеличиваются на единицу. Электроны заполняют уровни так, чтобы энергия атома была минимальной.
В многоэлектронном атоме каждый отдельный электрон движется в поле, которое отличается от кулоновского. Это приводит к тому, что вырождение по орбитальному моменту снимается 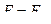 . Причем c увеличением l энергия уровней с одинаковыми n возрастает. Когда число электронов невелико, отличие в энергии с различными l и одинаковыми n не так велико, как между состояниями с различными n. Поэтому, сначала электроны заполняют оболочки с меньшими n, начиная с s подоболочки, последовательно переходя к большим значениям l.
. Причем c увеличением l энергия уровней с одинаковыми n возрастает. Когда число электронов невелико, отличие в энергии с различными l и одинаковыми n не так велико, как между состояниями с различными n. Поэтому, сначала электроны заполняют оболочки с меньшими n, начиная с s подоболочки, последовательно переходя к большим значениям l.
|
|
Единственный электрон атома водорода находится в состоянии 1 s. Оба электрона атома He находятся в состоянии 1 s с антипараллельными ориентациями спина. На атоме гелия заканчивается заполнение K -оболочки, что соответствует завершению I периода таблицы Менделеева.
Третий электрон атома Li (Z =3) занимает наинизшее свободное энергетическое состояние с n =2 (L -оболочка), т.е. 2 s -состояние. Так как он слабее других электронов связан с ядром атома, то им определяются оптические и химические свойства атома. Процесс заполнения электронов во втором периоде не нарушается. Заканчивается период неоном, у которого L -оболочка целиком заполнена.
В третьем периоде начинается заполнение M -оболочки. Одиннадцатый электрон первого элемента данного периода Na (Z =11) занимает наинизшее свободное состояние 3 s. 3 s -электрон является единственным валентным электроном. В связи с этим оптические и химические свойства натрия подобны свойствам лития. У следующих за натрием элементов нормально заполняются подоболочки 3 s и 3 p.
Впервые нарушение обычной последовательности заполнения уровней происходит у K (Z =19). Его девятнадцатый электрон должен был бы занять 3 d -состояние в M-оболочке. При данной общей конфигурации подоболочка 4 s оказывается энергетически ниже подоболочки 3 d. В связи с чем, при незавершенном в целом заполнении оболочки M начинается заполнение оболочки N. В оптическом и химическом отношении атом K подобен атомам Li и Na. Все эти элементы имеют валентный электрон в s -состоянии.
С аналогичными отступлениями от обычной последовательности, повторяющимися время от времени, осуществляется застройка электронных уровней всех атомов. При этом периодически повторяются сходные конфигурации внешних (валентных) электронов (например, 1 s, 2 s, 3 s и т.д.), чем обуславливается повторяемость химических и оптических свойств атомов.
Рентгеновские спектры. Самым распространенным источником рентгеновского излучения является рентгеновская трубка, в которой сильно ускоренные электрическим полем электроны бомбардируют анод. При торможении электронов возникает рентгеновское излучение. Спектральный состав рентгеновского излучения представляет собой наложение сплошного спектра, ограниченного со стороны коротких волн граничной длиной 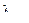 , и линейчатого спектра – совокупности отдельных линий на фоне сплошного спектра.
, и линейчатого спектра – совокупности отдельных линий на фоне сплошного спектра.
|
|
Сплошной спектр обусловлен излучением электронов при их торможении. Поэтому его называют тормозным излучением. Максимальная энергия кванта тормозного излучения соответствует случаю, когда вся кинетическая энергия электрона переходит в энергию рентгеновского фотона, т.е.
 ,
,
где U – ускоряющая разность потенциалов рентгеновской трубки. Отсюда граничная длина волны
 . (2)
. (2)
Измерив коротковолновую границу тормозного излучения, можно определить постоянную Планка. Из всех методов определения 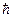 данный метод считается самым точным.
данный метод считается самым точным.
При достаточно большой энергии электронов на фоне сплошного спектра появляются отдельные резкие линии. Линейчатый спектр определяется только материалом анода, поэтому данное излучение называется характеристическим излучением.
Характеристические спектры отличается заметной простотой. Они состоят из нескольких серий, обозначаемых буквами K, L, M, N и O. Каждая серия насчитывает небольшое число линий, обозначаемых в порядке возрастания частоты индексами a, b, g … ( ,
,  ,
,  , …;
, …;  ,
,  ,
,  , … и т.д.). Спектры разных элементов имеют сходный характер. При увеличении атомного номера Z весь рентгеновский спектр целиком смещается в коротковолновую часть, не меняя своей структуры (рис.). Это объясняется тем, что рентгеновские спектры возникают при переходах внутренних электронов, которые для разных атомов являются сходными.
, … и т.д.). Спектры разных элементов имеют сходный характер. При увеличении атомного номера Z весь рентгеновский спектр целиком смещается в коротковолновую часть, не меняя своей структуры (рис.). Это объясняется тем, что рентгеновские спектры возникают при переходах внутренних электронов, которые для разных атомов являются сходными.
Схема возникновения рентгеновских спектров дана на рис. Возбуждение атома состоит в удалении одного из внутренних электронов. Если вырывается один из двух электронов K -слоя, то освободившееся место может быть занято электроном из какого-либо внешнего слоя (L, M, N и т.д.). При этом возникает K -серия. Аналогично возникают и другие серии, наблюдаемые, впрочем, только для тяжелых элементов. Серия K обязательно сопровождается остальными сериями, так как при испускании ее линий освобождаются уровни в слоях L, M и т.д., которые будут в свою очередь заполнятся электронами из более высоких слоев.
|
|
Исследуя рентгеновские спектры элементов, Г. Мозли установил соотношение, называемое законом Мозли
 , (3)
, (3)
где w – частота линии характеристического рентгеновского излучения, R – постоянная Ридберга,  (определяет рентгеновскую серию),
(определяет рентгеновскую серию), 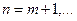 (определяет линию соответствующей серии), s – постоянная экранирования.
(определяет линию соответствующей серии), s – постоянная экранирования.
|
|
|

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!