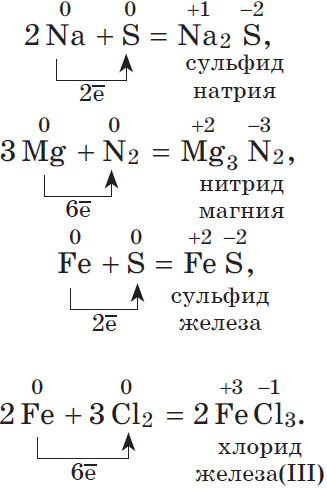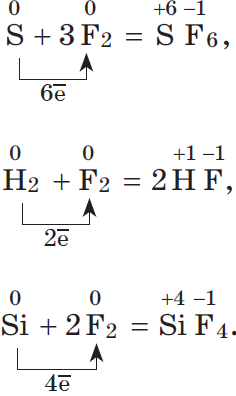1. Окислительные свойства неметаллов проявляются, в первую очередь, при их взаимодействии с металлами (как вы знаете, металлы — всегда восстановители):
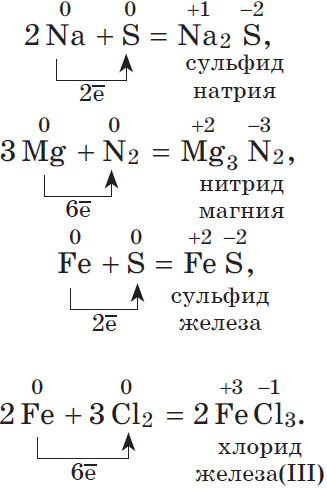
Окислительные свойства хлора Cl2 выражены сильнее, чем у серы, поэтому и металл Fe, который имеет в соединениях устойчивые степени окисления +2 и +3, окисляется им до более высокой степени окисления.
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения:

3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:

Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства:
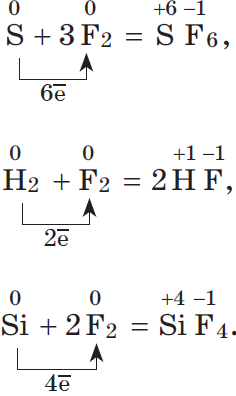
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор F2 — самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами.
Отметим, в первую очередь, окислительные свойства неметалла кислорода в реакциях со сложными веществами:
а)
H4+2
→
+2H2
восстановитель
−8
→
|1
окислитель
+4
→2
|2
б)2
O2+
2
восстановитель
−2
→
|1
окислитель
+4
→2
|2
Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами — неорганическими (а, б) и органическими (в, г):
а)2
+
=2
восстановитель
−1
→
|2
окислитель
+2
→2
|1
Сильный окислитель хлор Cl2 окисляет хлорид железа (II) в хлорид железа (III);
б)2
+
=
+
восстановитель 2
−2
→
|1
окислитель
+2
→2
|1
Хлор Cl2 как более сильный окислитель вытесняет иод I2 в свободном виде из раствора иодида калия;
в)
H4+
+H
восстановитель
−2
→
|1
окислитель
+2
→2
|1
Галогенирование метана — характерная реакция для алканов;
г)
H2
H2+
→
H2
−
H2
восстановитель
−1
→
|2
окислитель
+2
→2
|1
Вы помните, конечно, качественную реакцию на непредельные соединения — обесцвечивание бромной воды.
Восстановительные свойства простых веществ — неметаллов. При рассмотрении реакций неметаллов друг с другом мы уже отмечали, что, в зависимости от значения их электроотрицательности, один из них проявляет свойства окислителя, а другой — свойства восстановителя.
1. По отношению ко фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:

В результате реакций образуются оксиды неметаллов: несолеобразующие и солеобразующие кислотные. И хотя галогены непосредственно с кислородом не соединяются, известны их оксиды:
,
,
,
,
,
и др., которые получают косвенным путем.
3. Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами — окислителями:
а)
+
+
C
восстановитель
−2
→2
|1
окислитель
+2
→
|1
б)6
+5
5K
+3
O5
восстановитель
−5
→
|6
окислитель
+6
→
|5
в)
+4
O2↑+4
O2↑+2H2O
восстановитель
−4
→
|1
окислитель
+1
→
|4
г) 
восстановитель
−2
→
|1
окислитель
+2
→
|1
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования):
а)
+H2O⇄H
+H
O
восстановитель
−1
→
|1
окислитель
+1
→
|1
б)3
+6KOH=5K
+K
O3+2H2O
восстановитель
−5
→
|1
окислитель
+1
→
|5
Итак, подведем итоги. Большинство неметаллов могут выступать в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи только фтору F2).
Водородные соединения неметаллов. Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве из которых неметалл имеет низшую степень окисления.
| Период
| Группа
|
| III
| IV
| V
| VI
| VII
|
| 2
| | | | | |
| 3
|
| | P
| | |
| 4
|
|
| | | |
| 5
|
|
|
| | |
Среди приведенных формул веществ много таких, свойства, применение и получение которых вы изучали ранее: CH4,NH3,H2O,H2S,HCl.
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметалла с водородом, т.е. синтезом:
| 1.H2+Cl2=2HCl
|
| 2.N2+3H2⇄2NH3
|
| |
} В промышленности так получают хлороводород и аммиак.
| 3.C+2H2=CH4
|
| 4.2H2+O2=2H2O
|
| 5.H2+S⇄H2S
|
| |
} Синтезы метана, воды и сероводорода имеют в основном теоретическое значение.
Все водородные соединения неметаллов образованы ковалентными полярными связями, имеют молекулярное строение и при обычных условиях являются газами, кроме воды (жидкость).
Для водородных соединений неметаллов характерно различное отношение к воде. Метан и силан в ней практически нерастворимы. Аммиак при растворении в воде образует слабое основание — NH3·H2O.
При растворении в воде сероводорода, селеноводорода, теллуроводорода, а также галогеноводородов образуются кислоты с той же формулой, что и сами водородные соединения: H2S,H2Se,H2Te,HF,HCl,HBr,HI.
Если сравнить кислотно-основные свойства водородных соединений, образованных неметаллами одного периода, например, второго (NH3,H2O,HF) или третьего (PH3,H2S,HCl), то можно сделать вывод о закономерном усилении их кислотных свойств и, соответственно, ослаблении основных. Это, очевидно, связано с тем, что увеличивается полярность связи Э—Н (где Э — неметалл).
Кислотно-основные свойства водородных соединений неметаллов одной подгруппы также отличаются. Например, в ряду галогеноводородов HF,HCl,HBr,HI прочность связи Э—Н уменьшается, т. к. увеличивается длина связи. В растворах HCl,HBr,HI диссоциируют практически полностью — это сильные кислоты, причем их сила увеличивается от HF к HI. При этом HF относится к слабым кислотам, что обусловлено еще одним фактором — межмолекулярным взаимодействием, образованием водородных связей …Н—F…H—F…. Атомы водорода связаны с атомами фтора F не только своей молекулы, но еще и соседней.
Обобщая сравнительную характеристику кислотно-основных свойств водородных соединений неметаллов, сделаем вывод об усилении кислотных и ослаблении основных свойств этих веществ по периодам и главным подгруппам с увеличением атомных номеров образующих их элементов.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителей, ведь в них неметалл имеет низшую степень окисления.