Подготовка к ЕГЭ – химия
Электронная конфигурация атома



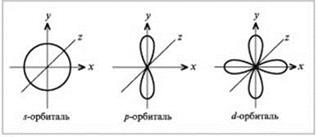


Число внешних (валентных) электронов определяется номером группы (для элементов главных подгрупп).
Число энергетических уровней (слоев) - номером периода.
Электроны, заполняющие орбитали попарно, называются спаренными, а одиночные электроны называются неспаренными.

Валентные электроны – электроны, внешнего и предвнешнего подуровня, могут участвовать в образовании химических связей.

Закономерности изменения химических свойств элементов.
Характеристика элементов.
Примеры заданий:
1. Выберите три элемента, которые в Периодической системе находятся в одной группе, и расположите эти элементы в порядке увеличения энергии ионизации атома: N, F, B, As, P
2. Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения высшей валентности: H, C, F, Be, P
3. Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения высшей степени окисления: Li, C, Cl, Mg, P
| Характеристика
| По периоду
(слева направо)
| В группе
(сверху вниз)
|
| Заряд ядра
| возрастает
| возрастает
|
| Радиус атома
| убывает
| возрастает
|
| Сродство к электрону
| возрастает
| убывает
|
| Энергия ионизации
| возрастает
| убывает
|
| Электроотрицательность
| возрастает
| убывает
|
| Металлические свойства
| ослабевают
| усиливаются
|
| Неметаллические свойства
| усиливаются
| ослабевают
|
| Восстановительные свойства
| ослабевают
| усиливаются
|
| Окислительные свойства
| усиливаются
| ослабевают
|


| | | | | |
| | |
| | | | 1. Неметалл
2. Окислитель
3. Высокая Электроотрицательность
4. Самый маленький размер радиуса атома
5. Увеличение кислотных свойств
6. Энергия ионизации возрастает
| |
|
| | 1. Металл
2. Восстановитель
3. Низкая Электроотрицательность
4. Самый большой размер радиуса атома
5. Увеличение основных свойств
6. Энергия ионизации убывает
| |
|
Электроотрицательность, степень окисления и валентность химических элементов.
| Любое простое вещество
| 0
|
| В сложных веществах (в соединениях)
|
| Металлы 1-й группы главной подгруппы
| +1
|
| Элементы 2-й группы главной подгруппы, Zn, Cd
| +2
|
| Алюминий
| +3
|
| Кислород
| -2 (кроме F2O и пероксидов!!!)
|
| Водород
| +1 (в соединениях с металлами -1)
|
| Фтор
| -1
|
| Алгебраическая сумма в соединении
| 0
|
| Алгебраическая сумма в
сложном ионе
| =заряду иона
|
| Степень окисления элемента в кислотном остатке
| = степени окисления элемента в кислоте
|
| Высшая
| =№ группы
|
| Низшая
| 8-№ группы
|
| В бинарных соединениях степень окисления второго элемента
| Низшая (8-№ группы)
|
Наиболее электроотрицательные элементы в соединении имеют отрицательные СО, а атомы элементов с меньшей электроотрицатель-ностью – положительные.
-4 +1
F O N Cl Br S C P Si I As H С H 4
Графич еский способ

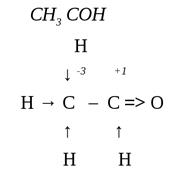
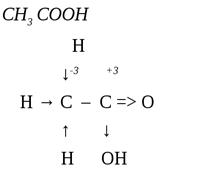
Валентность – это способность атомов элемента образовывать химические связи, равна числу неспаренных электронов.
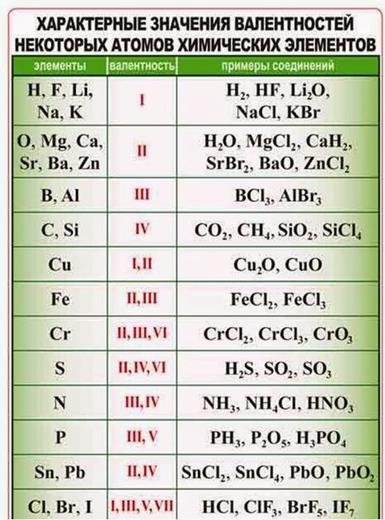
Примеры заданий:
Выберите два элемента, которые в соединениях могут иметь валентность V:
N, F, B, As, P
Ковалентная связь
Существует 2 механизма образования ковалентной связи:
· обменный механизм, когда каждый атом предоставляет в общую электронную пару 1 электрон

· донорно-акцепторный механизм, когда один атом предоставляет электронную пару, а другой — свободную орбиталь (HNO3,CO, NH4+, CH3-NH2+; О3)

Виды ковалентных связей: σ-связь (сигма-связь) — одинарная связь, Пи-связь (π-связь) — двойная или тройная связь. Длина связи – расстояние между ядрами (самая маленькая длина связи в молекуле водорода).
Примеры заданий:
1. Из предложенного перечня выберите два сложных вещества, в молекулах которых имеется p- связь:
1) метанол
2) азот
3) метаналь
4) аммиак
5) оксид углерода (II)
2. Из предложенного перечня выберите два соединения, в которых химическая связь образована за счет электронных пар.
1) Ca
2) H 2 O
3) NaCl
4) CaO
5) Cl 2
3. Из предложенного перечня выберите два соединения, в которых присутствует как ионная, так и ковалентная химическая связь.
1) CaO
2) Cl 2 O
3) Na 2 CO 3
4) NH 4 Cl
5) Br 2
4. Из перечисленного перечня выберите два соединения, в которых присутствуют химические связи, образованные по донорно-акцепторному механизму.
1) NH 4 Br
2) H 2 O
3) NaCl
4) HNO 3
5) H 2 SO 4
5. Из предложенного перечня веществ выберите два вещества, содержащие ковалентные неполярные связи.
1) CH 3 COONa
2) CaCl 2
3) NH 4 Br
4) FeS 2
5) CH 3 OLi
6. Из предложенного перечня выберите два соединения, в которых отсутствует ковалентная неполярная химическая связь.
1) С 2Н 6
2) Р Cl 3
3) Ba(NO 3) 2
4) H 2 O 2
5) Br 2
7. Из предложенного перечня выберите два вещества, для которых характерно образование межмолеклярных водородных связей.
1) HF
2) CH 4
3) H 3 N
4) C 2 H 6
5) H 2
8. Из предложенного перечня выберите два вещества, между молеклами которых образуются водородные связи.
1) Пропанол-1
2) Пропанол-2
3) Водород
4) Ацетальдегид
5) Метаналь
9. Из перечисленного перечня выберите два вещества, в молекулах которых присутствует ковалентная связь, образованная по донорно-акцепторному механизму.
1) H 2 SO 4
2) HNO 3
3) Na 2 CO 3
4) P 4
5) O 3
10. Из предложенного перечня выберите два соединения, в которых отсутствует ионная химическая связь.
1) BaCl 2
2) HCl
3) NH 4 Br
4) HNO 3
5) CaO
11. Из предложенного перечня выберите два вещества с одинаковым типом кристаллической решетки.
1) Cu
2) SiO 2
3) Al 2 (SO 4) 3
4) C (алмаз)
5) C 3 H 8
12. Из предложенного перечня выберите два вещества молекулярного строения.
1) озон
2) оксид бария
3) графит
4) сульфид калия
5) хлороводород
13. Из предложенного перечня выберите два вещества с атомной кристаллической решеткой.
1) хлороводород
2) вода
3) поваренная соль
4) кремнезем
5) графит
14. Из предложенного перечня выберите два вещества с ионной кристаллической решёткой.
1) йодид калия
2) хлор
3) хлорид цезия
4) хлорид фосфора (III)
5) оксид углерода (II)
15. Из предложенного перечня выберите два общих свойства для веществ с атомной и ионной кристаллической решеткой.
1) хорошая растворимость в воде
2) тугоплавкость
3) проводимость электрического тока в твердом состоянии
4) наличие высокого показателя твёрдости
5) высокая плотность
16. Выберите два правильных утверждения о длинах ковалентных связей.
1) Длина связи F- F больше длины связи H- H
 2) Длина связи C= C больше длины связи C- C
2) Длина связи C= C больше длины связи C- C
 3) Длина связи C= C равна длине связи C= C
3) Длина связи C= C равна длине связи C= C
4) Длина связи O- O больше длины связи O= O
5) Длина связи F- F больше длины связи I - I
17. Из предложенного перечня выберите два свойства, которые характеризуют вещества с молекулярной кристаллической решеткой.
1) Высокая электропроводность в кристаллическом виде
2) Высокая твердость
3) Высокая электропроводность в расплаве
4) Высокая летучесть
5) Низкая температура плавления
18. Из предложенного перечня выберите два общих свойства для веществ с атомной и ионной кристаллической решеткой.
1) Хорошая растворимость в воде
2) Тугоплавкость
3) Проводимость электрического тока в твердом состоянии
4) Наличие высокого показателя твердости
5) Высокая плотность
Подготовка к ЕГЭ – химия
Электронная конфигурация атома

























 2) Длина связи C= C больше длины связи C- C
2) Длина связи C= C больше длины связи C- C 3) Длина связи C= C равна длине связи C= C
3) Длина связи C= C равна длине связи C= C

