1. Химическая природа. Все ферменты – белки. По своему строе- нию ферменты подразделяются на две большие группы: одно- компонентные и двухкомпонентные. К однокомпонентным отно- сятся ферменты, состоящие только из белковых молекул. У этих ферментов роль активных центров выполняют определенные
химические группировки – аминокислотные остатки. Например, ОН– группа серина, SH– группа цистеина и др.
К двухкомпонентным относятся такие ферменты, которые состо- ят из белковой и небелковой части, причем белковая часть двух- компонентного фермента оказывает решающее влияние на спе- цифичность его действия. Вместе с тем соединение активной группы (небелковой части) с белками приводит к огромному возрастанию ее каталитической активности. Небелковая часть представлена витаминами или катионами d -элементов.
2. Размер. Молекулы ферментов имеют размер коллоидных частиц (1-100 нм), поэтому их относят к ультрамикрогетерогенным ка- тализаторам.
3. 
 Высокая каталитическая активность. Ничтожно малые коли- чества ферментов способны расщеплять во много раз превы- шающие количества реагирующих веществ. Например, 1 моль фермента алкогольдегидрогеназы за 1 сек при 25 С способствует превращению 720 моль этанола в уксусный альдегид, а 1 моль промышленного катализатора за 1 сек даже при 200 С позволяет окислить только 1 моль этанола.
Высокая каталитическая активность. Ничтожно малые коли- чества ферментов способны расщеплять во много раз превы- шающие количества реагирующих веществ. Например, 1 моль фермента алкогольдегидрогеназы за 1 сек при 25 С способствует превращению 720 моль этанола в уксусный альдегид, а 1 моль промышленного катализатора за 1 сек даже при 200 С позволяет окислить только 1 моль этанола.
4. Химическая специфичность. Ферменты действуют на опреде- ленные субстраты или типы связей. Например, уреаза расщепля- ет только мочевину, а пепсин (фермент желудочного сока) дей- ствует на пептидные связи белков.
5. Влияние внешних условий. По своей природе ферменты значи- тельно более чувствительны к изменению внешних условий, чем неорганические катализаторы. Температурный оптимум боль- шинства растительных ферментов 313-333 К, животных фермен- тов 313-323 К. Если температура превысит эти пределы, актив- ность фермента очень быстро падает, а при 343-353 К происхо- дит, как правило, их необратимое разрушение, обусловленное денатурацией белка.
6. Инактивация. В процессе протекания каталитической реакции фермент постепенно разрушается и утрачивает свою активность
– инактивируется. Чем большей активностью обладает фермент, тем он сильнее разрушается в процессе катализа. Этим свойст- вом ферменты существенно отличаются от неорганических ката- лизаторов, которые остаются без изменения в продуктах реак- ции.
Общие принципы кинетики химических реакций применимы и к ферментативным реакциям, однако у последних имеется важная отличительная особенность – явление насыщения субстратом. Субстрат – объект воздействия фермента. Например, белки являют- ся субстратом для фермента пепсина, крахмал – для амилазы и т.д. При низкой концентрации субстрата скорость реакции возрастает пропорционально концентрации субстрата, т.е. в отношении суб- страта реакция имеет I порядок. По мере увеличения концентрации субстрата, скорость реакции растет медленнее, пропорциональ- ность нарушается (реакция смешанного порядка). При дальнейшем увеличении концентрации субстрата, скорость реакции становится постоянной (реакция нулевого порядка). Происходит своего рода
«насыщение» фермента субстратом. Исследование эффекта «насы- щения» привело Л. Михаэлиса и М. Ментен в 1913 г. к созданию теории действия ферментов:
Е + S
k 1 ES ES + P
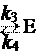 k 2
k 2
где Е – фермент (энзим); S – субстрат;
ES – фермент-субстратный комплекс; Р – продукты реакции;
k 1, k 2, k 3, k 4 – константы скорости прямых и обратных реакций. Количественное соотношение между скоростью ферментатив-
 ной реакции и концентрацией субстрата [S] выражается уравнени- ем Михаэлиса-Ментен:
ной реакции и концентрацией субстрата [S] выражается уравнени- ем Михаэлиса-Ментен:
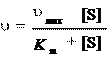
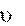 где max – максимальное значение скорости данной реакции;
где max – максимальное значение скорости данной реакции;
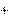 K m – «объединенная» константа Михаэлиса, равная
K m – «объединенная» константа Михаэлиса, равная
k 2 k 3
при
1 , K m = [S].

 k 1 2
k 1 2
max
Зависимость скорости ферментативной реакции от концентрации субстрата представлена на рис. 14.

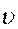
 m ax
m ax
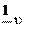 2 max
2 max
 K m
K m
Рис. 14. Зависимость скорости ферментативной реакции от концентрации субстрата
Значение K m равно концентрации субстрата, при которой ско- рость реакции равна половине своего максимального значения. Примерные значение K m для большинства ферментов от
10–1 до 10–5.
Уравнение Михаэлиса-Ментен – отправная точка при любом количественном описании действия ферментов.
 Обучающие задачи с решением
Обучающие задачи с решением
1. 
 Определите молекулярность следующих одностадийных реак- ций:
Определите молекулярность следующих одностадийных реак- ций:
а) I
2 2I; б) 2NO + O
2 2NO
2;
в) H2 + I2 2HI; г)
Решение:
88 Ra
226
86 Rn
222
He 4
Молекулярность реакции определяется числом частиц, участвую- щих в элементарном акте реакции.
Реакции а) и г) относятся к мономолекулярным, так как в элемен- тарном акте участвует одна молекула; реакция б) является тримо- лекулярной, потому что в элементарном акте взаимодействуют три молекулы, такие реакции встречаются крайне редко; реакция в) яв- ляется бимолекулярной в связи со вступлением во взаимодействие двух частиц.
2.  Напишите кинетическое уравнение для реакции:
Напишите кинетическое уравнение для реакции:
N2(г) + 2O2(г) 2NO2(г),
допуская, что уравнение реакции отражает ее механизм.
Решение:


 Кинетическое уравнение химической реакции показывает зависи- мость скорости процесса от концентрации компонентов реакцион- ной смеси. Кинетическое уравнение может иметь сложный вид, но если уравнение реакции отражает ее механизм, то скорость являет- ся степенной функцией концентрации исходных веществ:
Кинетическое уравнение химической реакции показывает зависи- мость скорости процесса от концентрации компонентов реакцион- ной смеси. Кинетическое уравнение может иметь сложный вид, но если уравнение реакции отражает ее механизм, то скорость являет- ся степенной функцией концентрации исходных веществ:
= k c (N2) c 2(О2)
3.  Определите порядок следующих химических реакций: а) Н2(г) + I2(г) 2НI(г);
Определите порядок следующих химических реакций: а) Н2(г) + I2(г) 2НI(г);
б) 2СО(г) + О2(г) 2СО2(г)
Решение:
Если уравнение химической реакции отражает ее механизм, то ре- акция имеет порядок по веществу (компоненту), равный показате- лю степени концентрации данного компонента в кинетическом уравнении. Сумма порядков по отдельным веществам (компонен- там) называется порядком реакции.


 Для реакции (а) кинетическое уравнение имеет вид:
Для реакции (а) кинетическое уравнение имеет вид:
= k c (Н2) c (I2),
т.е. данная реакция является первого порядка по веществу (компо- ненту) водороду, первого порядка по веществу йоду, суммарно по- рядок реакции равен двум.
Для реакции (б) кинетическое уравнение имеет вид:
 =
=  c 2(СО)
c 2(СО)  c (О2),
c (О2),
следовательно, данная реакция является реакцией второго порядка по веществу СО, реакцией первого порядка по веществу О2, сум- марно реакция является реакцией третьего порядка.
4. Определите тип сложной реакции гидролиза крахмала.
Решение:

 При гидролизе крахмала происходят следующие процессы:
При гидролизе крахмала происходят следующие процессы:
крахмал декстрины мальтоза глюкоза.
Эта реакция относится к последовательным реакциям, так как обра- зование конечного продукта происходит через ряд промежуточных стадий.
5. Определите тип сложной реакции нитрования фенола.
Решение:
Наличие в бензольном кольце гидроксильной группы – ориентанта 1 рода, приводит к образованию при нитровании одновременно ор-
 то- и пара-изомеров: H O
то- и пара-изомеров: H O
NO
 H O о -нитрофенол
H O о -нитрофенол
H O
SE
фенол
п - нитрофенол NO
В связи с одновременным образованием разных продуктов из одного и того же вещества, данный процесс следует отнести к па- раллельным (конкурирующим).
6. Атмосферные загрязнения постепенно уничтожают защитный озоновый слой Земли. Озоновому слою угрожают поступающие в атмосферу фторированные и хлорированные углеводороды - фреоны, например, CCl3F, CCl2F2, CClF3. Они химически ста- бильны в нижних слоях атмосферы, но в стратосфере под дейст- вием ультрафиолетового излучения Солнца разрушаются, выде- ляя атомарный хлор, после чего начинают протекать реакции взаимодействия атомарного хлора с озоном. Рассчитайте ско- рость такой реакции с образованием кислорода и монооксида хлора, если через 15 сек после начала реакции молярная концен- трация озона была 0,3 моль/л, а через 35 сек (от начала реакции) стала равна 0,15 моль/л.
Решение:
Запишем уравнение реакции и условие задачи в формульном виде:
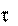 Cl + O3 = ClO + O2
Cl + O3 = ClO + O2
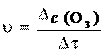
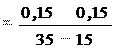
 c 1(O3) = 0,3 моль/л; 1 = 15 cек; c 2(O3) = 0,15 моль/л; 2 = 35 cек. Скорость реакции определяется как изменение концентрации уча- ствующего в ней вещества, отнесенной к промежутку времени, за который произошло это изменение, а именно:
c 1(O3) = 0,3 моль/л; 1 = 15 cек; c 2(O3) = 0,15 моль/л; 2 = 35 cек. Скорость реакции определяется как изменение концентрации уча- ствующего в ней вещества, отнесенной к промежутку времени, за который произошло это изменение, а именно:
 = 0,0075 моль/(л с)
= 0,0075 моль/(л с)

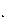
 Ответ: = 0,0075 моль л–1 с–1.
Ответ: = 0,0075 моль л–1 с–1.
7.  Диоксид серы (SO2) – самый распространенный загрязнитель воздуха. Он опасен для здоровья людей, особенно тех, кто страдает заболеваниями дыхательных путей. Диоксид серы снижает продуктивность сельскохозяйственных культур, за- медляет рост леса, пагубно действует на строительные мате- риалы, содержащие карбонат кальция. В атмосфере диоксид се- ры окисляется до SO3; при этом роль катализатора играет нахо- дящаяся в воздухе пыль оксидов металлов. Капли влаги пре- вращают SO3 в серную кислоту, которая вместе с атмосферны- ми осадками выпадает в виде "кислотных дождей". Рассчитайте значение константы скорости реакции диоксида серы с атомар- ным кислородом, если при концентрациях с (SO2) и с (O), рав- ных соответственно 0,25 и 0,6 моль/л, скорость реакции равна 0,003 моль/(л с).
Диоксид серы (SO2) – самый распространенный загрязнитель воздуха. Он опасен для здоровья людей, особенно тех, кто страдает заболеваниями дыхательных путей. Диоксид серы снижает продуктивность сельскохозяйственных культур, за- медляет рост леса, пагубно действует на строительные мате- риалы, содержащие карбонат кальция. В атмосфере диоксид се- ры окисляется до SO3; при этом роль катализатора играет нахо- дящаяся в воздухе пыль оксидов металлов. Капли влаги пре- вращают SO3 в серную кислоту, которая вместе с атмосферны- ми осадками выпадает в виде "кислотных дождей". Рассчитайте значение константы скорости реакции диоксида серы с атомар- ным кислородом, если при концентрациях с (SO2) и с (O), рав- ных соответственно 0,25 и 0,6 моль/л, скорость реакции равна 0,003 моль/(л с).
Решение:
Запишем уравнение реакции и условие задачи в формульном виде:

 O + SO2 = SO3
O + SO2 = SO3

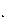 c (SO2) = 0,25 моль/л; c (O) = 0,6 моль/л; = 0,003 моль/(л с). Скорость реакции определяется как произведение константы ско- рости и концентраций реагентов в степенях, равных их стехиомет- рическим коэффициентам в уравнении реакции:
c (SO2) = 0,25 моль/л; c (O) = 0,6 моль/л; = 0,003 моль/(л с). Скорость реакции определяется как произведение константы ско- рости и концентраций реагентов в степенях, равных их стехиомет- рическим коэффициентам в уравнении реакции:
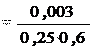
 = k c (SO2) c (O). Отсюда:
= k c (SO2) c (O). Отсюда:
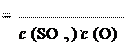
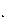 k = 0,02 л/(моль с).
k = 0,02 л/(моль с).
 Ответ: Константа скорости реакции равна 0,02 л/(моль с).
Ответ: Константа скорости реакции равна 0,02 л/(моль с).
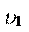
8. Минеральные воды Железндержат повышенное ко- личество радионуклида радона-222. Оцените, какая часть ра- дионуклида 222Rn останется в организме через месяц после его поступления.
Решение:
Скорость процесса радиоактивного распада описывается кинетиче- ским уравнением 1-го порядка.
Для реакции первого порядка находим константу скорости распада, используя период полураспада радионуклида 222Rn.
Из уравнения:
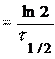 k ; k
k ; k
0,693

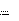 3,824
3,824
0,1812
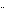 сутки 1.
сутки 1.
 Подставляем найденное значение k в уравнение:
Подставляем найденное значение k в уравнение:
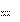 с = с о е – k ,
с = с о е – k ,

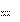
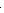
 с е 0,1812 30
с е 0,1812 30
с о
0,0043
или
0,43%.
Ответ: через месяц в организме останется 0,43% радионуклида
222Rn.
9. Во сколько раз возрастет скорость реакции при повышении температуры от 20 до 100оС, если энергия активации реакции равна 125,5 кДж/моль?
Решение:
Скорость реакции связана с энергией активации и температурой уравнением Аррениуса. Для двух температур уравнение имеет вид:
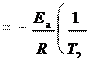
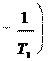

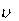 ln 2
ln 2
1
Подставляя в уравнение данные задачи и выражая энергию актива- ции в джоулях, а температуру в К, получим:





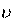 125,5 10 3 1 1
125,5 10 3 1 1
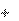
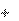
 ln 2
ln 2
11,05.
1
Отсюда
8,314
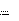

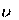 2 е 11, 05
2 е 11, 05
1
273
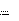 6,29
6,29
100
 10 4.
10 4.
273 20
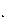 Ответ: повышение температуры от 20 до 100оС привело к увели- чению скорости в 6,29 104 раз.
Ответ: повышение температуры от 20 до 100оС привело к увели- чению скорости в 6,29 104 раз.
11. При повышении температуры от 20 до 40оС скорость реакции увеличилась в 6 раз. Вычислите температурный коэффициент и энергию активации реакции.
Решение:
Используя правило Вант-Гоффа о температурной зависимости ско- рости реакции, рассчитаем температурный коэффициент реакции:
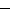 T T
T T
 2 1
2 1
2 10 ;
 1
1
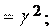
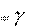 40 20
40 20
6 10

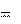 2,45.
2,45.
Для вычисления энергии активации реакции используем уравнение Аррениуса:
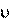
 ln 2
ln 2
1
E а 1 1;
 R T 2 T 1
R T 2 T 1
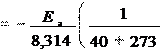

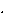 ln 6
ln 6
 1,79
1,79
E а
8,314
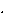 293
293
313
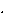 313
313
293
 68241
68241
Дж
 моль
моль
68,2
кДж
 .
.
моль
 Ответ: = 2,45; Е а = 68,2 кДж/моль.
Ответ: = 2,45; Е а = 68,2 кДж/моль.
Тема: ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Необратимые реакции – протекают в одном направлении до пол- ного израсходования одного из реагирующих веществ.
Обратимые процессы – протекают одновременно две взаимно противоположные реакции – прямая и обратная. Все обратимые процессы стремятся привести систему в устойчивое равновесное состояние (рис. 15).

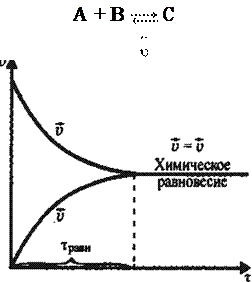
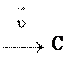
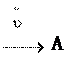 А + В С + В
А + В С + В
Рис. 15. Изменение скорости обратимых реакций
Большинство биохимических реакций носят обратимый характер.
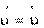
 Химическое равновесие – такое динамическое состояние об- ратимого процесса, при котором скорости прямой и обратной реакции равны и которое характеризуется постоянством пара- метров при постоянных внешних условиях.
Химическое равновесие – такое динамическое состояние об- ратимого процесса, при котором скорости прямой и обратной реакции равны и которое характеризуется постоянством пара- метров при постоянных внешних условиях.
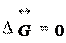 Кинетическое условие химического равновесия: . Термодинамическое условие химического равновесия:
Кинетическое условие химического равновесия: . Термодинамическое условие химического равновесия:
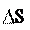 G = G min;
G = G min;
S = S max; = 0
Состояние химического равновесия имеет следующие особенности: а) динамический характер,
б) подвижность,
в) постоянство состояния химического равновесия во времени при неизменных внешних условиях,
г) возможность подхода к состоянию равновесия, как со стороны исходных веществ, так и со стороны продуктов реакции.
Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются. Состояние химического равновесия количественно характеризуется констан- той равновесия.
Константа химического равновесия – отношение констант скоростей прямой (k 1) и обратной (k 2) реакций:
K = k 1/ k 2
Константа равновесия химической реакции, K равн, равна отно- шению произведения равновесных концентраций продуктов реак- ции к произведению равновесных концентраций реагентов в степе- нях, равных стехиометрическим коэффициентам – з акон дейст- вующих масс для химического равновесия:
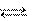 а А + b В с С + d D
а А + b В с С + d D
K равн =
[C] c [D] d,
[A]  a [B] b
a [B] b
где [А], [В], [С], [D] – равновесные концентрации всех веществ системы, которые устанавливаются в ней при наступлении состоя- ния химического равновесия.
K равн зависит от природы реагирующих веществ и от темпера- туры. Существует три способы выражения константы равновесия: через концентрации K с, через активности Kа, через парциальные давления для газов K р.
 Каждая обратимая реакция характеризуется определенным значением константы равновесия при данной температуре, которое определяет глубину превращения исходных веществ в продукты реакции. При K >>1 произведение концентраций полученных ве- ществ много больше произведения концентраций исходных ве- ществ, поэтому обратимая реакция дает в этом случае большой вы- ход продуктов реакции. При K 106, реакции практически необра- тимы. При K << 1, наоборот, выход продуктов реакции очень мал. Если K 10–6, то реакция практически не идет. В первом случае равновесие системы сильно смещено в сторону образования про- дуктов реакции, а во втором – в сторону исходных веществ. Если K находится в интервале 10–6 – 106, то такие реакции обратимы.
Каждая обратимая реакция характеризуется определенным значением константы равновесия при данной температуре, которое определяет глубину превращения исходных веществ в продукты реакции. При K >>1 произведение концентраций полученных ве- ществ много больше произведения концентраций исходных ве- ществ, поэтому обратимая реакция дает в этом случае большой вы- ход продуктов реакции. При K 106, реакции практически необра- тимы. При K << 1, наоборот, выход продуктов реакции очень мал. Если K 10–6, то реакция практически не идет. В первом случае равновесие системы сильно смещено в сторону образования про- дуктов реакции, а во втором – в сторону исходных веществ. Если K находится в интервале 10–6 – 106, то такие реакции обратимы.
Константа равновесия связана с изменением основных тер- модинамических характеристик соотношением:
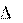 G = – R·T· ln K= – 2,3 R·T· lg K
G = – R·T· ln K= – 2,3 R·T· lg K

 Так как G= H – T· S, то R·T· ln K= S – H/T.
Так как G= H – T· S, то R·T· ln K= S – H/T.
Большое отрицательное значение H и высокие положитель-
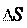 ные значения увеличивают константу равновесия и способству-
ные значения увеличивают константу равновесия и способству-
ют течению реакции в прямом направлении.
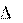
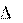 При отрицательных значениях G (G < 0), lg K > 0 и K > 1.
При отрицательных значениях G (G < 0), lg K > 0 и K > 1.
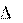
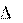
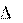 Чем больше отрицательные значения G, тем численно больше константа равновесия и тем сильнее смешается равновесие вправо. Чем больше положительные значения G (G > 0), тем сильнее оно смещается влево. В предельных случаях исходные ве- щества практически полностью превращаются в продукты реакции или, наоборот, химически между собой не взаимодействуют.
Чем больше отрицательные значения G, тем численно больше константа равновесия и тем сильнее смешается равновесие вправо. Чем больше положительные значения G (G > 0), тем сильнее оно смещается влево. В предельных случаях исходные ве- щества практически полностью превращаются в продукты реакции или, наоборот, химически между собой не взаимодействуют.
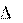 При G = 0 оба направления протекания обратимых реакций равновероятны. В этих случаях lg K = 0 и K = 1, т.е. произведение концентраций продуктов реакции становится равным произведе- нию концентраций исходных веществ.
При G = 0 оба направления протекания обратимых реакций равновероятны. В этих случаях lg K = 0 и K = 1, т.е. произведение концентраций продуктов реакции становится равным произведе- нию концентраций исходных веществ.
Для гетерогенных реакций в выражение для скорости реак- ций и константы равновесия не входят концентрации веществ, на- ходящихся в твердой фазе. Как постоянные величины они учиты- ваются в значениях соответствующих констант.
Уравнение изотермы Вант-Гоффа связывает направление реакции с исходным составом реагирующих веществ. Это уравне- ние позволяет определять направление процесса в том случае, ко- гда активности (концентрации) веществ не отвечают стандартному состоянию.
 Для реакции a А + b В с С + d D уравнение изотермы имеет вид:
Для реакции a А + b В с С + d D уравнение изотермы имеет вид:
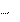
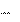 c c c d
c c c d
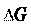 = RT
= RT
(ln K равн.
ln C D);
р-ции
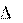
при с.у.
G o
 ции
ции
a b
A B
 = R Т ln K равн.
= R Т ln K равн.




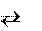
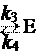 k 2
k 2 ной реакции и концентрацией субстрата [S] выражается уравнени- ем Михаэлиса-Ментен:
ной реакции и концентрацией субстрата [S] выражается уравнени- ем Михаэлиса-Ментен: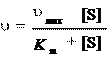
 где max – максимальное значение скорости данной реакции;
где max – максимальное значение скорости данной реакции; K m – «объединенная» константа Михаэлиса, равная
K m – «объединенная» константа Михаэлиса, равная
 k 1 2
k 1 2
 m ax
m ax 2 max
2 max K m
K m Обучающие задачи с решением
Обучающие задачи с решением
 Определите молекулярность следующих одностадийных реак- ций:
Определите молекулярность следующих одностадийных реак- ций:
 Напишите кинетическое уравнение для реакции:
Напишите кинетическое уравнение для реакции:

 Определите порядок следующих химических реакций: а) Н2(г) + I2(г) 2НI(г);
Определите порядок следующих химических реакций: а) Н2(г) + I2(г) 2НI(г); c (О2),
c (О2),
 то- и пара-изомеров: H O
то- и пара-изомеров: H O H O о -нитрофенол
H O о -нитрофенол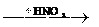

 H O
H O
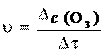
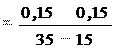
 c 1(O3) = 0,3 моль/л; 1 = 15 cек; c 2(O3) = 0,15 моль/л; 2 = 35 cек. Скорость реакции определяется как изменение концентрации уча- ствующего в ней вещества, отнесенной к промежутку времени, за который произошло это изменение, а именно:
c 1(O3) = 0,3 моль/л; 1 = 15 cек; c 2(O3) = 0,15 моль/л; 2 = 35 cек. Скорость реакции определяется как изменение концентрации уча- ствующего в ней вещества, отнесенной к промежутку времени, за который произошло это изменение, а именно: = 0,0075 моль/(л с)
= 0,0075 моль/(л с)
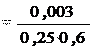
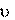 = k c (SO2) c (O). Отсюда:
= k c (SO2) c (O). Отсюда: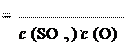
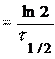 k ; k
k ; k
 3,824
3,824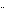 сутки 1.
сутки 1.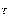 Подставляем найденное значение k в уравнение:
Подставляем найденное значение k в уравнение: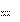 с = с о е – k ,
с = с о е – k ,
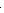
 с е 0,1812 30
с е 0,1812 30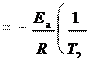
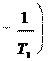

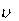 ln 2
ln 2




 125,5 10 3 1 1
125,5 10 3 1 1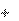
 ln 2
ln 2 
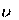 2 е 11, 05
2 е 11, 05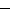 T T
T T 2 1
2 1 1
1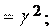
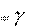 40 20
40 20
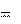 2,45.
2,45.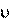
 R T 2 T 1
R T 2 T 1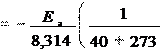

 ln 6
ln 6 1,79
1,79 моль
моль .
.

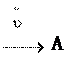 А + В С + В
А + В С + В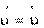
 Химическое равновесие – такое динамическое состояние об- ратимого процесса, при котором скорости прямой и обратной реакции равны и которое характеризуется постоянством пара- метров при постоянных внешних условиях.
Химическое равновесие – такое динамическое состояние об- ратимого процесса, при котором скорости прямой и обратной реакции равны и которое характеризуется постоянством пара- метров при постоянных внешних условиях.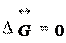 Кинетическое условие химического равновесия: . Термодинамическое условие химического равновесия:
Кинетическое условие химического равновесия: . Термодинамическое условие химического равновесия: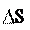 G = G min;
G = G min; а А + b В с С + d D
а А + b В с С + d D a [B] b
a [B] b
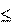 Каждая обратимая реакция характеризуется определенным значением константы равновесия при данной температуре, которое определяет глубину превращения исходных веществ в продукты реакции. При K >>1 произведение концентраций полученных ве- ществ много больше произведения концентраций исходных ве- ществ, поэтому обратимая реакция дает в этом случае большой вы- ход продуктов реакции. При K 106, реакции практически необра- тимы. При K << 1, наоборот, выход продуктов реакции очень мал. Если K 10–6, то реакция практически не идет. В первом случае равновесие системы сильно смещено в сторону образования про- дуктов реакции, а во втором – в сторону исходных веществ. Если K находится в интервале 10–6 – 106, то такие реакции обратимы.
Каждая обратимая реакция характеризуется определенным значением константы равновесия при данной температуре, которое определяет глубину превращения исходных веществ в продукты реакции. При K >>1 произведение концентраций полученных ве- ществ много больше произведения концентраций исходных ве- ществ, поэтому обратимая реакция дает в этом случае большой вы- ход продуктов реакции. При K 106, реакции практически необра- тимы. При K << 1, наоборот, выход продуктов реакции очень мал. Если K 10–6, то реакция практически не идет. В первом случае равновесие системы сильно смещено в сторону образования про- дуктов реакции, а во втором – в сторону исходных веществ. Если K находится в интервале 10–6 – 106, то такие реакции обратимы.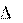 G = – R·T· ln K= – 2,3 R·T· lg K
G = – R·T· ln K= – 2,3 R·T· lg K
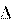 Так как G= H – T· S, то R·T· ln K= S – H/T.
Так как G= H – T· S, то R·T· ln K= S – H/T.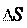 ные значения увеличивают константу равновесия и способству-
ные значения увеличивают константу равновесия и способству- Для реакции a А + b В с С + d D уравнение изотермы имеет вид:
Для реакции a А + b В с С + d D уравнение изотермы имеет вид:
 c c c d
c c c d = RT
= RT ции
ции = R Т ln K равн.
= R Т ln K равн.


