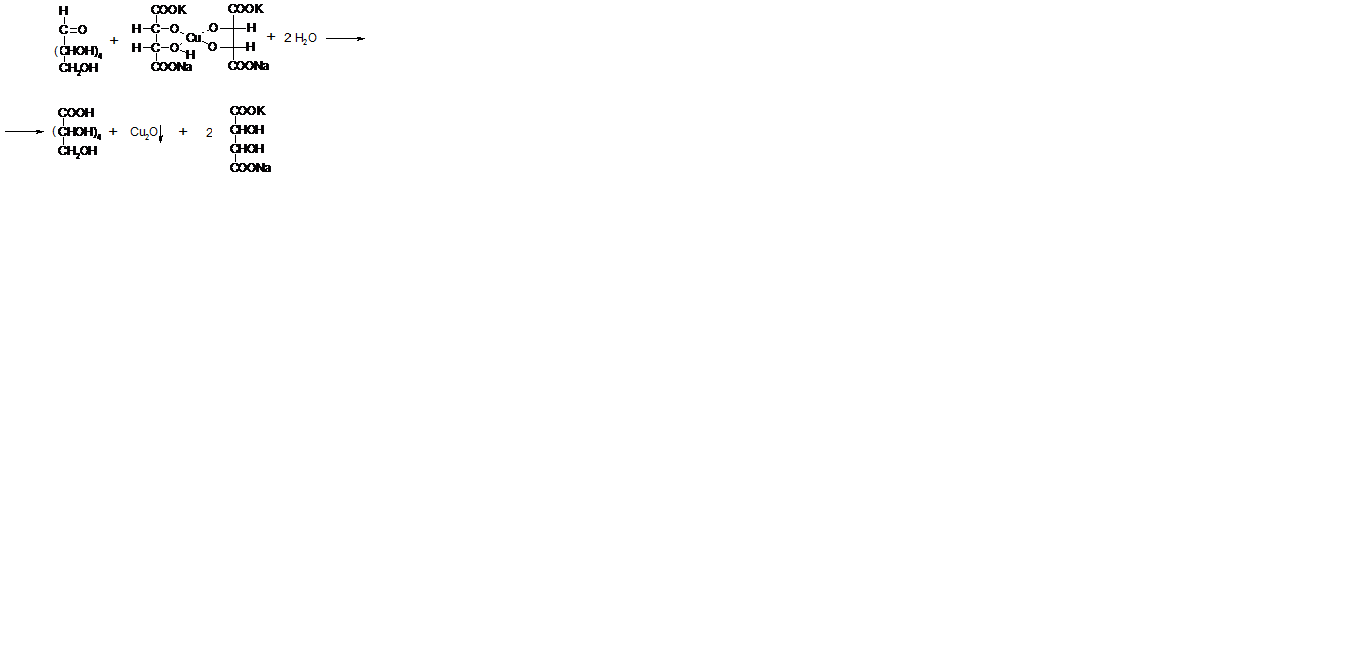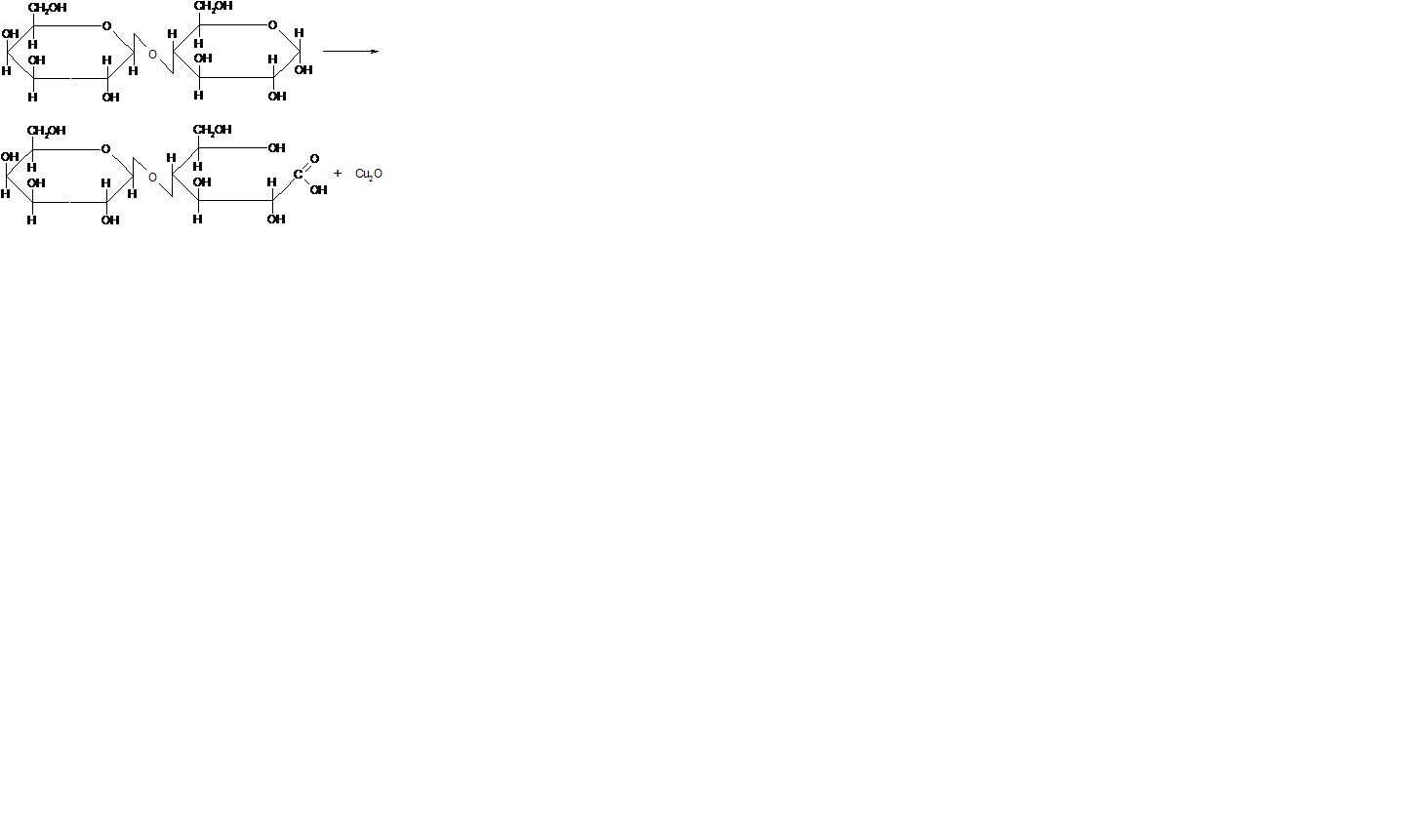Часть I
МОСКВА 2016
УДК 547 (083.131)
ББК 24.2я81
М 54
Авторы: Н.М. Пржевальский, Е.Н. Рожкова, Н.Л. Нам, Г.П. Токмаков, Л.Б. Дмитриев, П.Ю. Углинский, И.В. Лукина.
М 54. Лабораторно-практические занятия по органической химии: Рабочая тетрадь / Н.М. Пржевальский, Е.Н. Рожкова, Н.Л. Нам и др. - М.: Изд-во РГАУ-МСХА, 2015. - 85 с.
Рабочая тетрадь составлена в соответствии с программой курса «Органическая химия» и предназначена для студентов факультетов почвоведения, агрохимии и экологии, садоводства и ландшафтной архитектуры, технологического, агрономии и биотехнологии, зоотехнии и биологии (дневное отделение), выполняющих лабораторные работы на занятиях в практикуме. Темы лабораторных работ, выполнение и оформление которых студенты проводят самостоятельно, включают методы выделения и очистки органических веществ и способы определения основных классов органических соединений. Это даёт возможность закрепить пройденный материал и подготовиться к семинарским и практическим занятиям. Данная тетрадь включает материал интегрированного курса органической химии, составленного в соответствии с программами факультетов почвоведения, агрохимии и экологии, садоводства и ландшафтной архитектуры, технологического, агрономии и биотехнологии, зоотехнии и биологии по различным специальностям и направлениям и составляет единый учебно-методический комплекс с учебником Грандберг И.И., Нам Н.Л. «Органическая химия», М., Юрайт, 2012 г. и практикумом Грандберг И.И. «Практические работы и семинарские занятия по органической химии», М., Дрофа, 2001 г.
Рекомендовано к изданию методической комиссией факультета почвоведения, агрохимии и экологии (протокол № 31 от 17 июня 2016 года).
© Пржевальский Н.М., Рожкова Е.Н., Нам Н.Л., Токмаков Г.П., Дмитриев Л.Б., Углинский П.Ю., Лукина И.В., составители, 2016.
© ФГБОУ ВПО РГАУ-МСХА
имени К.А. Тимирязева, 2016
ОГЛАВЛЕНИЕ
РЕЙТИНГОВАЯ СИСТЕМА.. 5
Для студентов факультетов садоводства и ландшафтной архитектуры, технологического, агрономии и биотехнологии, зоотехнии и биологии. 5
Для студентов факультета почвоведения, агрохимии и экологии. 6
Общие правила поведения и техника безопасности при работе в химической лаборатории.. 8
ЛАБОРАТОРНАЯ РАБОТА №1
РАЗДЕЛЕНИЕ СМЕСИ ДВУХ ЖИДКОСТЕЙ ПЕРЕГОНКОЙ.. 10
ЛАБОРАТОРНАЯ РАБОТА №2
ХРОМАТОГРАФИЯ.. 16
А. Хроматографическое разделение 2,4-динитрофенилгидразонов альдегидов и кетонов на тонком незакреплённом слое оксида алюминия. 16
Б. Разделение аминокислот с помощью распределительной хроматографии на бумаге 20
В. Хроматографическое разделение красителей в тонком закреплённом слое адсорбента (на хроматографических пластинках Alufol или Silufol) 23
ЛАБОРАТОРНАЯ РАБОТА №3
ПЕРЕКРИСТАЛЛИЗАЦИЯ БЕНЗОЙНОЙ КИСЛОТЫ ИЗ ВОДЫ.. 27
ЛАБОРАТОРНАЯ РАБОТА №4
КАЧЕСТВЕННЫЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ. Качественные реакции на азот, серу и галогены.. 31
ЛАБОРАТОРНАЯ РАБОТА №5
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ. Кратная связь. 34
ЛАБОРАТОРНАЯ РАБОТА №6
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ. Гидроксильная группа 37
ЛАБОРАТОРНАЯ РАБОТА №7
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ. Амины.. 42
ЛАБОРАТОРНАЯ РАБОТА №8
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ. Карбонильная группа 46
ЛАБОРАТОРНАЯ РАБОТА №9
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ. Карбоксильная группа 52
ЛАБОРАТОРНАЯ РАБОТА №10
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ. Углеводы.. 58
ЛАБОРАТОРНАЯ РАБОТА №11
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ. Аминокислоты и белки.. 66
Оказание первой медицинской помощи в лабораторном практикуме по органической химии на кафедре физической и органической химии РГАУ-МСХА имени К.А. Тимирязева. 71
Рекомендуемая литература.. 73
РЕЙТИНГОВАЯ СИСТЕМА
ЛАБОРАТОРНАЯ РАБОТА №1
Результаты измерения температуры и объёма перегоняемой жидкости
| V(перегнанной жидкости), мл
| t ºС
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задание 3. Построение кривой перегонки.
На график кривой перегонки* наносят значения температуры и объёма перегоняемой жидкости
Рисунок 2.
Кривая перегонки
Т. кип., ºС
Задание 3. Определение температуры кипения компонентов смеси.
Температуры кипения компонентов смеси определяют по кривой перегонки (рис. 2). Полученные результаты (т. кип. практ.) записывают в таблицу 2.
Таблица 2.
ЛАБОРАТОРНАЯ РАБОТА №2
ХРОМАТОГРАФИЯ
Задание 3.
Измерение положения пятен, соответствующих индивидуальным веществам, и границы подъёма (фронта) жидкости (элюента).
Результаты запишите в таблицу 3.
Таблица 3.
ЛАБОРАТОРНАЯ РАБОТА №3
ЛАБОРАТОРНАЯ РАБОТА №4
ЛАБОРАТОРНАЯ РАБОТА №5
Кратная связь
Общая постановка задачи: освоить методику качественного определения кратной С=С связи в органических соединениях с помощью химических реакций
Оборудование и реактивы:
1. Пробирки
2. 0,2%-ный водный раствор перманганата калия
3. 1% -ный раствор брома в воде или хлороформе
4. Раствор органического соединения, содержащего двойную С=С связь
Краткий конспект*:
Обратите внимание, что при выполнении данной работы удобнее сначала наливать в пробирку окрашенные растворы (растворы брома и перманганата калия), затем прибавлять испытуемый раствор.
Задание 1. Взаимодействие вещества с кратной связью с раствором перманганата калия.
Наблюдения записывают в виде уравнений реакций:
Задание 2. Взаимодействие вещества с кратной связью с бромной водой.
Наблюдения записывают в виде уравнений реакций.
Выводы:
Вопросы для самоконтроля:
1. Напишите уравнения реакции, которая применяется для определения места положения двойной связи.
2. Предложите примеры уравнений реакций, протекающих по правилу Марковникова.
3. В каких случаях используют правило Зайцева? Приведите примеры.
4. Почему для алкенов более характерны реакции электрофильного присоединения?
ЛАБОРАТОРНАЯ РАБОТА №6
Гидроксильная группа
Общая постановка задачи: освоить методику качественного определения гидроксильной группы в органических соединениях с помощью химических реакций
Оборудование и реактивы:
1. Пробирки
2. 1%-ный водный раствор хлорида железа (III)
3. 3%-ный водный раствор сульфата меди (II)
4. 5% -ный водный раствор щелочи (NaOH)
5. Раствор многоатомного спирта
6. Раствор фенола
7. Раствор «енола»
Краткий конспект*:
Задание 1. Взаимодействие фенола с хлоридом железа (III).
Наблюдения записывают в виде уравнений реакций:
Задание 2. Взаимодействие гликоля с гидроксидом меди (II)
Наблюдения записывают в виде уравнений реакций.
Задание 3. Взаимодействие «енола» с хлоридом железа (III)
Наблюдения записывают в виде уравнений реакций.
Задание 4. Цветные реакции фенолов и нафтолов с хлоридом железа.
Реактивы: хлорид железа (Fe3+), 1 н раствор фенола, 1 % - ные спиртовые растворы пирокатехина, резорцина, гидрохинона, пирогаллола и 1 – нафтола. Берут 6 пробирок. В первую пробирку вносят 3 капли 1 н раствора фенола, во вторую - 3 капли раствора пирокатехина, в третью - резорцина, в четвертую - гидрохинона, а пятую - пирогаллола и в шестую - нафтола.
В каждую пробирку добавляют по 1 капле хлорного железа. При этом в первой пробирке появляется фиолетовое окрашивание, во второй - зеленое, в третьей - фиолетовое, в четвертой - зеленое, затем переходящее в желтое, в пятой - красное и в шестой - фиолетовое.
Фенолы с хлоридом железа дают различного цвета комплексные соединения.
Задание 5. Образование этилата натрия и его гидролиз.
Реактивы: металлический натрий, этиловый спирт безводный, раствор фенолфталеина.
В пробирку помещают кусочек металлического натрия, добавляют 3 капли этилового спирта и закрывают отверстие пробирки пальцем. Наблюдается бурное выделение водорода. По окончании реакции подносят отверстие пробирки к пламени горелки. При открытии пробирки водород воспламеняется. На дне пробирки остается беловатый осадок этилата натрия. К нему прибавляют 2 - 3 капли воды (если весь натрий прореагировал). Затем добавляют 1 каплю раствора фенолфталеина. Появляется красное окрашивание, так как этилат натрия в присутствии воды разлагается, выделяя гидроксид натрия.
2C2H5OH + 2Na  C2H5ONa + H2
C2H5ONa + H2
C2H5ONa + HOH  C2H5OH + NaOH
C2H5OH + NaOH
Задание 6. Образование трибромфенола.
Реактивы: бромная вода, раствор фенола.
В пробирку помещают 3 капли бромной воды и добавляют 1 каплю прозрачного раствора фенола. Образуется осадок 2,4,6-трибромфенола.

Данная реакция является реакцией электрофильного замещения в ароматическом ряду.
Выводы:
Вопросы для самоконтроля:
1. Напишите примеры реакций межмолекулярной и внутримолекулярной дегидратации.
2. Как вы думаете, почему нельзя разделить метанол и этанол с помощью простой перегонки?
3. Объясните, почему у этанола (С2Н6О) более высокая температура кипения, чем у диметилового эфира (С2Н6О).
4. Какое влияние на кислотность многоатомных спиртов оказывает внутримолекулярная водородная связь?
ЛАБОРАТОРНАЯ РАБОТА №7
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ
Амины
Общая постановка задачи: освоить методику качественного определения амино-группы в органических соединениях с помощью химических реакций.
Оборудование и реактивы:
1. Пробирки
2. Насыщенный бензольный раствор п -диэтиламинобензальдегида
3. Раствор первичного амина
4. Раствор анилина в диэтиловом эфире
5. Раствор алифатического амина
6. Универсальная индикаторная бумага
7. Фильтровальная бумага
Краткий конспект*:
Задание 1. Взаимодействие п-диэтиламинобензальдегида с первичным амином (реакция Эрлиха).
Обратите внимание, что при выполнении реакции на обнаружение первичных аминов с п- диметиламинобензальдегидом следует очень аккуратно наносить капли раствора амина и п- диметиламинобензальдегида, капли должны перекрываться, но не следует капать один раствор на другой.
Наблюдения записывают в виде уравнений реакций:
Задание 2. Определение основности аминов с помощью универсальной индикаторной бумаги.
Наблюдения записывают в виде уравнений реакций и значений рН исследуемых аминов.
Выводы:
Вопросы для самоконтроля:
1. Объясните различие в оснόвных свойствах алифатических и ароматических аминов.
2. Будет ли влиять введение дополнительной нитрогруппы в п -нитроанилин на основность амино-группы?
3. Предложите способы, с помощью которых можно отличить следующие вещества друг от друга: анилин, метиламин, диметиламин и триметиламин.
ЛАБОРАТОРНАЯ РАБОТА №8
Карбонильная группа
Общая постановка задачи: освоить методику определения карбонильной группы в органических соединениях с помощью химических реакций
Оборудование и реактивы:
1. Пробирки
2. 2%-ный раствор 2,4-динитрофенилгидразина (2,4-ДНФГ)
3. 3%-ный раствор солянокислого гидроксиламина
4. Раствор метилового оранжевого
5. Раствор фуксинсернистой кислоты
6. Растворы соединений с карбонильной группой
Краткий конспект*:
Задание 1. Взаимодействие карбонильного соединения с 2,4-ДНФГ.
Наблюдения записывают в виде уравнений реакций:
Задание 2. Взаимодействие карбонильного соединения с гидрохлоридом гидроксиламина в присутствии индикатора метилового оранжевого.
Наблюдения записывают в виде уравнений реакций:
Задание 3. Взаимодействие карбонильного соединения (альдегида или кетона) с фуксинсернистой кислотой.
Реакция с фуксинсернистой кислотой достаточно чувствительна, поэтому избегайте попадания карбонильных соединений в банку с этим реактивом, пользуйтесь пипетками, предназначенными для каждого индивидуального реактива.
Наблюдения записывают в виде уравнений реакций:
Задание 4. Образование альдегидов из спиртов отщеплением водорода.
Реактивы и материалы: этиловый спирт, спираль из медной проволоки, химический стакан.
Из медной проволоки туго скручивают спираль длинной 5 мм, свободно входящую в пробирку. В сухую пробирку помещают 6 капель этанола и 2 капли воды. Медную спираль прокаливают в пламени горелки и опускают в пробирку с раствором спирта. Спирт бурно вскипает и появляется запах уксусного альдегида. Прокаливание спирали и опускание в пробирку повторяют 4-5 раз. Затем пробирку охлаждают в стакане с водой. Полученный раствор альдегида испытывают на реакцию с 2,4-динитрофенилгидразином (опыт 1) и фуксинсернистой кислотой (опыт 3).

Задание 5. Окисление альдегидов гидроксидом меди.
Реактивы: 40%-ный раствор формальдегида, 0,2 н раствор сульфата меди, 0,2 н раствор гидроксида натрия.
В пробирку помещают 5 капель раствора гидроксида натрия, разбавленного 6 каплями воды, и добавляют 2 капли раствора сульфата меди. К выпавшему осадку гидроксида меди прибавляют 1-2 капли формальдегида и взбалтывают раствор. Нагревают над пламенем горелки только верхнюю часть раствора так, чтобы нижняя часть осталась холодной для контроля. В нагретой части пробирки выделяется желтый осадок гидроксида меди, переходящий затем в красный оксид меди (I). Иногда на чистых стенках пробирки откладывается блестящий металлический слой чистой меди (медное зеркало)

Эта реакция также является качественной реакцией на альдегиды.
Задание 6. Цветная реакция на оксогруппу с нитропруссидом натрия.
Реактивы: ацетон, 40%-ный раствор формальдегида, 0,2 Н раствор гидроксида натрия, 0,5% раствор нитропруссида натрия.
В две пробирки наливают по 5 капель воды и по 2 капли, в одну - ацетона, во вторую - формальдегида. Затем добавляют в каждую по 5 капель 0,5% раствора нитропруссида натрия и по 2 капли гидроксида натрия. Смесь приобретает красно-фиолетовую окраску, которая через несколько минут в пробирке с ацетоном переходит в желтую.
Задание 7.
ЛАБОРАТОРНАЯ РАБОТА №9
Карбоксильная группа
Общая постановка задачи: освоить методику определения карбоксильной группы в органических соединениях с помощью химических реакций.
Оборудование и реактивы:
1. Пробирки
2. Насыщенный водный раствор гидрокарбоната натрия
3. 5%-ный водный раствор щелочи (NaOH)
4. Концентрированные водные растворы нитрата свинца (II) или нитрата серебра
5. Растворы карбоновых кислот (муравьиной и уксусной) – 10%-ный и 50%-ный
6. Универсальная индикаторная бумага
Краткий конспект*:
Задание 1. Взаимодействие карбоновой кислоты с гидрокарбонатом натрия.
Наблюдения записывают в виде уравнений реакций:
Задание 2. Определение кислотности карбоновых кислот.
Наблюдения записывают в виде уравнений реакций и значений рН испытуемых кислот:
Задание 3. Получение нерастворимых солей свинца или серебра.
Обратите внимание, что при выполнении реакции по получению нерастворимых солей карбоновых кислот не следует наливать слишком много щёлочи. Рекомендуется брать разбавленную щёлочь и добавлять её по каплям, поскольку щёлочь может образовывать нерастворимые осадки с нитратом свинца или серебра.
Наблюдения записывают в виде уравнений реакций:
Задание 4. Растворимость в воде различных кислот.
Реактивы: муравьиная, уксусная, масляная, щавелевая, стеариновая кислоты.
3 капли или несколько кристалликов каждой из кислот взбалтывают в пробирке с 5 каплями воды. Если кислота не растворяется, пробирку нагревают.
Горячие растворы охлаждают и отмечают выделение кристаллов некоторых плохо растворимых кислот.
Задание 5. Образование и гидролиз сложного эфира.
Реактивы, материалы и приборы: изоамиловый спирт, ледяная уксусная кислота, серная кислота (плотность 1,84), 2н раствор серной кислоты, насыщенный раствор хлорида натрия, концентрированный раствор гидроксида натрия, водяная баня, пипетка.
Смешивают в двух пробирках по 5 капель уксусной кислоты и изоамилового спирта. В одну пробирку осторожно приливают 1 каплю концентрированной серной кислоты. Встряхнув пробирки, помещают их на 10 минут в горячую (но не кипящую) водяную баню.
Затем охлаждают обе пробирки в холодной воде и добавляют в каждую по 5 капель воды. Отмечают запах образовавшегося сложного эфира. Затем добавляют в каждую по 5 капель насыщенного раствора хлорида натрия и наблюдают изменение объема эфирного слоя.

Пипеткой осторожно снимают слой образовавшегося эфира и сливают по 2 капли эфира в 3 чистые пробирки. В эти пробирки добавляют по 4-5 капель воды и приливают в одну - 2 капли 2н серной кислоты, во вторую - 2 капли концентрированного раствора гидроксида натрия. Пробирки нагревают на водяной бане и отмечают различие в скорости исчезновения капель эфира и его запаха.
Гидролиз эфира быстрее происходит в присутствии щелочи, которая связывает образующуюся при гидролизе кислоту:

Задание 6. Растворимость и обменные реакции мыла.
Реактивы и материалы: мыло хозяйственное, 0,1 Н раствор хлорида кальция, 0,1 Н раствор ацетата свинца, 0,01 Н раствор сульфата меди.
В пробирку помещают около 10 мг твердого мыла, добавляют 10 капель воды и тщательно взбалтывают 1-2 минуты. Затем содержимое пробирки нагревают в пламени горелки. При нагревании мыло растворяется быстрее. Раствор мыла используют для обменных реакций. Для этого в 3 пробирки помещают по 3 капли раствора мыла и добавляют в одну пробирку 2 капли раствора хлорида кальция, в другую - 2 капли раствора ацетата свинца, в третью - 2 капли раствора сульфата меди.
Наблюдают выпадение осадков нерастворимых мыл.

Мыла - соли высших предельных и непредельных органических кислот.
Задание 7. Гидролиз мыла.
Реактивы и материалы: мыло, этиловый спирт, 1%-ный спиртовой раствор фенолфталеина.
В сухую пробирку помещают кусочек мыла, 4 капли спирта и энергично взбалтывают, затем добавляют 1 каплю фенолфталеина.
Окраска раствора не меняется. Затем к спиртовому раствору мыла добавляют по каплям воду. По мере прибавления воды появляется желтое окрашивание.

В результате гидролиза образуются малодиссоциированные карбоновые кислоты и едкий натр.
Выводы:
Вопросы для самоконтроля:
1. Объясните, почему при нанесении на индикаторную бумагу раствора бензойной кислоты окраска индикатора практически не меняется.
2. Объясните, чем отличается муравьиная кислота от остальных карбоновых кислот; подтвердите уравнениями реакций.
3. Объясните, как влияет длина углеродного скелета карбоновой кислоты на ее кислотные свойства.
4. Объясните, почему самым активным в карбоновых кислотах является α-атом водорода.
ЛАБОРАТОРНАЯ РАБОТА №10
Углеводы
Общая постановка задачи: освоить методику качественного определения сахаров с помощью химических реакций.
Оборудование и реактивы:
1. Пробирки
2. 5%-ный водный раствор сульфата меди (II)
3. 10%-ный водный раствор щелочи (NaOH)
4. Аммиачный раствор оксида серебра
5. Реактив Селиванова
6. Раствор альдозы
7. Раствор кетозы
8. Водяная баня
9. Газовая горелка (или электрическая плитка)
Краткий конспект*:
Задание 1. Взаимодействие моносахаридов с гидроксидом меди (II).
Реакцию с солями меди (II) выполняют как для альдозы, так и для кетозы. После нагревания полученных растворов сравнивают результаты. Обратите внимание, что альдегидная группа более активна в реакциях окисления, чем кето-группа.
Наблюдения записывают в виде уравнений реакций:
Задание 2. Взаимодействие кетозы с реактивом Селиванова.
Наблюдения записывают в виде уравнений реакций.
Задание 3. Реакция серебряного зеркала.
Обратите внимание, что для выполнения реакции серебряного зеркала необходима чистая пробирка, при добавлении аммиачного раствора оксида серебра в неё не должны попадать частицы осадка (в противном случае выпадение серебра будет происходить не на стенках пробирки, а в объеме раствора).
Наблюдения записывают в виде уравнений реакций.
Задание 4. Взаимодействие сахаров с медно-виннокислым комплексом (реактивом Фелинга).
Реактивы и материалы: 5%-ные растворы глюкозы, лактозы, сахарозы, реактив Фелинга А и Б.
Раствор А: сульфат меди в водном растворе (3,5 г на 50мл)
Раствор Б: тартрат калия, натрия в водно-щелочном растворе (17,3г сегнетовой соли и 6г гидроксида натрия в 50мл воды)
В пробирке смешивают по 5 капель реактива Фелинга А и Б и используют в дальнейшей работе.
В три пробирки наливают по 5 капель исследуемых сахаров: в первую - глюкозу, во вторую - лактозу, в третью – сахарозу, и в каждую добавляют по 1-2 капли реактива Фелинга. Смесь в пробирках нагревают в водяной бане. Наблюдают выпадение оксида меди (I) в пробирках с глюкозой и лактозой. В пробирке с сахарозой сохраняется синий цвет
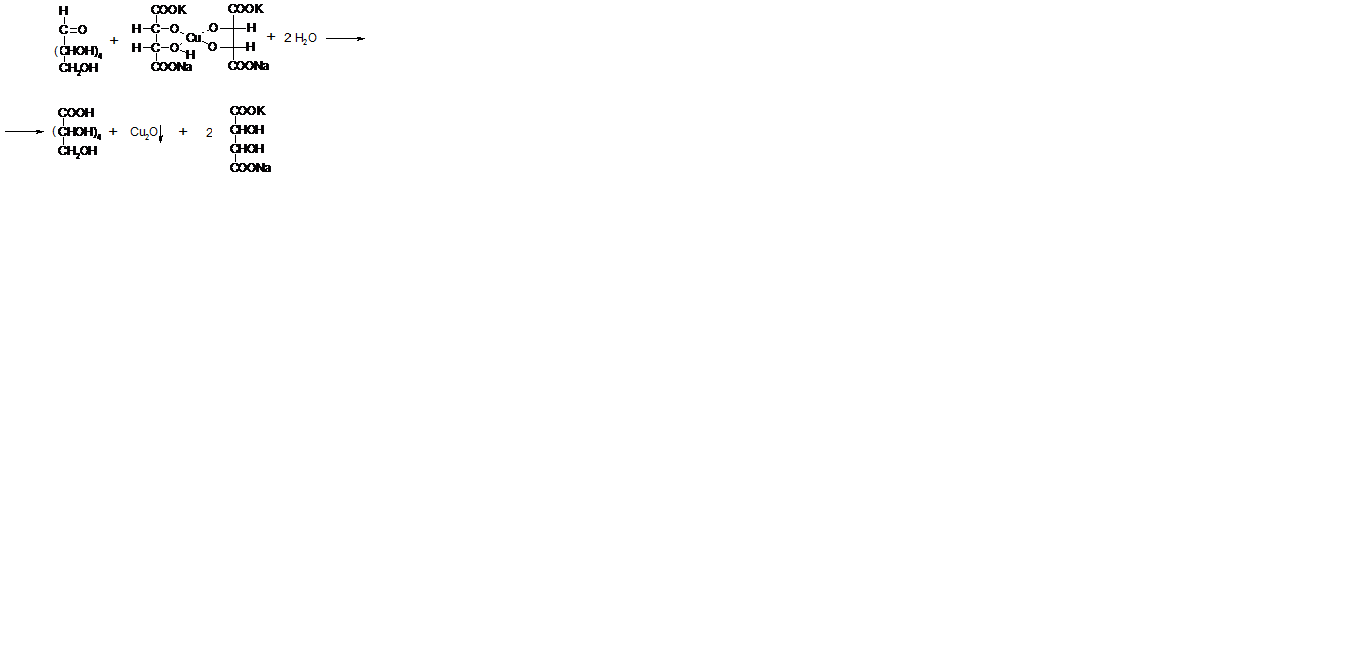
Восстанавливать соединения меди из реактива Фелинга при нагревании способны лишь те сахара, которые имеют в молекуле свободную альдегидную группу или глюкозидный гидроксил.
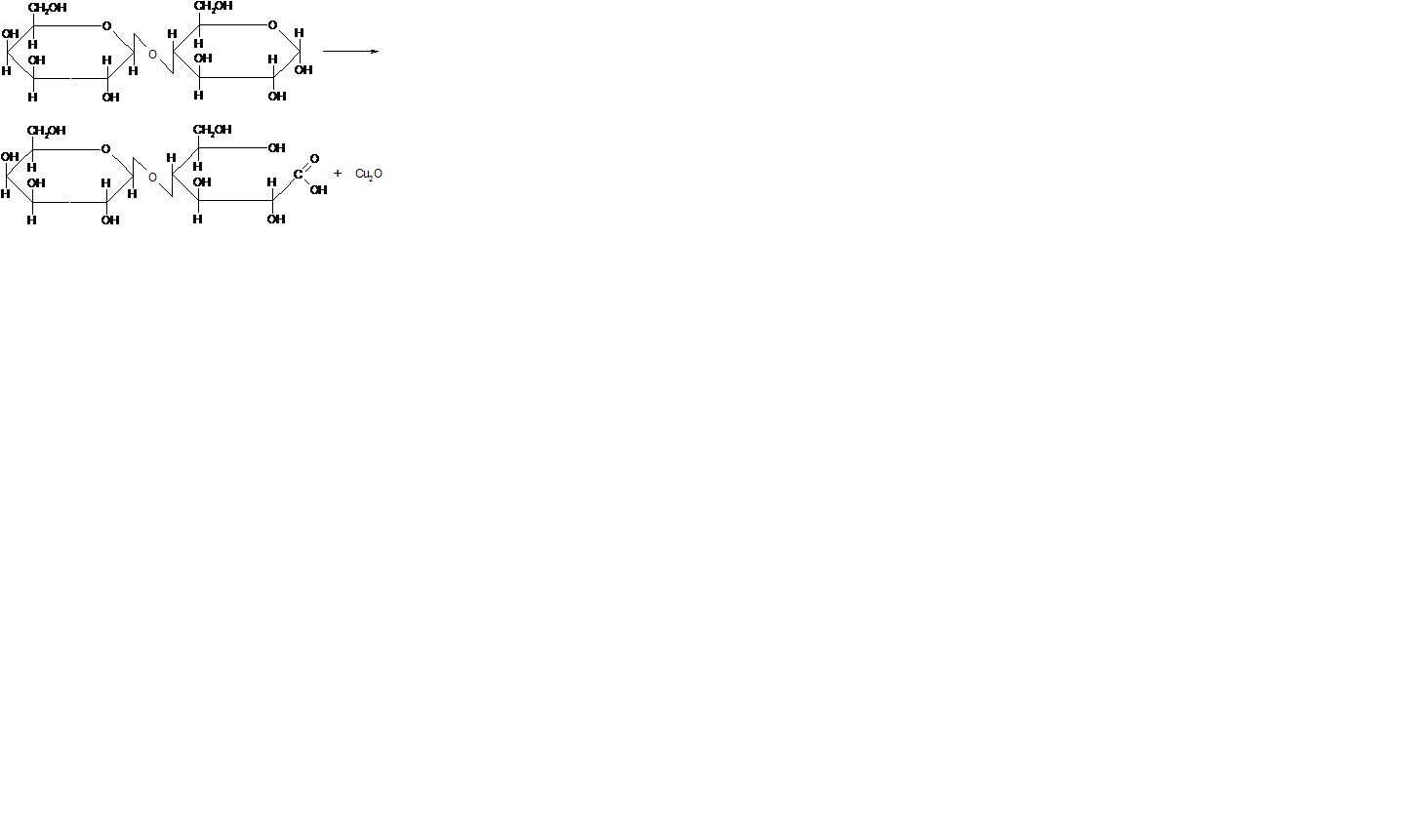
Сахароза не восстанавливает раствор Фелинга, что указывает на отсутствие в ее молекуле свободной альдегидной группы.
Задание 5. Образование озазона глюкозы.
Реактивы: 0,5%-ный раствор глюкозы, солянокислый фенилгидразин, ацетат натрия.
В пробирку вносят небольшое количество кристаллов солянокислого фенилгидразина и такое же количество ацетата натрия, добавляют 3 капли раствора глюкозы. Ставят пробирку в заранее нагретую до кипения водяную баню. Через 10-15 минут в пробирке образуется желтый кристаллический осадок озазона глюкозы. В растворе смеси солянокислого фенилгидразина и ацетата натрия в результате обменной реакции образуется уксуснокислый фенилгидразин, последний, как соль слабой кислоты и слабого основания, сильно гидролизован и в растворе находится в равновесии со свободным фенилгидразином, который реагирует с углеводом. Синтез озазона протекает через стадии образования фенилгидразона и кетофенилгидразона глюкозы (см. ниже).
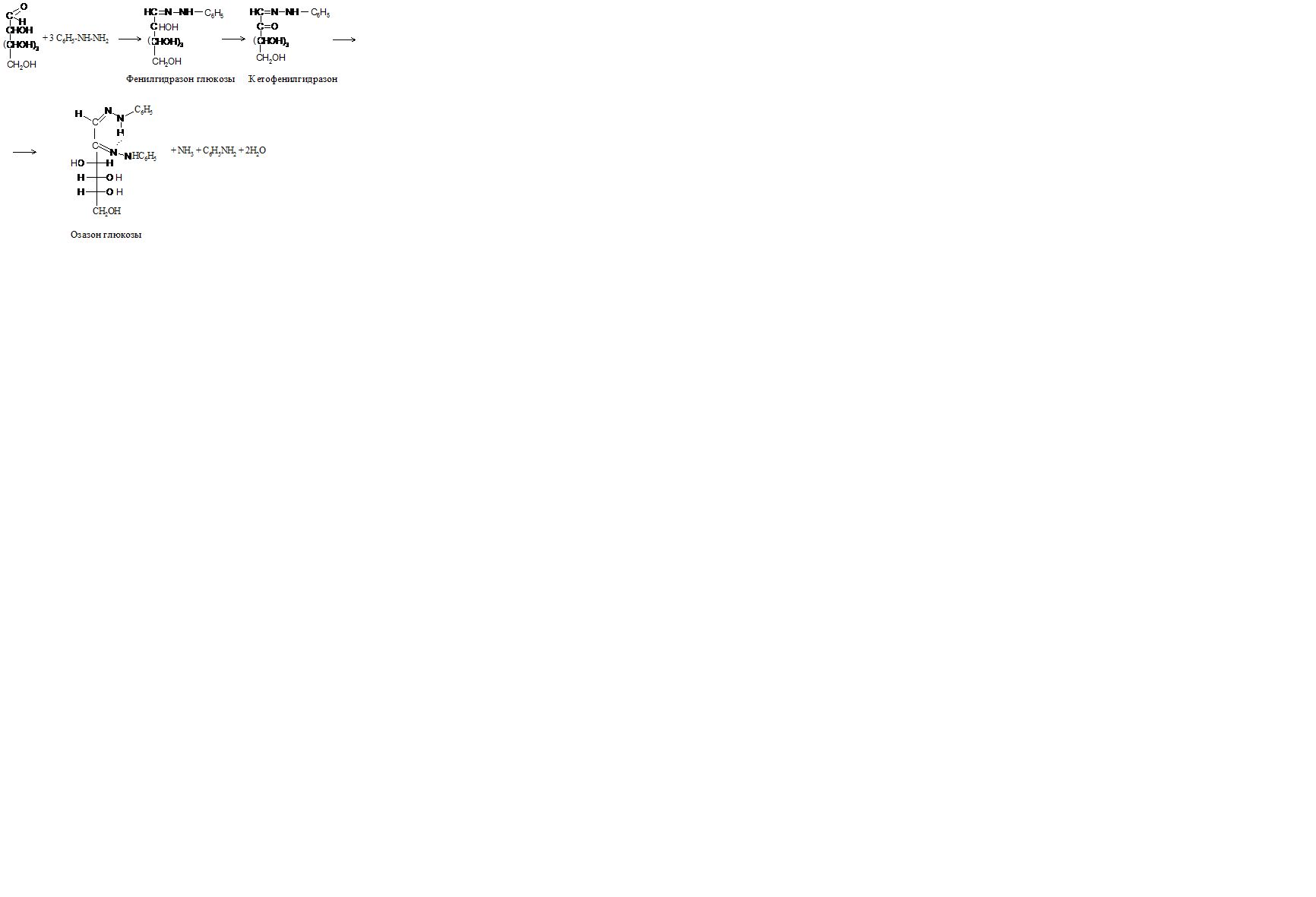
Озазоны - труднорастворимые вещества желтого цвета - служат для идентификации углеводов.
Задание 6. Гидролиз сахарозы.
Реактивы: 1%-ный раствор сахарозы, 2 н раствор серной кислоты, реактив Фелинга (А и Б).
Наливают в 2 пробирки по 5 капель раствора сахарозы, в одну из пробирок добавляют 2 капли разбавленной серной кислоты. Обе пробирки одновременно нагревают в кипящей водяной бане 10-15 минут, затем охлаждают и проводят с содержимым каждой из них реакции с реактивом Фелинга..
Отмечают различия в результатах реакции для раствора сахарозы, нагревавшихся с кислотой и без кислоты.
Сахароза не имеет в молекуле ни свободных гликозидных гидроксилов, ни карбонильных групп и поэтому существенно отличается по реакционной способности от моносахаридов и большинства дисахаридов.
При гидролизе сахароза расщепляется на α,D-глюкопиранозу и β,D- фруктофуранозу.

Реакция с реактивом Фелинга указывает, что в результате гидролиза в растворе появляются карбонильные группы, способные восстанавливать двухвалентную медь до оксида меди (I).
Задание 7. Гидролиз крахмала кислотами.
Реактивы: 2%-ный раствор крахмального клейстера, 2 н раствор серной кислоты, 0,1н раствор йода в KI, 2 н раствор гидроксида натрия, реактив Фелинга (А и Б).
В большую пробирку помещают 20 капель крахмального клейстера, 6 капель серной кислоты, пробирку встряхивают и ставят в кипящую водяную баню. Каждую минуту отбирают пипеткой по 1 капле гидролизата и переносят в пробирку с раствором йода. Для этого предварительно в 8 пробирок помещают по 1 капле раствора йода и по 5 капель воды.
Последовательные пробы обнаруживают постепенное изменение окраски при реакции с йодом (синюю, сине-фиолетовую, красно-фиолетовую, красновато-оранжевую, оранжевую и желтую).
Гидролиз крахмала заканчивают, когда гидролизат с йодом не будет давать цветной реакции. Раствор охлаждают, нейтрализуют раствором щелочи, добавляют 2 капли реактива Фелинга и нагревают. Выпадает осадок оксида меди (I), что указывает на присутствие мальтозы и глюкозы.
При нагревании с разбавленными минеральными кислотами крахмал подвергается гидролизу по следующей схеме:

крахмал декстрины мальтоза глюкоза
Крахмал с йодом дает синее окрашивание, декстрины, в зависимости от величины цепочки, окрашиваются йодом в фиолетовые, красные, оранжевые цвета. Мальтоза и глюкоза не изменяют окраски йода.
Выводы:
Вопросы для самоконтроля:
1. Будет ли рибоза давать реакцию серебряного зеркала? Ответ обоснуйте.
2. Напишите таутомерные формы для альдопентозы.
3. Приведите примеры восстанавливающих и невосстанавливающих дисахаридов. Покажите различия в их строении и химических свойствах.
ЛАБОРАТОРНАЯ РАБОТА №11
Аминокислоты и белки
Общая постановка задачи: освоить методику качественного определения аминокислот и белков с помощью химических реакций.
Оборудование и реактивы:
1. Пробирки
2. 2%-ный водный раствор сульфата меди (II)
3. Кристаллический медный купорос
4. 10%-ный водный раствор щелочи (NaOH)
5. Кристаллический ацетат натрия
6. 3%-ный водный раствор хлорида железа (III)
7. 0,03%-ный раствор нингидрина
8. Концентрированная азотная кислота
9. Концентрированный раствор аммиака
10. Растворы аминокислот
11. Раствор белка (10%-ный водный раствор яичного альбумина)
12. Водяная баня
13. Газовая горелка (или электрическая плитка)
Краткий конспект*:
Задание 1. Взаимодействие аминокислоты с хлоридом железа (III).
Наблюдения записывают в виде уравнений реакций:
Задание 2. Взаимодействие аминокислоты с медным купоросом в присутствии ацетата натрия.
Обратите внимание, что в данной реакции используется кристаллический медный купорос.
Наблюдения записывают в виде уравнений реакций.
Задание 3. Взаимодействие аминокислоты с нингидрином.
Наблюдения записывают в виде уравнений реакций.
Задание 4. Ксантопротеиновая реакция на белки.
Будьте очень внимательны при работе с концентрированной азотной кислотой и концентрированным раствором аммиака при выполнении ксантопротеиновой реакции на белки. Данную реакцию выполняют только в вытяжном шкафу при включенной вентиляции!
Запишите свои наблюдения:
Задание 5. Биуретовая реакция на белки.
Запишите свои наблюдения:
Задание 6. Реакция на серу в белках.
Запишите свои наблюдения:
Выводы:
Вопросы для самоконтроля:
1. Приведите примеры реакций, которые подтверждают амфотерные свойства аминокислот.
2. Приведите у



 C2H5ONa + H2
C2H5ONa + H2