Гигиеническое значение воды
Воду можно рассматривать как ведущий показатель санитарного благополучия населения. Доброкачественная вода необходима для поддержания чистоты тела и закаливания, уборки жилища, приготовления пищи и мытья посуды, стирки белья, поливки улиц и зеленых насаждений.
Народнохозяйственное значение воды состоит в том, что она служит источником электроэнергии, используется как средство водного транспорта, необходима для промышленно сти и сельского хозяйства.
Психогигиеническое и оздоровительное значение воды состоит в ее использовании для купания, закаливания, занятий спортом. Хороший эффект дают физиотерапевтические водные процедуры и питье минеральных вод.
Велико также эстетическое значение воды и ее роль в воздействии на эмоциональное состояние человека.
Большая положительная роль воды в жизни человека не исключает возможности неблагоприятного воздействия, которое она может оказывать при определенных условиях.
Эпидемиологическое значение воды связано с тем, что через нее могут передаваться многие заболевания:
Инфекционные заболевания ( кишечные инфекции бактериальной природы(холера, брюшной тиф, паратифы А и Б, дизентерия).
Легионеллез, который вызывается жгутиковой бациллой Legionellapneumophilla, передающейся воздушно-капельным путем и являющейся одной из главных причин тяжелой спорадической пневмонии.
Вирусные — возбудителей инфекционного гепатита (болезнь Боткина), полиомие лита, энтеровирусов (болезнь Коксаки А и В) ив меньшей степени аденовирусов (бассейновые конъюнктивиты).
Лептоспирозы ( желтушный лептоспироз - болезнь Васильева-Вейля и безжелтушный лептоспироз (водная лихорадка).
Зоонозные инфекции ( туляремия, бруцеллез, сибирская язва).
Протозойные инвазии (амебиаз или амебная дизентерия, балантидиоз и лямблиоз).
Глистные инвазии (аскаридоз, анкилостомидоз, стронгилоидоз).
Грибковые заболевания, в частности возбудителей эпидермофитии.
Механизмы и факторы инфицирования воды различны. Большую опасность в эпидемиологическом отношении представляют неочищенные или недостаточно очищенные фекально-хозяйственные сточные воды, стоки инфекционных больниц, ветеринарных лечебниц, предприятий, связанных с разделкой туш и обработкой шкур животных. Попадание возбудителей инфекционных болезней в открытые водоемы возможно также с ливневыми водами и выбросами сточных вод пассажирских и промысловых судов. Большую опасность представляет питьевая вода в случае, если она не подвергается очистке и обеззараживанию перед употреблением.
Значение минерального (солевого) состава воды.
Минеральный состав природных вод может способствовать развитию неинфекционных заболеваний. Употребление воды с несоответствующим нормативам солевым составом может быть причиной развития флюороза, нитратной метгемоглобинемии, нарушений водно-солевого обмена, диспепсических расстройств и т.д.
Косвенное влияние состава и свойств природных вод проявляется в ограничении употребления воды, имеющей неблагоприятные органолептические свойства (запах, вкус, цветность, мутность). Вода, обладающая неприятным запахом и вкусом, вызывает нарушения водно-солевого режима, секреторной деятельности желудка, а также ограничение или отказ населения от использования такой воды в питьевых целях. Так соли железа придают воде чернильный привкус, соли тяжелых металлов — вяжущий привкус, хлориды — соленый, сульфаты и фосфаты — горький привкус. Поэтому их содержание в питьевой воде ограничивается по пределу вкусового ощущения. Вода с повышенной минерализацией отрицательно влияет на секрецию желудка, вызывает отеки, нарушает водно-солевой обмен, хуже утоляет жажду.
Солевой состав природных вод формируется в первую очередь в результате вымывания веществ из почвы и в связи с этим отражает химическую структуру почвы данной местности. Медь, йод, бром в значительной количестве могут поступать из атмосферы.
Однако довольно часто химические вещества, находящиеся в воде, имеют не природное происхождение, а поступают в водоемы с хозяйственно-фекальными или промышленными стоками.
Степень и характер минерализации воды в той или иной местности отличается известным постоянством и изменение химического состава воды, не связанное с естественными причинами (весенние паводки и др.) может рассматриваться как показатель загрязнения теми или иными отбросами. Количество минеральных солей, содержащихся в воде, выражают в миллиграммах на 1л или в отдельных случаях – в миллиграмм-эквивалентах на 1 литр.
Количественно величина солевого состава воды или степень минерализации воды определяется величиной сухого остатка.
Сухой остаток характеризует сумму всех химических соединений (минеральных и органических), растворенных в 1 л воды. Величина сухого остатка влияет на вкусовые качества воды. Величина сухого остатка для питьевой воды должна быть не более 1000 мг/л. Вода с большим содержанием солей имеет неприятный солоноватый или горьковатый привкус. Длительное использование для питья высокоминерализованных вод приводит к ряду изменений в организме. Так у населения, постоянно потребляющего солоноватые подземные воды, содержащие хлоридно-сульфатно-натриевые соли, отмечается снижение диуреза, задержка воды в тканях, отеки, нарушение водно-электролитного баланса и секреторной деятельности желудочно-кишечного тракта. Наиболее выраженные патологические изменения в организме проявляются при употреблении для питьевых целей морской воды, минерализация которой составляет от 10 г/л. Даже при кратковременном употреблении такой воды, нарушается кислотно-щелочное равновесие и повышается остаточный азот в крови, ухудшается сердечная деятельность. Все эти симптомы наблюдаются на фоне резкой жажды и утомляемости. В тяжелых случаях может наступить смерть.
Кроме того, более высокие величины сухого остатка, если они не оправдываются геологическими особенностями почвы, дают основание предполагать о загрязнении воды посторонними примесями.
Однако употребление излишне деминерализованной (мягкой), а тем более дистиллированной воды также неблагоприятно для организма. Такая вода имеет сниженные вкусовые свойства. Ее длительное использование для питья нарушает регуляцию водно-электролитного баланса, вызывает увеличение содержания электролитов в сыворотке крови и моче с их ускоренным выведением из организма, снижение осмотической резистентности эритроцитов, изменения в сердечно-сосудистой системе. Нижним пределом минерализации, при котором поддерживается гомеостаз организма, является сухой остаток в 100 мг/л, оптимальным уровнем минерализации является сухой остаток в 200-300 мг/л.
Есть еще один показатель, который интегрально характеризует содержание в воде минеральных компонентов. Это величина жесткости воды.
Жесткость воды зависит от содержания в ней солей щелочноземельных металлов - кальция и магния, главным образом в виде двууглекислых и отчасти сернокислых, хлористых, азотнокислых и азотисто-кислых соединений. Иногда она обусловливается также наличием солей закисного железа, марганца и алюминия.
Физиологическое значение солей жесткости невелико. Очень жесткая вода, если в ней содержится много сернокислого магния и присутствует сернокислый натрий или, реже калий, способна вызвать у человека, привыкшего к мягкой воде, послабляющее действие. Косвенное влияние жесткой воды на функции организма может казаться в худшем усвоении пищи, сварной в жесткой воде. Овощи и мясо развариваются в жесткой воде плохо, потому, что находящиеся в них белковые вещества образуют с щелочами нерастворимые соединения, препятствующие воде проникать внутрь вещества.
Большое значение имеет жесткость воды в санитарном и техническом отношении. Требуется гораздо больше мыла при мытье тела и стирке, так как образование пены не наступает до тех пор, пока не выпадут из воды нерастворимые известковые и магнезиальные соли.
Вода с высокой жесткостью непригодна для промышленных целей. Например, в текстильной промышленности образующиеся нерастворимые известковые мыла, осаждаясь в волокнах, сообщают тканям грубость и затрудняют окраску.
Наконец, жесткость воды иногда может служить качестве санитарного показателя: увеличение жесткости воды может зависеть от загрязнения воды, так как одной из причин увеличения жесткости воды является распад органических веществ. Жесткость воды может также увеличиваться вследствие попадания в источник щелочных сточных вод.
Различают три вида жесткости: общую, постоянную и устранимую (временную).
Общая жесткость - это жесткость сырой воды, обусловливаемая всеми соединениями кальция и магния (иногда железа и марганца), независимо от того, с какими анионами связаны вышеназванные катионы.
Постоянная жесткость – жесткость воды после одночасового кипячения, зависящая от присутствия в воде различных солей, не дающих осадка при кипячении. Главным образом это сульфаты и хлориды кальция и магния.
Устранимая (временная) жесткость – жесткость воды, устраняемая при кипячении, что объясняется разрушением бикарбонатов кальция Ca (HCO3)2 и в меньшей степени магния Mg(HCO3)2 , а иногда и железа Fe(HCO3)2 и превращения их в нерастворимые углекислые соли (монокарбонаты), которые оседают на стенках сосудов в виде накипи (CaCO3, MgCO3). Таким образом, устранимая жесткость есть часть общей жесткости, которую можно вычислить по разнице между общей и постоянной жесткостью.
Нормируется общая жесткость воды, но практический интерес представляет и устранимая жесткость, например при выборе дозы сернокислого алюминия при коагуляции воды.
Жесткость воды выражается в миллиграмм-эквивалентах на 1 литр воды или в условных градусах жесткости.
1 мг-экв соответствует 28 мг CaO(окиси кальция)
1° жесткости соответствует 10 мг CaO
Таким образом 1 мг-экв = 2,8
Хлориды. Хлористые соли встречаются практически во всех водоисточниках. Их содержание в воде зависит от характера почв и увеличивается с северо-запада на юго-восток. Хлориды влияют на вкус воды, придавая ей солоноватый привкус. Допускается содержание хлоридов до пределов вкусовой ощутимости, т.е. не более 350 мг/л
В некоторых случаях хлориды можно использовать как показатель загрязнения. Хлориды выводятся из организма человека через почки, поэтому хозяйственно-бытовые сточные воды всегда содержат много хлоридов. Но всегда нужно помнить, что хлориды могут использоваться в качестве показателей загрязнения только в сравнении с местными, региональными нормами. В том случае, когда содержание хлоридов в чистой воде данной местности не известно, решить вопрос о загрязнении воды только по одному этому показателю невозможно. К примеру, большие количества хлоридов могут быть в подземных водах в местах с солончаковой почвой и в этом случае они не указывают на загрязнение воды.
Сульфаты. При превышении обычного для данной местности содержания солей серной кислоты они могут служить признаком загрязнения воды органическими веществами. Сера является составной частью белков, которые при разложении и последующем окислении дают соли серной кислоты. Но главное значение сульфатов заключается том, что они портят вкус воды и вызывают у некоторых людей расстройство деятельности кишечника (послабляющее действие).
Фосфаты. В чистых водах соли фосфорной кислоты обычно не встречаются и их наличие говорит о сильном загрязнении воды разлагающимися органическими веществами, поступающими из почвы или с промышленными стоками.
Медь, свинец, цинк, ртуть и др. В питьевой воде не должны находиться ядовитые вещества. Отдельные элементы могут встречаться в ней как примеси, попадающие с промышленными стоками.
Йод. В природных водах содержание йода незначительно и составляет небольшую часть суточной потребности в нем человека (100-200 γ), которая покрывается в основном за счет пищи. Количество йода в воде рассматривается как своего рода индикатор его содержания во внешней среде. Если йода мало в воде, то его мало и в почве, и в растительных продуктах, произрастающих в данном районе и, наконец, в организме животных и человека. В связи с недостаточным поступлением йода в организм щитовидная железа вынуждена усиленно функционировать (йод входит в состав тироксина – гормона щитовидной железы), что ведет к ее гипертрофии и нарушению деятельности всего организма.
Среди профилактических мероприятий наибольшее распространение получило употребление йодированной поваренной соли (массовая профилактика). Также практикуется выдача населению йодида калия в виде таблеток, в первую очередь школьникам, беременным и кормящим матерям (групповая профилактика).
Фтор. Содержащийся в воде фтор обеспечивает значительную часть суточной потребности человека в этом микроэлементе. Содержание фтора в природных водах колеблется. Наименьшие концентрации наблюдаются в воде поверхностных водоисточников, а наибольшие - в подземных водах.
Изменение концентрации фтора в питьевой воде оказывает большое влияние на состояние твердых тканей – костей и зубов, а также на некоторые физиологические функции. Установлено, что пониженное содержание фтора (менее 0,5 мг/л) служит одной из причин кариеса зубов. Концентрации фтора выше допустимых (норма его содержания в воде зависит от климатического пояса) вызывают другое заболевание зубов – флюороз (пятнистость, крапчатость эмали). На поверхности эмали появляются меловидные полоски и пятна; дальнейшем происходит окрашивание эмали в коричневый цвет, флюорозные пятна увеличиваются, появляется пигментация эмали темно-желтого или коричневого цвета, наступают необратимые изменения в зубах, касающееся не только эмали, но иногда и дентина, вплоть до полного разрушения коронок. В течение длительного времени считалось, что флюороз выражается только элективным поражением зубов и скелета.
Однако фтор поражает многие органы и ткани. При длительном (в течение 10-20 лет) потреблении воды с концентрацией фтора 10 мл и выше могут наблюдаться изменения со стороны костно-суставного аппарата: остеосклероз, диффузный остеопороз, костные отложения на ребрах, деформация скелета. Фтор имеет исключительное сродство ко всем кальцинированным тканям и внетканевым отложениям кальция. Поэтому часто атеросклеротические изменения сосудов сопровождаются местными отложениями фтора. Таким же вторичным фторозом часто сопровождается желчно-каменная и мочекаменная болезнь.
Реакция воды. Природная вода обычно имеет слабощелочную реакцию. В норме pH питьевой воды находится в пределах от 6,5 до 8,5. Сильнокислой считается вода с pH ниже 4,0, что обусловлено либо наличием гуминовых веществ, либо проникновением в водоем промышленных сточных вод. Сильнощелочная реакция (pH выше 10) указывает на поступление в водоем соответствующих стоков либо наблюдается при цветении водоема.
Таблица 1. Показатели качества источников централизованного хозяйственно-питьевого водоснабжения (извлечение из ГОСТа 2761—84)
|
Определяемые показатели
| Показатели качества воды
|
| 1-й
| 2-й
| 3-й
|
|
I. Подземные источники водоснабжения
|
| Мутность, мг/дм3, не более
| 1,5
| 1,5
| 10
|
| Цветность, градусы, не более
| 20
| 20
| 50
|
| Водородный показатель (рН)
| 6-9
| 6-9
| 6-9
|
| Железо (Fe), мг/дм3, не более
| 0,3
| 10
| 20
|
| Марганец (Мп), мг/дм3, не более
| 0,1
| 1
| 2
|
| Сероводород (H2S), мг/дм3, не более
| Отсутствие
| 3
| 10
|
| Фтор (F), мг/дм3, не более
| 1,5-0,7*
| 1,5-0,7*
| 5
|
| Окисляемость перманганатная, мг/дм по кислороду, не более
| 2
| 5
| 15
|
| Число бактерий группы кишечной палочки (БГКП) в1 дм3, не более
| 3
| 100
| 1000 1000
|
|
Подземные источники
| 1
| Вода удовлетворяет требованиям
СанПиН 2.1.4.1074-01
| Обработка не требуется
|
| 2
| Имеются отклонения по отдельным показателям
| Аэрирование, фильтрация, обеззараживание.
|
| 3
| Имеются существенные отклонения
| Аэрирование, отстаивание, фильтрация, использование реагентов и др.
|
|
Поверхностные источники
| 1
| Слабое микробное и органическое загрязнение
| Фильтрация с коагуляцией или без нее, обеззараживание
|
| 2
| Среднее загрязнение
| Коагуляция, отстаивание, фильтрация, обеззараживание
|
| 3
| Сильное загрязнение, требующее дополнительных методов обработки
| Коагуляция, отстаивание, фильтрация, обеззараживание. Применение дополнительной ступени осветления, сорбционных методов, более эффективных методов обеззараживания
|
Практическая работа. Определение качества воды на предмет ее соответствия ГОСТ 2761-84. «Источники централизованного хозяйственно-питьевого водоснабжения. Гигиенические, технические требования и правила выбора»
Приборы, реактивы, материалы: Лабораторная посуда и реактивы для химического исследования воды, таблицы с нормативными документами.
Посуда:
1. колба на 200 мл;
2. бюретка
3. реторта
Реактивы:
1. аммиачный буферный раствор;
2. индиктор – эриохром черный;
3. 0,05 н трилон Б.
Принцип метода
Если в воду, содержащую ионы кальция и магния, ввести какой-либо индикатор, дающий цветное соединение с этими ионами, то при прибавлении трилона Б - двунатриевой соли этилендиаминотетрауксусной кислоты – произойдет изменение окраски в точке эквивалентности, т.е. когда добавленное количество трилона Б свяжет ионы кальция и магния в прочный комплекс. По количеству прибавленного раствора трилона Б к взятому объему воды и определят общую жесткость воды. В качестве индикатора применяют эриохром-черный.
Методика определения
В коническую колбу емкостью 200 мл наливают 50,0 мл испытуемой воды, добавляют 2 мл аммиачного буферного раствора, 4 капли индикатора эриохрома-черного. Смесь титруют из бюретки (медленно при интенсивном перемешивании) 0,05 н раствором трилона Б до перехода окраски из винно-красной через фиолетовую в синюю.
Общую жесткость определяют по формуле:
 , где
, где
a – количество израсходованного раствора трилона Б;
N – нормальность раствора;
V- объем воды, взятой для исследования;
Таким образом,
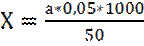 ,т.е. Х=а (мг-экв/л)
,т.е. Х=а (мг-экв/л)
Т.е. количество израсходованного трилона Б соответствует общей жесткости воды в мг-экв/л.
Для перерасчета жесткости воды в условные градусы необходимо величину жесткости, измеренную в мг-экв/л умножить на коэффициент 2,8.
Посуда:
1. пробирки;
Реактивы:
1.азотная кислота (HNO3);
2. азотнокислое серебро (AgNO3);
Принцип метода
Хлориды в воде определяются путем их осаждения азотнокислым серебром (AgNO3)с образованием белого осадка хлористого серебра (AgCl), нерастворимого в азотной кислоте и растворимого в аммиаке и других едких щелочах.
NaCl+ AgNO3 = AgCl↓+NaNO3
Азотнокислое серебро осаждает также углекислые и фосфорнокислые соли, образуя такой же белый осадок, как и с солями хлора. Поэтому углекислые и фосфорнокислые соли надо предварительно исключить из реакции, что достигается прибавлением азотной кислоты, в которой они растворяются.
Методика определения
Для определения хлоридов 1/3 пробирки заполняют испытуемой воды, подкисляют 2-3 каплями азотной кислоты и затем добавляют несколько капель 10% азотнокислого серебра. В присутствии небольшого количества хлоридов образуется белая муть или легкая опалесценция, при значительном же количестве образуется белый творожистый осадок.
Посуда:
1. колба на 50-100 мл;
2. бюретка
Реактивы:
1. индикатор – 10% раствор хромовокислого калия (К2СrO4);
2. титрованный раствор азотнокислого серебра (AgNO3), 1 мл которого может осадить 1 мг хлора.
Принцип метода
Содержание хлоридов в воде вычислят по количеству израсходованного раствора азотнокислого серебра. В качестве индикатора применяют хромовокислый калий К2СrO4, который начинает вступать в реакцию с азотнокислым серебром лишь после осаждения всех хлористых солей; после этого лишняя капля прилитого раствора азотнокислого серебра даст в соединении с хромовокислым калием хромовокислое серебро Ag2СrO4, в связи с чем желтоватый цвет титруемой жидкости изменится в красновато-бурый, что и будет служить показателем конца осаждения хлоридов
Методика определения:
В колбу наливают 10 исследуемой воды, добавляют 1-2 капли 10% раствора К2СrO4 и прибавляют по каплям титрованный раствор AgNO3 из бюретки, до изменения цвета (с желтого в кирпично-красный). Считают количество капель, израсходованных на титрование.
Расчет содержания хлоридов в воде производится по формуле:
 (мг),
(мг),
где a - число капель раствора AgNO₃
Посуда:
1. пробирки
2. пипетка
Реактивы:
1. хлористый барий (BaCl2);
2. соляная кислота (HCl)
Качественное определение сульфатов
Принцип метода
Определение в воде сульфатов производят с помощью хлористого бария (BaCl2), который осаждает сульфаты с образованием белого кристаллического осадка (BaSO4), нерастворимого в соляной кислоте:
Na2SO4 +BaCl2 = BaSO4↓+2NaCl.
Белый осадок от хлористого бария могут давать также углекислые, фосфорнокислые и некоторые другие соли. Для предотвращения этого необходимо предварительно прибавить соляную кислоту, которая переводит указанные соли в хлористые, и они в дальнейшем не мешают реакции определения солей серной кислоты.
Методика определения
Для определения сульфатов наливают треть пробирки испытуемой воды, прибавляют 2-3 капли соляной кислоты и несколько капель 10% раствора хлористого бария и нагревают до кипения.
Гигиеническое значение воды
Воду можно рассматривать как ведущий показатель санитарного благополучия населения. Доброкачественная вода необходима для поддержания чистоты тела и закаливания, уборки жилища, приготовления пищи и мытья посуды, стирки белья, поливки улиц и зеленых насаждений.
Народнохозяйственное значение воды состоит в том, что она служит источником электроэнергии, используется как средство водного транспорта, необходима для промышленно сти и сельского хозяйства.
Психогигиеническое и оздоровительное значение воды состоит в ее использовании для купания, закаливания, занятий спортом. Хороший эффект дают физиотерапевтические водные процедуры и питье минеральных вод.
Велико также эстетическое значение воды и ее роль в воздействии на эмоциональное состояние человека.
Большая положительная роль воды в жизни человека не исключает возможности неблагоприятного воздействия, которое она может оказывать при определенных условиях.
Эпидемиологическое значение воды связано с тем, что через нее могут передаваться многие заболевания:
Инфекционные заболевания ( кишечные инфекции бактериальной природы(холера, брюшной тиф, паратифы А и Б, дизентерия).
Легионеллез, который вызывается жгутиковой бациллой Legionellapneumophilla, передающейся воздушно-капельным путем и являющейся одной из главных причин тяжелой спорадической пневмонии.
Вирусные — возбудителей инфекционного гепатита (болезнь Боткина), полиомие лита, энтеровирусов (болезнь Коксаки А и В) ив меньшей степени аденовирусов (бассейновые конъюнктивиты).
Лептоспирозы ( желтушный лептоспироз - болезнь Васильева-Вейля и безжелтушный лептоспироз (водная лихорадка).
Зоонозные инфекции ( туляремия, бруцеллез, сибирская язва).
Протозойные инвазии (амебиаз или амебная дизентерия, балантидиоз и лямблиоз).
Глистные инвазии (аскаридоз, анкилостомидоз, стронгилоидоз).
Грибковые заболевания, в частности возбудителей эпидермофитии.
Механизмы и факторы инфицирования воды различны. Большую опасность в эпидемиологическом отношении представляют неочищенные или недостаточно очищенные фекально-хозяйственные сточные воды, стоки инфекционных больниц, ветеринарных лечебниц, предприятий, связанных с разделкой туш и обработкой шкур животных. Попадание возбудителей инфекционных болезней в открытые водоемы возможно также с ливневыми водами и выбросами сточных вод пассажирских и промысловых судов. Большую опасность представляет питьевая вода в случае, если она не подвергается очистке и обеззараживанию перед употреблением.
Значение минерального (солевого) состава воды.
Минеральный состав природных вод может способствовать развитию неинфекционных заболеваний. Употребление воды с несоответствующим нормативам солевым составом может быть причиной развития флюороза, нитратной метгемоглобинемии, нарушений водно-солевого обмена, диспепсических расстройств и т.д.
Косвенное влияние состава и свойств природных вод проявляется в ограничении употребления воды, имеющей неблагоприятные органолептические свойства (запах, вкус, цветность, мутность). Вода, обладающая неприятным запахом и вкусом, вызывает нарушения водно-солевого режима, секреторной деятельности желудка, а также ограничение или отказ населения от использования такой воды в питьевых целях. Так соли железа придают воде чернильный привкус, соли тяжелых металлов — вяжущий привкус, хлориды — соленый, сульфаты и фосфаты — горький привкус. Поэтому их содержание в питьевой воде ограничивается по пределу вкусового ощущения. Вода с повышенной минерализацией отрицательно влияет на секрецию желудка, вызывает отеки, нарушает водно-солевой обмен, хуже утоляет жажду.
Солевой состав природных вод формируется в первую очередь в результате вымывания веществ из почвы и в связи с этим отражает химическую структуру почвы данной местности. Медь, йод, бром в значительной количестве могут поступать из атмосферы.
Однако довольно часто химические вещества, находящиеся в воде, имеют не природное происхождение, а поступают в водоемы с хозяйственно-фекальными или промышленными стоками.
Степень и характер минерализации воды в той или иной местности отличается известным постоянством и изменение химического состава воды, не связанное с естественными причинами (весенние паводки и др.) может рассматриваться как показатель загрязнения теми или иными отбросами. Количество минеральных солей, содержащихся в воде, выражают в миллиграммах на 1л или в отдельных случаях – в миллиграмм-эквивалентах на 1 литр.
Количественно величина солевого состава воды или степень минерализации воды определяется величиной сухого остатка.
Сухой остаток характеризует сумму всех химических соединений (минеральных и органических), растворенных в 1 л воды. Величина сухого остатка влияет на вкусовые качества воды. Величина сухого остатка для питьевой воды должна быть не более 1000 мг/л. Вода с большим содержанием солей имеет неприятный солоноватый или горьковатый привкус. Длительное использование для питья высокоминерализованных вод приводит к ряду изменений в организме. Так у населения, постоянно потребляющего солоноватые подземные воды, содержащие хлоридно-сульфатно-натриевые соли, отмечается снижение диуреза, задержка воды в тканях, отеки, нарушение водно-электролитного баланса и секреторной деятельности желудочно-кишечного тракта. Наиболее выраженные патологические изменения в организме проявляются при употреблении для питьевых целей морской воды, минерализация которой составляет от 10 г/л. Даже при кратковременном употреблении такой воды, нарушается кислотно-щелочное равновесие и повышается остаточный азот в крови, ухудшается сердечная деятельность. Все эти симптомы наблюдаются на фоне резкой жажды и утомляемости. В тяжелых случаях может наступить смерть.
Кроме того, более высокие величины сухого остатка, если они не оправдываются геологическими особенностями почвы, дают основание предполагать о загрязнении воды посторонними примесями.
Однако употребление излишне деминерализованной (мягкой), а тем более дистиллированной воды также неблагоприятно для организма. Такая вода имеет сниженные вкусовые свойства. Ее длительное использование для питья нарушает регуляцию водно-электролитного баланса, вызывает увеличение содержания электролитов в сыворотке крови и моче с их ускоренным выведением из организма, снижение осмотической резистентности эритроцитов, изменения в сердечно-сосудистой системе. Нижним пределом минерализации, при котором поддерживается гомеостаз организма, является сухой остаток в 100 мг/л, оптимальным уровнем минерализации является сухой остаток в 200-300 мг/л.
Есть еще один показатель, который интегрально характеризует содержание в воде минеральных компонентов. Это величина жесткости воды.
Жесткость воды зависит от содержания в ней солей щелочноземельных металлов - кальция и магния, главным образом в виде двууглекислых и отчасти сернокислых, хлористых, азотнокислых и азотисто-кислых соединений. Иногда она обусловливается также наличием солей закисного железа, марганца и алюминия.
Физиологическое значение солей жесткости невелико. Очень жесткая вода, если в ней содержится много сернокислого магния и присутствует сернокислый натрий или, реже калий, способна вызвать у человека, привыкшего к мягкой воде, послабляющее действие. Косвенное влияние жесткой воды на функции организма может казаться в худшем усвоении пищи, сварной в жесткой воде. Овощи и мясо развариваются в жесткой воде плохо, потому, что находящиеся в них белковые вещества образуют с щелочами нерастворимые соединения, препятствующие воде проникать внутрь вещества.
Большое значение имеет жесткость воды в санитарном и техническом отношении. Требуется гораздо больше мыла при мытье тела и стирке, так как образование пены не наступает до тех пор, пока не выпадут из воды нерастворимые известковые и магнезиальные соли.
Вода с высокой жесткостью непригодна для промышленных целей. Например, в текстильной промышленности образующиеся нерастворимые известковые мыла, осаждаясь в волокнах, сообщают тканям грубость и затрудняют окраску.
Наконец, жесткость воды иногда может служить качестве санитарного показателя: увеличение жесткости воды может зависеть от загрязнения воды, так как одной из причин увеличения жесткости воды является распад органических веществ. Жесткость воды может также увеличиваться вследствие попадания в источник щелочных сточных вод.
Различают три вида жесткости: общую, постоянную и устранимую (временную).
Общая жесткость - это жесткость сырой воды, обусловливаемая всеми соединениями кальция и магния (иногда железа и марганца), независимо от того, с какими анионами связаны вышеназванные катионы.
Постоянная жесткость – жесткость воды после одночасового кипячения, зависящая от присутствия в воде различных солей, не дающих осадка при кипячении. Главным образом это сульфаты и хлориды кальция и магния.
Устранимая (временная) жесткость – жесткость воды, устраняемая при кипячении, что объясняется разрушением бикарбонатов кальция Ca (HCO3)2 и в меньшей степени магния Mg(HCO3)2 , а иногда и железа Fe(HCO3)2 и превращения их в нерастворимые углекислые соли (монокарбонаты), которые оседают на стенках сосудов в виде накипи (CaCO3, MgCO3). Таким образом, устранимая жесткость есть часть общей жесткости, которую можно вычислить по разнице между общей и постоянной жесткостью.
Нормируется общая жесткость воды, но практический интерес представляет и устранимая жесткость, например при выборе дозы сернокислого алюминия при коагуляции воды.
Жесткость воды выражается в миллиграмм-эквивалентах на 1 литр воды или в условных градусах жесткости.
1 мг-экв соответствует 28 мг CaO(окиси кальция)
1° жесткости соответствует 10 мг CaO
Таким образом 1 мг-экв = 2,8
Хлориды. Хлористые соли встречаются практически во всех водоисточниках. Их содержание в воде зависит от характера почв и увеличивается с северо-запада на юго-восток. Хлориды влияют на вкус воды, придавая ей солоноватый привкус. Допускается содержание хлоридов до пределов вкусовой ощутимости, т.е. не более 350 мг/л
В некоторых случаях хлориды можно использовать как показатель загрязнения. Хлориды выводятся из организма человека через почки, поэтому хозяйственно-бытовые сточные воды всегда содержат много хлоридов. Но всегда нужно помнить, что хлориды могут использоваться в качестве показателей загрязнения только в сравнении с местными, региональными нормами. В том случае, когда содержание хлоридов в чистой воде данной местности не известно, решить вопрос о загрязнении воды только по одному этому показателю невозможно. К примеру, большие количества хлоридов могут быть в подземных водах в местах с солончаковой почвой и в этом случае они не указывают на загрязнение воды.
Сульфаты. При превышении обычного для данной местности содержания солей серной кислоты они могут служить признаком загрязнения воды органическими веществами. Сера является составной частью белков, которые при разложении и последующем окислении дают соли серной кислоты. Но главное значение сульфатов заключается том, что они портят вкус воды и вызывают у некоторых людей расстройство деятельности кишечника (послабляющее действие).
Фосфаты. В чистых водах соли фосфорной кислоты обычно не встречаются и их наличие говорит о сильном загрязнении воды разлагающимися органическими веществами, поступающими из почвы или с промышленными стоками.
Медь, свинец, цинк, ртуть и др. В питьевой воде не должны находиться ядовитые вещества. Отдельные элементы могут встречаться в ней как примеси, попадающие с промышленными стоками.
Йод. В природных водах содержание йода незначительно и составляет небольшую часть суточной потребности в нем человека (100-200 γ), которая покрывается в основном за счет пищи. Количество йода в воде рассматривается как своего рода индикатор его содержания во внешней среде. Если йода мало в воде, то его мало и в почве, и в растительных продуктах, произрастающих в данном районе и, наконец, в организме животных и человека. В связи с недостаточным поступлением йода в организм щитовидная железа вынуждена усиленно функционировать (йод входит в состав тироксина – гормона щитовидной железы), что ведет к ее гипертрофии и нарушению деятельности всего организма.
Среди профилактических мероприятий наибольшее распространение получило употребление йодированной поваренной



 , где
, где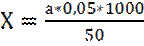 ,т.е. Х=а (мг-экв/л)
,т.е. Х=а (мг-экв/л) (мг),
(мг),


