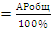ХИМИЯ
91 Закономерности электронного строения атомов элементов малых и больших периодов. Законы и правила в атомной системе.
92 Периодический закон Д.И. Менделеева. Периодичность изменения свойств химических элементов и их соединений.
93 Основные классы неорганических соединений, их номенклатура. Генетическая связь между основными классами соединений
94 Природа химической связи. Характеристика и типы ковалентной связи. Представление об ионной, водородной, металлической связи.
95 Теория и виды гибридизации. Пространственное строение молекул органических и неорганических веществ.
96 Первый закон термодинамики. Закон Гесса. Расчет тепловых эффектов химических реакций.
97 Второй закон термодинамики. Понятие об энтропии. Энергия Гиббса и направление химических реакций.
98 Химическая кинетика. Скорость химических реакций. Факторы, влияющие на скорость гомогенных и гетерогенных реакций.
99 Обратимые и необратимые химические реакции. Химическое равновесие и условия его смещения. Принцип Ле-Шателье.
100 Электролитическая диссоциация кислот, оснований, солей. Амфотерные электролиты.
101 Сильные и слабые электролиты. Степень и константа электролитической диссоциации. Закон разбавления Оствальда.
102 Теория сильных электролитов. Теория Дебая-Хюккеля. Активность и коэффициент активности.
103 Комплексные соединения, классификация и номенклатура, устойчивость комплексных ионов. Понятие о константах нестойкости и устойчивости. Получение и разрушение комплексных ионов.
104 Закономерности протекания окислительно-восстановительных реакций. Влияние различных факторов на протекание окислительно-восстановительных реакций.
105 Электролиз растворов и расплавов солей. Характеристика электродных процессов.
106 Способы количественного выражения состава растворов: массовая доля, мольная доля, молярность, нормальность, моляльность.
107 Коллигативные свойства растворов. Температура замерзания и кипения растворов. Первый и второй законы Рауля. Осмос и осмотическое давление.
108 Аммиак, строение, получение и свойства. Азотная кислота и ее соли. Особенности свойств. Химические основы производства азотной кислоты.
109 Общая характеристика элементов VI А группы периодической системы элементов. Кислород и его соединения. Получение и свойства.
110 Оксиды серы (IV) и (VI), серная кислота и ее соли. Особенности взаимодействия серной кислоты с металлами. Химические основы производства серной кислоты.
111 Общая характеристика элементов VА группы периодической системы элементов. Фосфор и его соединения.
112 Общая характеристика элементов VII А группы периодической системы элементов. Хлор и его соединения.
113 Положение металлов в периодической системе элементов Д.И. Менделеева. Физические и химические свойства металлов. Основные промышленные способы получения металлов.
114 Общая характеристика и свойства металлов IА и IIА групп периодической системы элементов.
115 Предельные углеводороды. Особенности строения, номенклатура и изомерия, химические свойства. Радикальный механизм реакций замещения у алканов.
116 Этиленовые углеводороды. Особенности строения, номенклатура, виды изомерии алкенов. Химические свойства и получение алкенов. Механизм реакций электрофильного присоединения. Качественные реакции на кратную связь.
117 Ацетиленовые углеводороды. Понятие о sp-гибридизации. Номенклатура и изомерия, химические свойства, качественные реакции на алкины.
118 Диеновые углеводороды. Классификация, свойства, получение. Особенности реакций присоединения у сопряженных диеновых углеводородов
119 Понятие о реакциях полимеризации, сополимеризации, поликонденсации. Получение высокомолекулярных соединений. Каучуки.
120 Ароматические углеводороды. Электронное строение, номенклатура, изомерия. Правила ориентации в бензольном ядре. Химические свойства, механизм реакций электрофильного замещения у аренов.
121 Спирты, классификация, номенклатура и изомерия. Химические свойства одноатомных спиртов.
122 Химические особенности многоатомных спиртов.
123 Фенолы, классификация, номенклатура, химические свойства. Получение фенола. Взаимное влияние атомов в молекуле фенола.
124 Карбонильные соединения, номенклатура и изомерия. Строение и химические свойства, качественные реакции на карбонильные соединения.
125 Карбоновые кислоты, классификация, номенклатура и изомерия. Химические свойства одноосновных предельных карбоновых кислот.
126 Оксикислоты: особенности химических свойств. Явление оптической изомерии. Понятие о рацематах.
127 Нейтральные жиры, классификация, структура, химические свойства, биологические функции. Получение жиров и их промышленная переработка.
128 Углеводы, классификация, биологическая роль. Моносахариды, химические свойства, особенности строения и изомерия.
129 Важнейшие природные гомополисахариды: целлюлоза, гликоген, крахмал. Особенности строения, свойства, биологическая роль, применение.
130 Алифатические и ароматические амины, классификация и номенклатура. Строение и химические свойства. Основный характер аминов. Получение анилина и его применение.
131 Аминокислоты: классификация, физико-химические свойства, растворимость, амфотерность, стереохимия, изоэлектрическое состояние. Важнейшие реакции по карбоксильной и аминогруппе.
132 Белки: общая характеристика, классификация и физико-химические свойства белков. Теория строения белков.
133 Структурная организация нуклеиновых кислот.
134 Характеристика процессов биосинтеза белка. Роль нуклеиновых кислот в биосинтезе белков.
135 Цикл трикарбоновых кислот как универсальный метаболический путь. Локализация, характеристика основных этапов, биологическая роль процесса.
Примеры типовых задач по химии
1) Над нагретой серой массой 12,8г пропустили избыток водорода и полученный газ растворили в избытке раствора NaОН, определите массу образовавшейся соли, если выход на первой стадии 85%, а на второй – 90%.
2) Смесь оксидов кальция и магния массой 2,08 г полностью растворили в азотной кислоте и получили 6,4 г смеси нитратов. Найдите массовую долю оксида магния в смеси.
3) Смесь гидридов натрия и калия массой 7,6 г растворяется в воде с выделением 5,6дм3 (н.у.) водорода. Определите массы гидридов в смеси и их массовые доли.
4) Смесь цинка и магния массой 2,3 г растворили в соляной кислоте, для чего потребовалось 10см3 кислоты с массовой долей HCL 0,3 (ρ = 1,0г/см3). Найдите массы металлов в смеси.
5) Имеется смесь Fe и FeО, при обработке которой разбавленной серной кислотой выделилось 112см3 (н.у.) газа. При взаимодействии такой же смеси при нагревании с избытком водорода масса смеси уменьшается на 0,048г. Найдите массовые доли веществ в исходной смеси.
6) К раствору серной кислоты прибавили NaOH и получили 3,6 г гидросульфата и 2,84 г сульфата натрия. Определите химические количества кислоты и щелочи, вступивших в реакцию.
7) На растворение 14,4 г смеси меди и ее оксида (II) затрачено 48,5г раствора с ω (HNO3) = 80%. Найдите массовые доли веществ в исходной смеси.
8) Смесь стружек Zn и Cu обработали избытком раствора КОН, выделился газ объемом 2,24дм3 (н.у.). Для полного хлорирования такого же образца металлов потребовался хлор объемом 8,96дм3 (н.у.). Рассчитайте массовую долю металлов в исходной смеси.
9) Определите массовые доли всех веществ в растворе, полученном при сливании 300 г раствора с ω (NaOH) = 5% и 200 г раствора с ω (H2SO4) = 9,8%. Какую окраску будет иметь лакмус в полученном растворе?
10) Некоторый газ при 250С и давлении 99,3 кПа занимает объем 152 мл. Какой объем займет газ при нормальных условиях? Определите химическое количество вещества и число молекул, содержащихся в данном объеме газа.
11) Имеется газовая смесь, массовые доли водорода и азота в которой составляют 0,35 и 6,65. Определите объемные доли газов в смеси и относительную плотность данной смеси по воздуху.
12) Определите плотность по водороду газовой смеси, состоящей из 15 л метана и 5 л пропана.
13) Оксид углерода IV находится в сосуде, объем которого = 20 л, при t = 220С и давлении 500 кПа. Определите массу данного объема газа.
14) Реакция при t 500С протекает за 3 минуты 20 секунд. Температурный коэффициент скорости реакции = 3. За сколько времени закончится эта реакция при 30 и 1000С?
15) Через 5 секунд после начала реакции 2 NO + О2 ↔ 2NO2 молярная концентрация NO снизилась на 0,2 моль/дм3. Определите среднюю скорость образования NO2 (моль/дм3 ∙ с).
16) Учитывая термохимическое уравнение:
2H2S (г) + 3О2 (г) = 2Н2О (г) + 2SO2 (г) + 857 кДж
Найдите: а) сколько теплоты выделится при сгорании 17г сероводорода;
б) какой объем О2 (дм3, н.у.) нужен для реакции, чтобы получить 600 кДж теплоты?
17) При взаимодействии 13 г Zn с S выделилось 40,2 кДж теплоты. Чему равен тепловой эффект реакции образования 1 моль сульфида Zn?
18) Тепловой эффект растворения аммоний нитрата химическим количеством 1 моль в воде равен – 26,4 кДж. Укажите тепловой эффект растворения (кДж) NH4NO3 в воде, если при этом образовался раствор, содержащий суммарно 1,505 ∙ 1023 ионов NH  и NO
и NO 
19) Считая диссоциацию Ва(ОН)2 полной, найдите химическое количество ионов ОН- в 1 дм3 раствора Ва(ОН)2 с ω = 1%; ρ = 1,026г/см3.
20) Найдите степень диссоциации СН3СООН, содержащей в некотором объеме 5 · 1019 ее молекул и 1,8 · 1018 ионов Н+ и СН3СОО-.
21) Найдите химическое количество ионов водорода в 1 дм3 раствора фтороводородной кислоты (ω = 0,1%; ρ = 1 г/см3) считая α = 2%. Рассчитайте значение рН данного раствора.
22) В растворе объемом 4 дм3 содержится H2SO4 массой 0,196 г. Считая, что H2SO4 полностью распадается на ионы, укажите рН раствора.
23) Массовые доли элементов (%) в гидроксиде железа равны: 62,2 (железо); 35,6 (кислород); 2,2 (водород). Какова формула гидроксида? Рассчитайте химическое количество данного гидроксида в образце массой 100 г.
24) При взаимодействии 6,2 г фосфора с кислородом получено 14,2 г его оксида. Найдите простейшую (эмпирическую) формулу оксида.
25) Соединение некоторого элемента имеет формулу Э3О4; массовая доля элемента в нем равна 72,4%. Установите элемент. Рассчитайте число структурных единиц (Э3О4), содержащихся в порции данного вещества массой 100 г.
26) При сжигании 10,0 г металла получено 18,9 г оксида металла (III). Установите металл и объем кислорода (дм3, н.у.) затраченный на сжигание.
27) Относительная плотность паров вещества по воздуху 1,52, а массовые доли элементов углерода и кислорода соответственно равен 0,2727 и 0,7273. Установите формулу вещества.
28) При сгорании 11,8 г вещества получено 17,6 г СО2, 0,5 моль Н2О и 2,24 дм3 (н.у.) N2. Относительная плотность паров вещества по N2 2,11. Установите молекулярную формулу вещества.
29) Какая масса магнетита с массовой долей Fe3O4 90% потребуется для получения 100г Fe, если потери в производстве составляют 3%.
30) Какую массу карбоната натрия, содержащую 10% примесей, надо взять для получения 28,56дм3 (н.у.) СО2 при выходе продукта 85%?
31) Какой объем H2S (дм3, н.у.) можно получить при действии избытка соляной кислоты на сульфид железа (II) массой 83,81 г, содержащий 5,5% примесей по массе, если выход реакции равен 96%?
32) На сжигание 0,1 моль углеводорода было затрачено 20,16дм3 О2 (н.у.), при этом получили 10,8 г Н2О. Определите массу и формулу углеводорода.
33) Смесь бутана и бутена-2, полученная при гидрировании 5,4 г бутадиена-1,3, обесцветила 80г бромной воды с ω(Br2) = 4%. Определите массовую долю бутана в смеси углеводородов.
34) При нагревании 100 г раствора бензойной кислоты и бензилового спирта в бензоле с серной кислотой получено 10,6 г сложного эфира, а при обработке 100г такой же смеси исходных веществ NаНСО3 выделяется 4,48дм3 (н.у.) газа. Найти массы кислоты и спирта в исходном растворе.
35) Крахмал массой 342 г подвергли гидролизу. Выход продукта реакции равен 80%. Полученную глюкозу подвергли спиртовому брожению, выход спирта составил 75%. В результате брожения образовался водный раствор спирта массой 368 г. Определите массовую долю этанола в полученном растворе.
36) Найдите массу раствора с массовой долей глюкозы 10%, при брожении которого выделилось столько же СО2 как и при полном сгорании 35см3 этанола (ρ = 0,8г/см3).
37) Какой объем уксусной эссенции с ω (СН3СООН) = 30% (ρ = 1,04г/см3) можно получить из 500 кг технического СаС2 (массовая доля примесей 4%), если выход кислоты равен 80%?
38) На нейтрализацию смеси муравьиной и уксусной кислот нужно 8см3 раствора КОН (ω = 40% и ρ = 1,4г/см3), а такая же масса смеси с избытком Ag2О дает 10,8 г осадка. Найдите массовые доли кислот в смеси.
39) На смесь этаналя и пропаналя подействовали избытком Ag2О/NH3 и получили 64,8 г осадка. При гидрировании такой же массы альдегидов получили 15,2 г смеси спиртов. Чему равна масса смеси альдегидов?
40) Имеется смесь этанола и фенола. К одной половине смеси добавили избыток натрия и получили 672см3 (н.у.) водорода, а к другой прилили избыток бромной воды и получили 6,62 г осадка. Определите массовые доли веществ в исходной смеси.
41) При взаимодействии алканола с избытком Na выделилось 11,2 дм3 (н.у.) Н2 и образовалось 82 г алкоголята натрия. Установите формулу спирта.
42) Бензол, полученный с выходом 80% при дегидрировании 16,8 г циклогексана, был подвергнут нитрованию нитрующей смесью. Какая масса нитробензола получена, если выход реакции нитрования 90%?
43) Какой объем ацетилена нужно взять для получения такого количества бензола, при нитровании которого образуется 153,9дм3 (ρ = 1,12г/см3) нитробензола, если выход нитробензола равен 80%?
44) Вычислите молярную концентрацию, молярную концентрацию эквивалента, (для условия полной нейтрализации) раствора серной кислоты, где ω (H2SО4) = 20% и ρ 1,14 г/мл.
45) Какой объем раствора серной кислоты с массовой долей H2SО4 30% (р = 1219 кг/м3) можно приготовить из 12 кг раствора серной кислоты с массовой долей H2SО4 60 %
46) Какой объем соляной кислоты с массовой долей НС1 38% (р =1,19 г/мл) нужно взять для приготовления 1л 2н раствора? Определите титр раствора.
47) Для определения содержания бария гидроксида анализируемый раствор перенесли в мерную колбу вместимостью 100 см и довели дистиллированной водой до метки. На титрование 5 см3 полученного раствора было затрачено 14,33 см3 раствора НС1 с молярной концентрацией 0,105 моль/л. Вычислите массу бария гидроксида в анализируемом растворе.
48) Сколько граммов Н3РО4 содержится в растворе, если на титрование его с фенолфталеином затрачено 25,50 мл 0,2000 н раствора NaOH?
49) Какую массу дигидрата щавелевой кислоты Н2С2O2 нужно взять, чтобы на ее титрование расходовалось 20 мл 0,1 М раствора NaOH? (М(Н2С2O4 · 2Н2O) =126 г/моль).
50) На титрование 20,00 мл раствора НС1 с титром, равным 0,001825 г/мл, израсходовано 23,04 мл раствора NaOH. Вычислите молярную концентрацию эквивалента и титр раствора NaOH.
51) На титрование 0,2860 г Na2CО3 · 10Н2О в присутствии метилового-оранжевого израсходовано 24,10 мл раствора НС1. Рассчитайте молярную концентрацию и титр раствора НС1.
52) Какая масса технического карбида кальция, содержащего 20% примесей по массе, нужна для получения из него двухстадийным синтезом 12,5 г винилхлорида, если выход на каждой стадии 80%?
53) При сжигании 0,1 моль углеводорода получено 5,4 г воды и 8,96 дм3 углекислого газа (н.у.). Изобразите возможные структуры углеводорода.
54) Смесь бензола и стирола прореагировала с бромной водой массой 320 г с массовой долей брома 4%. При сгорании такой же массы смеси углеводородов образовался CO2 объемом 35 дм3 (н.у.). Найдите массовую долю бензола в смеси.
55) При сгорании 0,005 моль альдегида получили CO2, который с 56 г раствора КОН (ω = 2%) образует кислую соль. Какова формула альдегида?
ХИМИЯ
Основные законы химии: стехиометрические законы, закон сохранения массы в химических реакциях, закон постоянства состава, закон эквивалентов. Газовые химические законы. Закон объемных отношений. Закон Авогадро. Объединенный газовый закон. Закон парциальных давлений.
Закон сохранения массы веществ
(М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи.
Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Закон постоянства состава
Впервые сформулировал Ж.Пруст (1808 г).
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
Массовая доля элемента w(Э) показывает, какую часть составляет масса данного элемента от всей массы вещества: где n - число атомов; Ar(Э) - относительная атомная масса элемента; Mr - относительная молекулярная масса вещества.
Закон объемных отношений
(Гей-Люссак, 1808 г.)
"Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа".
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
Закон Авогадро ди Кваренья
(1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул.
Закон справедлив только для газообразных веществ.
Следствия.
1. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
2. При нормальных условиях (0°C = 273°К, 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
Объединенный газовый закон - объединение трех независимых частных газовых законов: Гей-Люссака, Шарля, Бойля-Мариотта, уравнение, которое можно записать так:
P1V1 / T1 = P2V2 / T2
И наоборот, из объединенного газового закона
при P = const (P1 = P2) можно получить
V1 / T1 = V2 / T2
(закон Гей-Люссака);
при Т= const (T1 = T2):
P1V1 = P2V2
(закон Бойля-Мариотта);
при V = const
P1 / T1 = P2 / T2
(закон Шарля).
Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клайперона-Менделеева:
pV= (m / M) RT
где m - масса газа; M - молекулярная масса; p - давление; V - объем; T - абсолютная температура (°К); R - универсальная газовая постоянная (8,314 Дж/(моль • К) или 0,082 л атм/(моль • К)).
Для данной массы конкретного газа отношение m / M постоянно, поэтому из уравнения Клайперона-Менделеева получается объединенный газовый закон.
Закон парциальных давлений
На практике часто приходится встречаться со смесью различных газов (например, воздух), В этом случае необходимо применять вышерассмотренные газовые законы для каждого газа в отдельности и затем суммировать полученные величины. При этом пользуются также законом парциальных давлений: общее давление газовой смеси равно сумме парциальных давлений отдельных газов, составляющих данную смесь, то есть
| Робщ = Р1 + Р2 +.. + Рп
| (1.5)
|
Из формулировки закона следует, что парциальное давление представляет собой частичное давление, создаваемое отдельным газом. И действительно, парциальное давление - это такое давление, которое бы создавал данный газ, если бы он один занимал весь объем.
Величина парциального давления определяется несколькими способами, но наиболее часто встречающийся практически способ основан на использовании формулы
Р 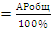
| |
где А - содержание данного газа в газовой смеси в объемных %.
Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях.
Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Рассмотрим реакцию взаимодействия гидроксида алюминия с серной кислотой:
2 Al(OH)3+ 3 H2SO4= Al2(SO4)3+ 6 H2O.
Из уравнения следует, что 2 моль Al(OH)3 взаимодействует с 3 моль H2SO4, при этом образуется 1 моль Al2(SO4)3 и 6 моль H2O. Таким образом, количество моль реагентов и продуктов (пропорциональное стехиометрическим коэффициентам в уравнении) обычно неодинаково.
Теперь рассмотрим число моль эквивалентов веществ, участвующих в данной реакции. 6 Моль эквивалентов Al(OH)3 взаимодействует с 6 моль эквивалентов H2SO4, при
этом образуется 6 моль эквивалентов Al2(SO4)3 и 6 Моль эквивалентов H2O. Таким образом, количество моль эквивалентов реагентов и продуктов всегда одинаково.
Электролиз расплава
При электролизе расплава хлорида меди (II) электродные процессы могут быть выражены полуреакциями:
на катоде (–): Сu2+ + 2e → Cu0 – катодное восстановление
на аноде (+): 2 Cl– – 2e → Cl2 – анодное окисление
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных полуреакций, и для хлорида меди она выразится уравнением
Cu2+ + 2 Cl– → Cu + Cl2
Электролиз растворов осложняется участием в электродных процессах ионов Н⁺ и ОН⁻. Кроме того, молекулы воды сами могут подвергаться электродному окислению или восстановлению.
Катодные процессы в водных растворах при электролизе не зависят от материала катода, а только от природы катиона.
Анодные процессы в водных растворах зависят от материала анода и природы аниона. При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться.Примером электролиза расплавов может служить электролиз хлорида магния, молекулы которого подвергаются диссоциации.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаетсяэлектродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы —катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательныеионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Этиленовые углеводороды. Особенности строения, номенклатура, виды изомерии алкенов. Химические свойства и получение алкенов. Механизм реакций электрофильного присоединения. Качественные реакции на кратную связь.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие однудвойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алкановзаменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Алкены, число атомов углерода в которых больше двух, (т.е. кроме этилена) имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная. Например, единственным изомером пропена является циклопропан (C3H6) по межклассовой изомерии. Начиная с бутена, существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.

При нормальных условиях алкены с C2H4 до C4H8 — газы; с пентена C5H10 до гексадецена C17H34 включительно — жидкости, а начиная с октадецена C18H36 — твёрдые вещества. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Основным промышленным методом получения алкенов является каталитический и высокотемпературный крекинг углеводородов нефти и природного газа. Для производства низших алкенов используют также реакцию дегидратации соответствующих спиртов.
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения.
Механизм реакций электрофильного присоединения по связи углерод-углерод
Электрофильное присоединение по кратной связи обычно, двухстадийный процесс AdE2 — реакция бимолекулярного электрофильного присоединения (англ. addition electrophilic bimolecular). На первом этапе происходит атака электрофила и образование π-комплекса, который затем расщепляется, а далее образовавшийся карбкатион подвергается нуклеофильной атаке:

Получение жиров
Растительные масла обычно получают способом прессования. При горячем способе прессования удается отжать максимальное количество жирного масла, поскольку белки отчасти свертываются и масло легче освобождается из тканей, не говоря уже о том, что при этом масло становится более подвижным. Горячее прессование сопровождается, однако, и большим переходом сопутствующих веществ, а также высокоплавких фракций масла (например, тристеарина). Отжим семян в холодных прессах, естественно, приводит к меньшему выходу масел, но полученные при этом масла содержат меньше сопутствующих веществ и значительно менее окрашены.
Жирные масла получают также путем экстрагирования семян летучими органическими растворителями (чаще низкокипящими фракциями бензина). Экстракция проводится на заводах в установках, работающих по принципу аппарата Сокслета, с последующей отгонкой экстрагента.
Животные жиры получают путем вытапливания жировой ткани, снятой с внутренних органов животных (почек, брыжейки, большого сальника). Перед этим собранный жир очищают от остатков других тканей.
Мальтоза

Мальтоза (от лат. maltum - солод) - C12H22O11 - дисахарид, состоящий из двух остатков глюкозы; содержится в больших количествах в проросших зёрнах (солоде) ячменя, ржи и других зерновых; обнаружен также в томатах, в пыльце и нектаре ряда растений. Мальтоза относится к восстанавливающим сахарам, восстанавливает фелингову жидкость, даёт гидразон и озазон и может быть окислена в одноосновную мальтобионовую кислоту, которая при гидролизе дает D-глюкозу и D-глюконовую кислоту. Мальтоза была синтезирована действием мальтазы (энзима дрожжей) на концентрированные растворы глюкозы. Для неё характерно явление мутаротации, сильно вращает плоскость поляризации влево[5]. Мальтоза менее сладка, чем например сахароза, однако, она более чем в 2 раза слащелактозы.
Целлобиоза
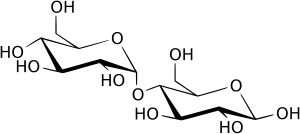
Целлобиоза 4-(β-глюкозидо)-глюкоза - дисахарид, состоящий из двух остатков глюкозы, соединённых β-гликозидной связью; основная структурная единица целлюлозы. Высшие животные не в состоянии усваивать целлюлозу, так как не обладают разлагающим её ферментом. Однако улитки, гусеницы и черви, содержащие ферменты целлобиазу и целлюлазу, способны расщеплять (и тем самым утилизовать) содержащие целлобиозу растительные остатки. Целлобиоза, как и лактоза, имеет 1→4 β-гликозидную связь и является восстанавливающим дисахаридом, но в отличие от лактозы при полном гидролизе даёт только D-глюкозу[6].
Невосстанавливающие (нередуцирующие) дисахариды [править | править вики-текст]
Невосстанавливающие дисахариды не имеют ОН-группы ни при одном аномерном центре, в результате чего, они не вступают в реакции с фелинговой жидкостью и реактивом Толленса.
Сахароза C12H22O11,, тростниковый сахар, в быту просто сахар, — дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозыи β-фруктозы.
Сахароза является весьма распространённым в природе дисахаридом. Она встречается во многих фруктах, плодах и ягодах. Особенно велико содержание сахарозы в сахарной свёкле и сахарном тростнике, которые и используются для промышленного производства пищевого сахара.
Сахароза имеет высокую растворимость.

Трегалóза или микóза — углевод из группы невосстанавливающих дисахаридов. В природной трегалозе 2 остатка D-глюкозы связаны α-1,1-гликозидной связью.
Представляет собой белое кристаллическое вещество, хорошо растворимое в воде, не имеет запаха, сладковатая на вкус (сладость трегалозы составляет примерно 45% от сладости сахарозы). По своему строению трегалоза - невосстанавливающий сахар т.е. не имеет полуацетального гидроксила[1]. Благодаря α(1→1)-связи, трегалоза в растворе имеет высокую температуру плавления - 203° С, устойчива к кислотному гидролизу при высоких температурах и в сильнокислой среде. Не реагирует с фелинговой жидкостью. При гидролизе образует только глюкозу. Фермент гидролизующий трегалозу называется трегалазой.
Классификация
По радикалу
Неполярные: аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан,
Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин
Полярные заряженные отрицательно при pH=7: аспартат, глутамат
Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин
По функциональным группам
Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
Оксимоноаминокарбоновые: серин, треонин
Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
Амиды моноаминодикарбоновых: аспарагин, глутамин
Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
Серосодержащие: цистеин, метионин
Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
Гетероциклические: триптофан, гистидин, пролин
Иминокислоты: пролин


ХИМИЯ
91 Закономерности электронного строения атомов элементов малых и больших периодов. Законы и правила в атомной системе.
92 Периодический закон Д.И. Менделеева. Периодичность изменения свойств химических элементов и их соединений.
93 Основные классы неорганических соединений, их номенклатура. Генетическая связь между основными классами соединений
94 Природа химической связи. Характеристика и типы ковалентной связи. Представление об ионной, водородной, металлической связи.
95 Теория и виды гибридизации. Пространственное строение молекул органических и неорганических веществ.
96 Первый закон термодинамики. Закон Гесса. Расчет тепловых эффектов химических реакций.
97 Второй закон термодинамики. Понятие об энтропии. Энергия Гиббса и направление химических реакций.
98 Химическая кинетика. Скорость химических реакций. Факторы, влияющие на скорость гомогенных и гетерогенных реакций.
99 Обратимые и необратимые химические реакции. Химическое равновесие и условия его смещения. Принцип Ле-Шателье.
100 Электролитическая диссоциация кислот, оснований, солей. Амфотерные электролиты.
101 Сильные и слабые электролиты. Степень и константа электролитической диссоциации. Закон разбавления Оствальда.
102 Теория сильных электролитов. Теория Дебая-Хюккеля. Активность и коэффициент активности.
103 Комплексные соединения, классификация и номенклатура, устойчивость комплексных ионов. Понятие о константах нестойкости и устойчивости. Получение и разрушение комплексных ионов.
104 Закономерности протекания окислительно-восстановительных реакций. Влияние различных факторов на протекание окислительно-восстановительных реакций.
105 Электролиз растворов и расплавов солей. Характеристика электродных процессов.
106 Способы количественного выражения состава растворов: массовая доля, мольная доля, молярность, нормальность, моляльность.
107 Коллигативные свойства растворов. Температура замерзания и кипения растворов. Первый и второй законы Рауля. Осмос и осмотическое давление.
108 Аммиак, строение, получение и свойства. Азотная кислота и ее соли. Особенности свойств. Химические основы производства азотной кислоты.
109 Общая характеристика элементов VI А группы периодической системы элементов. Кислород и его соединения. Получение и свойства.
110 Оксиды серы (IV) и (VI), серная кислота и ее соли. Особенности взаимодействия серной кислоты с металлами. Химические основы производства серной кислоты.
111 Общая характеристика элементов VА группы периодической системы элементов. Фосфор и его соединения.
112 Общая характеристика элементов VII А группы периодической системы элементов. Хлор и его соединения.
113 Положение металлов в периодической системе элементов Д.И. Менделеева. Физические и химические свойства металлов. Основные промышленные способы получения металлов.
114 Общая характеристика и свойства металлов IА и IIА групп периодической системы элементов.
115 Предельные углеводороды. Особенности строения, номенклатура и изомерия, химические свойства. Радикальный механизм реакций замещения у алканов.
116 Этиленовые углеводороды. Особенности строения, номенклатура, виды изомерии алкенов. Химические свойства и получение алкенов. Механизм реакций электрофильного присоединения. Качественные реакции на кратную связь.
117 Ацетиленовые углеводороды. Понятие о sp-гибридизации. Номенклатура и изомерия, химические свой



 и NO
и NO