

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Интересное:
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
С.А. Сергеева, В.Е. Рябинин
Практикум по химии

 |
| Митохондрии- «энергетические станции» клетки, отвечающие за кислородное дыхание |  
|  Эволюционное прошлое митохондрий, их бактериальное происхождение породило неожиданный побочный эффект, весьма неприятный для людей, Эволюционное прошлое митохондрий, их бактериальное происхождение породило неожиданный побочный эффект, весьма неприятный для людей,
|
| т.к. разрушенные митохондрии, сходные по своей структуре с компонентами бактериальных клеток, иммунной системой распознается как инфекция. | ||

Учебное пособие
предназначено для самостоятельной аудиторной и
внеаудиторной работы студентов, обучающихся
по специальности 060105.65 – Стоматология
Челябинск 2012
УДК
ББК
| Рецензенты: | В. В. Авдин, заведующей кафедрой экологии и природопользования, декан химического факультета ФГБОУ ВПО Южно-Уральского государственного университета, директор НОЦ "Нанотехнологии", профессор, д.х.н. | |
| ?? | ||
| Авторы: | С.А. Сергеева, ст. преподаватель кафедры химии ГБОУ ВПО ЧелГМА Минздравсоцразвития России, к.б.н. В.Е. Рябинин, профессор кафедры химии ГБОУ ВПО ЧелГМА Минздравсоцразвития России, д.б.н. | |
|
Представлены практические задания по разделу биофизической химии: газы и жидкости, первый и второй законы термодинамики, термохимия, химические равновесия, химическая кинетика и катализ. Пособие содержит ситуационные задачи с образцами их решения, имеет большое число вопросов и задач, а также тесты для самоконтроля. В пособии подробно описаны методики выполнения лабораторных работ, а также физико-химические принципы проведения эксперимента и обработки результатов измерений, что повышает профилизацию предмета. В конце пособия приведены справочные данные о свойствах важнейших неорганических и органических соединений.
|
|
Пособие составлено с учетом требований Федерального Государственного образовательного стандарта высшего профессионального образования по специальности 060201– Стоматология, утвержденного приказом Минобрнауки РФ № 1118 от 8 ноября 2010 года.
Учебное пособие утверждено на заседании Ученого совета ГБОУ ВПО ЧелГМА Минздравсоцразвития России от ….12 протокол №…..
Учебное пособие предназначено для студентов стоматологического факультета.
Содержимое ресурса охраняется законом об авторском праве. Несанкционированное копирование и использование данного продукта без ссылки на издание запрещается.
Сергеева С.А., Рябинин В.Е., 2012
Изд-во «Челябинская государственная
медицинская академия, 2012
Оглавление
| Введение ……………………………………………………………………. Раздел 1. Тепловые эффекты химических реакций. Термодинамические характеристики химических и биохимических процессов………………….. 1.1.Ситуационные задачи с алгоритмами их решений, эталонами ответов и с комментариями…………………………………………………………… 1.2.Ситуационные задачи для закрепления материала……………………… 1.3.Контрольные вопросы …………………………………………………….. 1.4.Лабораторная работа. Определение стандартной теплоты (энтальпии) реакции нейтрализации ……………………………………... 1.5.Тесты текущего уровня…………………………………………………….. Раздел 2. Кинетика химических и биохимических реакций. Химическое равновесие………………………………………………………………………. 2.1.Ситуационные задачи с алгоритмами их решений, эталонами ответов и с комментариями…………………………………………………………… 2.2.Ситуационные задачи для закрепления материала ……………………... 2.3..Контрольные вопросы ……………………………………………………. 2.4.Лабораторная работа. Зависимость скорости химической реакции от концентрации……………………………………………………………….. 2.5.Тесты текущего уровня…………………………………………………….. Приложения ……………………………………………………………… Список литературы ……..………………………….………………... | 5 6 7 10 12 12 14 18 19 22 24 25 26 29 35 |
Введение
|
|
Как невозможно научиться читать и писать, не зная алфавита, так и трудно себе представить современного специалиста в области естественных наук без знаний основополагающих законов материального мира. Так, в частности, изучение биохимических основ различных метаболических процессов невозможно без усвоения определенных знаний классической термодинамики, предсказательная ценность которой возрастает с увеличением объема изучаемой совокупности метаболитов. Именно поэтому в учебном пособии дается подробная информация о термодинамических принципах на примерах химических и биохимических процессов, рассматриваются варианты решения задач биомедицинского характера. Приобретение навыков в решении типичных задач значительно облегчает усвоение материала и помогает проводить анализ экспериментальных данных.
Определение состояния энергетического обмена в открытых системах представляет собой достаточно сложную задачу, тем не менее, в настоящее время сформулированы общие принципы применения термодинамики к неравновесным открытым системам в стационарном состоянии. Главные принципы биоэнергетики позволяют объяснить, почему протекают одни реакции и не осуществляются другие. Как известно, многие метаболические процессы регулируются энергетическим статусом клетки, ее энергетическим зарядом и потенциалом фосфорилирования. Поэтому стратегия метаболизма заключается в генерировании АТФ, восстановительной способности (НАДФН и НАДН) и различных предшественников для биосинтетических процессов.
Поскольку живые организмы получают энергию в результате окислительно-восстановительных реакций, то особое значение приобретает рассмотрение и изучение количественных отношений, связывающих эти реакции и изменения энергии (константа равновесия, свободная энергия реакции и др.). Химические реакции можно исследовать либо путем анализа поведения участвующих в них молекул, т.е. методами химической кинетики, либо путем рассмотрения процесса переноса энергии, который сопровождает реакцию, т.е. методами химической термодинамики. В учебном пособии дается не только информация о кинетике химических и биохимических реакций, но и предлагается осуществить соответствующие лабораторные работы. Определение скоростей или исследование кинетики химических и ферментативных реакций является мощным методом изучения механизмов этих процессов и получения важной информации, как в теоретическом, так и в практическом плане.
|
|
Овладение основами химической термодинамики и кинетики является необходимой предпосылкой для успешного изучения химических основ жизнедеятельности. Пособие поможет студентам глубже усвоить основополагающие разделы химии и будет полезным при изучении биохимии и фармакологии.

Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть (лабораторная работа).
3. Контроль усвоения темы (тесты текущего уровня).
Практическая часть
1.1.Ситуационные задачи (№№ с 1 по 7) с алгоритмами их решений, эталонами ответов и с комментариями.
Экспериментальная часть
Реакции нейтрализации
Принцип метода. Теплота, выделяемая или поглощаемая в химической реакции, измеряется с помощью калориметра. В калориметрах наиболее распространенного типа реакция протекает в камере, которая помещена в термоизолированный сосуд. Выделение теплоты изучается при реакции нейтрализации по повышению температуры раствора.
В данной работе требуемая точность эксперимента позволяет учитывать только теплоту, пошедшую на разогрев раствора и калориметрического стакана; теплотой, пошедший на разогрев других частей калориметра, можно пренебречь
Энтальпия реакции нейтрализации, протекающей между сильной кислотой и сильным основанием, практически не зависит от их природы, так как реально в растворах протекает одна и та же реакция: В качестве примера рассмотрим реакцию нейтрализации сильной кислоты  раствором сильного основания
раствором сильного основания  . Представим ее уравнением реакции гидратированных ионов:
. Представим ее уравнением реакции гидратированных ионов:
|
|
 ;
; 
После сокращения ионов натрия и хлора может быть представлена в виде краткого ионного уравнения, составляющего суть процесса:
 ;
;  .
.
При температуре 298 К для 1 моль – эквивалентна кислоты или основания  . Отсюда
. Отсюда  кДж/моль, поэтому
кДж/моль, поэтому  .
.
В случае реакции нейтрализации слабых кислот и слабых оснований такого постоянство не наблюдается, так как часть теплоты расходуется на ионизации слабой кислоты и слабого основания.
Таблица 1.1
Образец теста
1. Система, которая не может обмениваться веществом с окружающей средой, но может обмениваться с ней энергией и работой называется _____ системой.
1) изолированной
2) закрытой
3) равновесной
4) открытой
2. Окружающая среда, как и система, обладает соответствующими свойствами, т.е. параметрами. Из внешних параметров обычно учитывают только _____.
1) давление и температуру
2) плотность и концентрацию
3) концентрацию и давление
4) химический потенциал и давление
3.  , применяемая в медицинской практике в качестве антисептика, а также антидота при отравлении марганцовокислым калием, неустойчивое соединение, медленно разлагающееся под действием света. В этой связи термодинамической функцией, которая служит критерием данного процесса при постоянной температуре и объеме является _____.
, применяемая в медицинской практике в качестве антисептика, а также антидота при отравлении марганцовокислым калием, неустойчивое соединение, медленно разлагающееся под действием света. В этой связи термодинамической функцией, которая служит критерием данного процесса при постоянной температуре и объеме является _____.
1) энтальпия
2) энергия Гиббса
3) энергия Гельмгольца
4) внутренняя энергия
4. Внутренней энергией системы называется ______.
1) кинетическая энергия движения молекул
2) суммарный запас всех видов энергии
3) потенциальная энергия системы
4) энергия притяжения электронов к ядру
5. Если в ходе процесса при постоянном давлении системой совершается только работа расширения, то для внутренней энергии справедливо выражение _____.
1) 
2) 
3) 
4) 
6. Химическая реакция обязательно сопровождается выделением или поглощением энергии, поскольку _____.
1) для ее протекания необходима энергия, равная энергии активации
2) её протекание требует столкновения реагирующих частиц
3) её протекание заключается в разрыве одних, и образовании других химических связей
4) при её протекании количество атомов до и после реакции остается постоянным
7. Энергия, освобождающаяся при окислении питательных веществ в процессе _____ не используется.
1) синтеза АТФ
2) теплопродукции
3) гидролиза концевой фосфоангидридной связи АТФ
4) сокращения мышц
8. В молекуле АТФ макроэргической связью является- _____.
1) гликозидная
2) фосфоэфирная
|
|
3) фосфоангидридная
4) водордная
9. На синтез одной молекулы глюкозы в реакции темновой фазы фотосинтеза затрачено АТФ ______.
1) 3
2) 6
3) 18
4) 12
10. В ходе циклического фотофосфорилирования происходит _____.
1) восстановление НАДФН
2) восстановление НАДН
3) синтез АТФ
4) фотоокисление воды
11. Конечными продуктами обмена веществ являются: _____.
1) мочевина,  ,
, 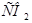
2) пируват, мочевина, АТФ
3) ацетил-КоА,  , пируват
, пируват
4) 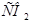 ,
,  , ацетил-КоА
, ацетил-КоА
12. Часть энергии системы, которую можно использовать для совершения работы при постоянной температуре и давлении, называется _____.
1) энтальпией
2) связанной энергией
3) свободной энергией
4) энтропией
13. Для замыкания гликозидной связи при синтезе сахарозы необходимо свободной энергии _____ кДж.
1) 5-10
2) 10-15
3) 20-30
4) 45-50
14. Все биохимические процессы в организме человека протекают при постоянном давлении и температуры, тип такого процесса называется _____.
1) изотермическим
2) изохорным
3) изобарно- изотермическим
4) адиабатическим
15. В реальных системах термодинамический процесс может сопровождаться как увеличением, так и уменьшением энтропии, поэтому данная характеристика уменьшается, как правило, при _____.
1) плавлении
2) испарении
3) полимеризации
4) диссоциации
16. Первый закон термодинамики является отображением всеобщего принципа сохранения и превращения энергии, поэтому математическое выражение этого закона имеет вид: _____.
1) 
2) 
3) 
4) 
17. Максимальная калорийность пищевых продуктов вычисляется на основании методов термохимии путем определения теплоты сгорания продуктов с помощью прибора - _____.
1) осмометра
2) вискозиметра
3) калориметрической бомбы
4) калориметра
18. Закон Гесса позволяет рассчитывать тепловые эффекты реакций (процесс образования продуктов), протекающих в животных и растительных организмах, поэтому данным условиям удовлетворяет уравнение: _____.
1) 
2) 
3) 
4) 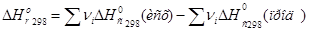
19. Для следующих нижеуказанных систем –______ применим второй закон термодинамики, который отражает факторы, определяющие направление и глубину протекания химических реакций.
1) изолированных, гетерогенных
2) закрытых, гомогенных
3) открытых, гетерогенных
4) закрытых гетерогенных
20. Необратимые процессы старения организма связаны с изменением энтропии, поэтому тип данной энергии в биологии расценивают, как _____.
1) связанный
2) внутренний
3) полной энергией системы
4) рассеянной
21. Изменение свободной энергии Гиббса /  / – это максимальная работа, которую организм выполняет за определенное время, для расчета который справедливо выражение _____.
/ – это максимальная работа, которую организм выполняет за определенное время, для расчета который справедливо выражение _____.
1) 
2) 
3) 
4) 
22. В биоэнергетике при изучении биохимических реакций принято пользоваться значениями  при рН = 7. При этом процессы дыхания и усвоения пищи, протекающие при
при рН = 7. При этом процессы дыхания и усвоения пищи, протекающие при  в системе, называются ______.
в системе, называются ______.
1) эндэргоническими
2 эндотермическими
3) экзэргоническими
4) гомогенными
4. Вопросы по теме для самостоятельного изучения их студентами.
1. Термодинамика живого организма.
5. Практические навыки, которыми должен овладеть студент по теме занятия. Студент должен владеть навыками:
вычисления различные термодинамические и термохимические расчеты, а также константы химического равновесия для прогнозирования и интерпретации физико-химических процессов, в том числе умения использовать эти знания применительно к конкретным системам, встречающихся в биологических объектах.
- умения работать с учебной, научной и справочной литературой, а также с сетью Интернет для постоянного усовершенствования своих знаний, с целью анализировать сложившуюся ситуацию и принимать решения в пределах своей профессиональной компетенции и полномочий.

Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть (лабораторная работа).
3. Контроль усвоения темы (тесты текущего уровня).
Практическая часть
1.1.Ситуационные задачи (№№ с 1 по 7) с алгоритмами их решений, эталонами ответов и с комментариями.
Экспериментальная часть
Лабораторная работа. Зависимость скорости химической реакции от концентрации
Принцип метода. Метод основан на определении времени 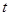 образования опалесценции, обусловленной образованием серы /
образования опалесценции, обусловленной образованием серы /  / в ходе разложения динатрий тиосульфата серной кислотой. Время
/ в ходе разложения динатрий тиосульфата серной кислотой. Время  от начала реакции (началом реакции считается момент сливания растворов) до заметного помутнения раствора зависит от скорости реакции
от начала реакции (началом реакции считается момент сливания растворов) до заметного помутнения раствора зависит от скорости реакции 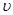 . Это дает возможность судить об относительной скорости реакции: чем больше скорость, тем меньше время.
. Это дает возможность судить об относительной скорости реакции: чем больше скорость, тем меньше время.
Процесс разложения многостадийный:
 (1)
(1)
 (2)
(2)
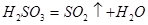 (3)
(3)
Скорость второй реакции наименьшая, является предметом изучения, поэтому она и определяет скорость разложения 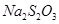 . Образующаяся в результате окислительно-восстановительного процесса сера вызывает помутнение раствора. Однако помутнение становится заметным после того, как концентрация серы достигнет определенной величины. Следовательно, чем выше концентрация веществ в смеси, тем быстрее между ними идет реакция. Другими словами, скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в степенях, равных стехиометрическим коэффициентам – закон действующих масс.
. Образующаяся в результате окислительно-восстановительного процесса сера вызывает помутнение раствора. Однако помутнение становится заметным после того, как концентрация серы достигнет определенной величины. Следовательно, чем выше концентрация веществ в смеси, тем быстрее между ними идет реакция. Другими словами, скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ в степенях, равных стехиометрическим коэффициентам – закон действующих масс.
В зависимости от значения порядка реакции  можно выделить 4-е основные зависимости скорости реакции от концентрации, графики которых показаны на рисунке 2.1.
можно выделить 4-е основные зависимости скорости реакции от концентрации, графики которых показаны на рисунке 2.1.

| Рис. 2.1. Зависимость скорости реакции от концентрации для химических реакций разного порядка: 1- 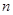 = 0; 2 - 0 < = 0; 2 - 0 < 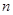 < 1;
3– < 1;
3–  =1; 3– =1; 3–  >1. >1.
|
Цель работы. Установить зависимость скорости реакции разложения динатрия тиосульфата / 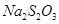 /. Определить порядок данной реакции.
/. Определить порядок данной реакции.
Приборы и оборудование: секундомер, бюретки вместимостью 25 мл, стаканы вместимостью 50 мл, мензурки.
Реактивы: серная кислота и динатрий тиосульфата с концентрацией 0,15 моль/л; вода дистиллированная.
Ход работы:
1. В 8 стаканов (4 пары) из бюреток (* лучше пипеткой) налейте объемы 0,15 М раствора  и дистилированной воды, приведенные в таблице №3.1.
и дистилированной воды, приведенные в таблице №3.1.
2. В первый стакан прилейте 15 мл 0,15 М раствора H2SO4, одновременно включите секундомер. Определите время от момента добавления кислоты до появления в растворе слабой опалесценции. Опыт повторите 2 раза.
3. Проведите аналогичные опыты с 2, 3 и 4- ми стаканами.
4. Данные и результаты эксперимента внесите в таблицу №2.1.
Таблица 2.1
Зависимость скорости разложения  от ее концентрации /
от ее концентрации /  /
/
| № опыта | Объем, мл | Общий объем, мл |
моль/л
| Промежуток времени от начала отсчета до появления мути, сек. | 
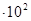 , ,

| ||||
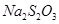
| 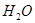
| 
| 
| 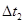
| 
| ||||
| 1. | 15 | 0 | 15
| ||||||
| 2. | 10 | 5 | |||||||
| 3. | 5 | 10 | |||||||
| 4. | 3 | 12 | |||||||
5. Обработка результатов. Выполните следующие нижеуказанные расчеты:
а) Для всех проведенных опытов (т.е. 1, 2, 3 и 4-й), пользуясь полученными данными, определите молярную концентрацию тиосерной кислоты  по формуле:
по формуле:
1)  .
.
б) Вычислите для всех проведенных опытов (т.е. 1, 2, 3 и 4-й)  по формуле:
по формуле:
1)  .
.
в) Рассчитайте скорость химической реакции для всех проведенных опытов (т.е. 1, 2, 3 и 4-й) по формуле:
1) 
 .
.
6. Выводы. 1) Постройте график зависимости скорости  реакции (ось ординат) от концентрации
реакции (ось ординат) от концентрации 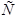 (ось абсцисс) реагирующих веществ. Согласно закону действия масс зависимость скорости реакции от концентрации должна выражаться прямой линией, проходящей через начало координат. 2) Сделайте вывод о зависимости скорости реакции от концентрации и определите порядок реакции.
(ось абсцисс) реагирующих веществ. Согласно закону действия масс зависимость скорости реакции от концентрации должна выражаться прямой линией, проходящей через начало координат. 2) Сделайте вывод о зависимости скорости реакции от концентрации и определите порядок реакции.
3. Контроль усвоения темы ( тесты для самоконтроля уровня текущих знаний).
Образец теста
1. «При увеличении температуры на 10 градусов скорость большинства химических реакций увеличивается в 2-4 раза» – это формулировка _____.
1) закона действующих масс
2) закон Генри
3) правила Вант-Гоффа
4) закона Гесса
2. Отношение произведения равновесных активностей продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к такому же произведению активностей исходных веществ при данной температуре есть величина постоянная, называемая _____.
1) константой химического равновесия
2) степенью диссоциации
3) свободной энергией Гиббса
4) константой скорости реакции
3. Если температурный коэффициент скорости равен 3, то при увеличении температуры от 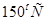 до
до 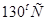 скорость химической реакции _____ раз.
скорость химической реакции _____ раз.
1) увеличится в 27 раз
2) уменьшится в 27 раз
3) увеличится в 81 раз
4)уменьшится в 81 раз
4. Количественное влияние температуры на скорость химической реакции выражается уравнением _____.
1) Вант-Гоффа
2) Аррениуса
3) Фарадея
4) Рауля
5. Реакция окисления этанола в организме человека идет по уравнению:  . При повышении концентрации исходных веществ в 5 раз скорость данной реакции _____раз.
. При повышении концентрации исходных веществ в 5 раз скорость данной реакции _____раз.
1) уменьшится в 25 раз
2) увеличится в 25 раз
3) уменьшится в 5 раз
4) увеличится в 5 раз
6. В организме человека тростниковый сахар (сахароза) под влиянием ферментов превращается в глюкозу и фруктозу. Если увеличить температуру на  при
при  =3, то скорость этой реакции _____ раз (а).
=3, то скорость этой реакции _____ раз (а).
1) уменьшится в 3 раз
2) увеличится в 9 раз
3) уменьшится в 9 раз
4) увеличится в 27 раз
7. Величина  (константа равновесия) зависит от _____ и рекомендуют ёё использовать для характеристики смещения равновесия биохимических процессов.
(константа равновесия) зависит от _____ и рекомендуют ёё использовать для характеристики смещения равновесия биохимических процессов.
1) концентрации реагирующих веществ
2) катализатора
3) давления
4) природы реагирующих веществ и температуры
8. Реакция окисления глюкозы в организме человека протекает по уравнению:  . Кинетическое уравнение скорости этой реакции имеет вид: _____.
. Кинетическое уравнение скорости этой реакции имеет вид: _____.
1) 
2) 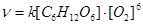
3) 
4) 
9. В растениях в процессе фотосинтеза с участием природного катализатора пигмента (хлорофилла) за счет солнечной энергии образуется глюкоза по схеме:  , Кинетическое уравнение скорости этой реакции имеет вид: _____.
, Кинетическое уравнение скорости этой реакции имеет вид: _____.
1) 
2) 
3) 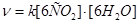
4) 
10. Порядок реакции для указанной реакции: 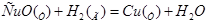 имеет вид: _____.
имеет вид: _____.
1) 0
2) 1
3) 2
4) 3
11. При повышении давления в 4 раза скорость химической реакции:  увеличивается в _____ раз (а).
увеличивается в _____ раз (а).
1) 64
2) 124
3) 924
4) 1024
12. Бикарбонат натрия, применяющийся в медицине при отравлении циклическими антидепрессантами, подвергается гидролизу по реакции:  . Уравнение константы равновесия этой реакции имеет вид: _____.
. Уравнение константы равновесия этой реакции имеет вид: _____.
1) 
2) 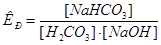
3) 
4) 
13. Температурный оптимум действия ферментов в живом организме в градусах составляет_____  .
.
1) 35-40
2) 65-70
3) 15-20
4) 0-10
4. Вопросы по теме для самостоятельного изучения их студентами.
1. Современные проблемы химической кинетики и фармакокинетики.
5. Практические навыки, которыми должен овладеть студент по теме занятия. Студент должен владеть навыками:
- вычисления различных кинетических расчетов, а также константы химического равновесия для прогнозирования и интерпретации физико-химических процессов, в том числе умения использовать эти знания применительно к конкретным системам, встречающиеся в биологических объектах для управления биохимическими процессами, а также для моделирования ряда реакций, протекающих с участием ферментов
ž умения работать с учебной, научной и справочной литературой, а также с сетью Интернет для постоянного усовершенствования своих знаний, с целью анализировать сложившуюся ситуацию и принимать решения в пределах своей профессиональной компетенции и полномочий.
Приложения А
Приложение 1
Термодинамические свойства некоторых неорганических соединений при 298 К


 .
.
| Символ | Вещество | 
| 
| 
|
|
| 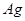 (т) (т)
| 0 | 42,5 | 0 |
 (водн) (водн)
| 106 | 73 | 77 | |
 (т) (т)
| -127 | 96,1 | -109,7 | |
 (т) (т)
| -100 | 107 | -97 | |
 (т) (т)
| -123 | 141 | -32,2 | |
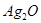 (т) (т)
| -30,6 | 122 | -10,8 | |
|
|  (т) (т)
| 0 | 28,3 | 0 |
 (водн) (водн)
| -525 | -313 | -481 | |
 корунд корунд
| -1670 | 51 | -1576 | |
 (т) (т)
| -2568 | 140 | -2292 | |
|
| 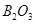 (т) (т)
| -1264 | 54 | -1184 |
 (t) (t)
| -1089 | 89,6 | -963 | |
 (водн) (водн)
| -1068 | 160 | -963 | |
|
| 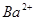 (волн) (волн)
| -538 | 12,6 | -561 |
 (т) (т)
| -860 | 126 | -811 | |
 (т) (т)
| -1462 | 203 | -1296 | |
 (т) (т)
| -554 | 70 | -525 | |
 (т) (т)
| -1465 | 132 | -1353 | |
|
|  (ж) (ж)
| 0 | 152 | 0 |
 (г) (г)
| 30,7 | 245 | 3,1 | |
 (г) (г)
| -36,4 | 199 | -53,5 | |
|
|  графит графит
| 0 | 57 | 0 |
 алмаз алмаз
| 1,9 | 24 | 2,9 | |
 (г) (г)
| -111 | 198 | -137 | |
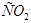 (г) (г)
| -393,5 | 214 | -394,4 | |
 (водн) (водн)
| -413 | 121 | -386 | |
 (водн) (водн)
| -700 | 187 | -623 | |
 (водн) (водн)
| -691 | 95 | -587 | |
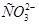 (водн) (водн)
| -676 | -53 | -528 | |
|
|  (водн) (водн)
| -543 | -55 | -553 |
 (т) (т)
| -636 | 40 | -603 | |
 (т) (т)
| -987 | 76 | -897 | |
 (т) (т)
| -1432 | 107 | 1320 |
Продолжение приложение 1
|
|  (т) (т)
| -1762 | 194 | -1565 |
 (т) (т)
| -1220 | 69 | -1167 | |
 (т) (т)
| -795 | 114 | -750 | |
 (водн) (водн)
| -878 | 55 | -815 | |
 (т) (т)
| -2607 | |||
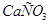 (т) (т)
| -1207 | 93 | -1129 | |
|
|  (г) (г)
| 0 | 223 | 0 |
 (г) (г)
| 76 | 266 | 94 | |
 (г) (г)
| -92,3 | 186,7 | -95,3 | |
 (водн) (водн)
| -167 | 55 | -131 | |
|
| 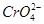 (водн) (водн)
| -863 | 38,5 | -706 |
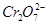 (водн) (водн)
| -1461 | 214 | -1257 | |
|
|  (т) (т)
| 0 | 33 | 0 |
 (водн) (водн)
| 64,4 | 99 | 65 | |
 (т) (т)
| -136 | 84,5 | -118 | |
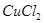 (т) (т)
| -206 | 108 | -162 | |
 (т) (т)
| -770 | 113 | -662 | |
 (т) (т)
| -2278 | 305 | 1880 | |
|
|  (водн) (водн)
| -329 | -9,6 | -276 |
 (r) (r)
| -269 | 174 | -271 | |
|
|  (т) (т)
| 0 | 27,2 | 0 |
 (водн) (водн)
| -88 | -113 | -85 | |
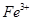 (водн) (водн)
| -48 | -293 | -11 | |
 (т) (т)
| -824 | |||
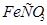 (т) (т)
| -753 | 96 | -680 | |
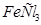 (т) (т)
| -405 | |||
|
|
|

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!