Для большинства имеется оптимальный рН, выше и ниже - активность снижается. Однако не всегда колоколообразная кривая, иногда может быть прямая. Форма зависимости активности данного фермента от рН зависит от:
1. рК’ ионизируемых групп активного центра фермента, участвующих в связывании субстрата,
2. рК’ функциональных групп субстрата, участвующих в связывании фермента с субстратом,
3. рК’ функциональных групп молекул фермента, ответственных за каталитический акт,
4. рК’ других групп фермента, состояние ионизации которых может определять специфическую каталитически активную конформацию молекулы.

Построение кривых активность-рН - проводят в условиях насыщения фермента.
Кривая может иметь особенно простую форму в случаях, когда фермент действует на электрически нейтральные субстраты или на субстраты, у которых заряженные группы не имеют существенной роли в каталитическом акте. Пример - папаин, инвертаза (гидролизует нейтральные молекулы сахарозы и сохраняет постоянную активность в интервале 3-7,5.
Значение оптимума активности не всегда совпадает со значением рН, характерным для нормального окружения фермента. Это позволяет предположить, что влияние рН на активность фермента может быть одним из факторов, ответственных за регулирование ферментативной активности.
Ингибирование ферментов
1. При изучении ингибирования получены многие основные факты о действии ферментов.
2. Ингибирование различных ферментов специфическими клеточными компонентами служит одним из факторов, регулирующих ход ферментативных реакций в интактной клетке.
Различают обратимое и необратимое ингибирование. Необратимое обычно сопровождается разрушением или модификацией одной или нескольких функциональных групп фермента. Обратимое подчиняется количественным законам УММ, в свою очередь подразделяется на конкурентное и неконкурентное. Конкурентное может быть ослаблено или устранено увеличением концентрации субстрата. На неконкурентное концентрация субстрата не влияет.
Конкурентное ингибирование
Классический пример - ингибирование сукцинатдегидрогеназы малонатом и другими дикарбоновыми кислотами. (Потренируемся по названиям ферментов). Относится к ферментам цикла трикарбоновых кислот, катализирует отщепление 2 водородов от двух метиленовых групп сукцината:
-OOC-CH2- CH2-COO- + акцептор → -OOC-CH=CH-COO- + восстановленный акцептор
сукцинат фумарат
-OOC-CH2 -COO- -OOC-COO- -OOC-CH2- CО-COO-
малонат оксалат оксалоацетат
Ингибируется малонатом (напоминает сукцинат тем, что при рН7,0 также имеет две ионизированные карбоксильные группы. Однако отщеплять водород от малоната не может.При конкурентном ингибировании степень ингибирования зависит не от абсолютной концентрации ингибитора, а от соотношения концентраций ингибитора и субстрата. При соотношении малоната и сукцината 50:1 скорость реакции снижется в 2 раза независимо от абсолютных концентраций. Ингибируют и другие дикарбоновые кислоты и даже пирофосфат - отрицательные группировки находятся примерно на одинаковом расстоянии. Отсюда вывод - каталитический центр содержит две определенным образом расположенные положительно заряженные группировки, способные притягивать два карбоксила. Можем сказать, что структура каталитического центра комплементарна по отношению к структуре субстрата.
Изучение многих примеров - вывод: конкурентный ингибитор реагирует с ферментом, попадая в тот же центр связывания, что и субстрат, в результате чего происходит обратимое образование комплекса EI.
k1
E+I ↔ EI
k2
Следуя формализму теории ММ, ингибиторную константу Ki можно определить как отношение констант скоростей Ki= k1/ k2 . Таким образом Ki представляет собой константу диссоциации фермент-ингибиторного комплекса Ki=[E][I]/[EI].
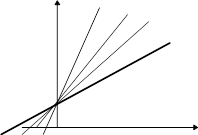
Легко распознается путем построения графиков Лайнуивера-Бэрка при разных концентрациях ингибитора. При истинном конкурентном - набор прямых, отличающихся углом наклона и пересекающих ось ординат в одной точке. То есть. присутствие конкурентного ингибитора не меняет значение Vmax - при любой концентрации ингибитора можно добавить столько субстрата, что активность фермента будет максимальной. В присутствии конкурентного ингибитора кажущаяся величина Km будет больше ее истинного значения на величину, равную разнице в длине отрезков отсекаемых по оси абсцисс. В случае неингибированной реакции тангенс равен Km/ Vmax. В присутствии ингибитора тангенс увеличивается в (1+[I]) / Ki раз. Из этого соотношения можно рассчитать величину Ki.
1/v 1/v
 1/[S]
1/[S] 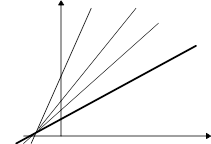 1/[S]
1/[S]




 1/[S]
1/[S]  1/[S]
1/[S]


