Кислоты и их свойства.
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
| HF
| Фтороводородная кислота (плавиковая)
|
| HCl
| Хлороводородная кислота (соляная)
|
| HBr
| Бромоводородная кислота
|
| HI
| Йодоводородная кислота
|
| H2S
| Сероводородная кислота
|
| H2SO3
| Сернистая кислота
|
| H2SO4
| Серная кислота
|
| HNO3
| Азотная кислота
|
| HNO2
| Азотистая кислота
|
| H3PO4
| Фосфорная (ортофосфорная) кислота
|
| H2CO3
| Угольная кислота
|
| H2SiO3
| Кремниевая кислота
|
Все кислоты обязательно содержат водород, который записывается в формуле на первом месте. Вся остальная часть формулы называется кислотным остатком.
Например, у НСl кислотным остатком является Сl-, а у Н3РО4 кислоьный остаток РО43-.
Классификация кислот.
1) По содержанию кислорода:
Кислоты
| Бескислородные
| Кислородсодержащие
|
| HF
| HNO3
|
| HCl
| H2SO4
|
| HBr
| H2SiO3
|
| HI
| H2CO3
|
| H2S
| H3PO4
|
По количеству водорода
Кислоты
| Одноосновные
| Двухоосновные
| Трехосновные
|
| HCl
| H2S
| H3PO4
|
| HNO3
| H2SO4
|
|
По растворимости в воде
Кислоты
| Нерастворимые
| Растворимые
|
| H2SiO3
| Все остальные
|
По стабильности
Кислоты
| Стабильные
| Нестабильные
|
| HCl
| H2SO3
|
| H2SO4
| H2SiO3
|
| H3PO4
| H2CO3
|
Физические свойства кислот.
1. Агрегатное состояние: жидкие или твердые (H3PO4, H2SiO3).
2. Кислые на вкус.

 3. Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и др.
3. Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и др.
Окрашенные растворы: H2CrO4 , HMnO4 .
H 2 SO 4 - серная кислота - бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из вождуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов.
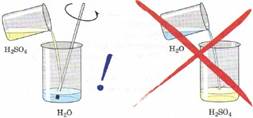
При смешивании серной кислоты с водой выделяется большое количество количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего.
Правило разбавления серной кислоты:
При растворении серной кислоты нужно вливать ее тонкой струей в воду и перемешивать.
Серная кислота обугливает древесину, кожу, ткани. Если в пробирку с H2SO4 опустить лучинку, то происходит химическая реакция - лучинка обугливается.
Угольная и сернистая кислоты - H 2 CO 3 и H 2 SO 3 - в свободном виде не существуют, т.к. они легко разлагаются на воду и соответствующий оксид:
H2CO3 → СО2 + Н2О
H2SO3 → SО2 + Н2О
Действие их на индикаторы.
Индикаторы - вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной (лакмус, метилоранж, фенолфталеин).
В кислотах:
| Лакмус
| Метилоранж
| Фенолфталеин
|
| красный
| красно-розовый
| бесцветный
|
Кремниевую кислоту распознать с помощью индикаторов распознать нельзя, т.к. она нерастворима в воде.
Диссоциация кислот.
1) HCl ↔ Н+ + Cl-
2)
| Н+ определяют кислую среду раствора.
| |
H
2SO
4 ↔
2 Н + + SO
42-
3) H3PO4 ↔ 3 Н + + PO43-
Химические свойства.
Химические свойства кислот.
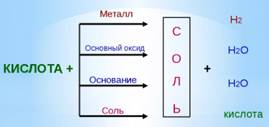
Кислоты взаимодействуют с металлами, оксидами металлов, основаниями и солями. Во всех случаях основным продуктом реакции будет соль.
Кислоты и их свойства.
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
| HF
| Фтороводородная кислота (плавиковая)
|
| HCl
| Хлороводородная кислота (соляная)
|
| HBr
| Бромоводородная кислота
|
| HI
| Йодоводородная кислота
|
| H2S
| Сероводородная кислота
|
| H2SO3
| Сернистая кислота
|
| H2SO4
| Серная кислота
|
| HNO3
| Азотная кислота
|
| HNO2
| Азотистая кислота
|
| H3PO4
| Фосфорная (ортофосфорная) кислота
|
| H2CO3
| Угольная кислота
|
| H2SiO3
| Кремниевая кислота
|
Все кислоты обязательно содержат водород, который записывается в формуле на первом месте. Вся остальная часть формулы называется кислотным остатком.
Например, у НСl кислотным остатком является Сl-, а у Н3РО4 кислоьный остаток РО43-.
Классификация кислот.
1) По содержанию кислорода:
Кислоты
| Бескислородные
| Кислородсодержащие
|
| HF
| HNO3
|
| HCl
| H2SO4
|
| HBr
| H2SiO3
|
| HI
| H2CO3
|
| H2S
| H3PO4
|
По количеству водорода
Кислоты
| Одноосновные
| Двухоосновные
| Трехосновные
|
| HCl
| H2S
| H3PO4
|
| HNO3
| H2SO4
|
|
По растворимости в воде
Кислоты
| Нерастворимые
| Растворимые
|
| H2SiO3
| Все остальные
|
По стабильности
Кислоты
| Стабильные
| Нестабильные
|
| HCl
| H2SO3
|
| H2SO4
| H2SiO3
|
| H3PO4
| H2CO3
|
Физические свойства кислот.
1. Агрегатное состояние: жидкие или твердые (H3PO4, H2SiO3).
2. Кислые на вкус.

 3. Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и др.
3. Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и др.
Окрашенные растворы: H2CrO4 , HMnO4 .
H 2 SO 4 - серная кислота - бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из вождуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов.
При смешивании серной кислоты с водой выделяется большое количество количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может закипеть и выбросить брызги серной кислоты на лицо и руки работающего.
Правило разбавления серной кислоты:
При растворении серной кислоты нужно вливать ее тонкой струей в воду и перемешивать.

Серная кислота обугливает древесину, кожу, ткани. Если в пробирку с H2SO4 опустить лучинку, то происходит химическая реакция - лучинка обугливается.
Угольная и сернистая кислоты - H 2 CO 3 и H 2 SO 3 - в свободном виде не существуют, т.к. они легко разлагаются на воду и соответствующий оксид:
H2CO3 → СО2 + Н2О
H2SO3 → SО2 + Н2О
Действие их на индикаторы.
Индикаторы - вещества, изменяющие окраску в зависимости от среды – кислотной или щелочной (лакмус, метилоранж, фенолфталеин).
В кислотах:
| Лакмус
| Метилоранж
| Фенолфталеин
|
| красный
| красно-розовый
| бесцветный
|




 3. Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и др.
3. Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и др.



