Билет №2
Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость. Молекулы с нечетным числом электронов.
Молекула - физ.устойчивая система,состоящая из определенного числа ядер и электронов.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Пример: Н2+Н=>Н3 (такой молекулы не может быть,такое св-во называется-насыщаемость)
В методе молекулярных орбиталей для описания распределения электронной плотности в молекуле используется представление о молекулярной орбитали (подобно атомной орбитали для атома). Молекулярные орбитали - волновые функции электрона в молекуле или другой многоатомной химической частице. Каждая молекулярная орбиталь (МО), как и атомная орбиталь (АО), может быть занята одним или двумя электронами. Состояние электрона в области связывания описывает связывающая молекулярная орбиталь, в области разрыхления - разрыхляющая молекулярная орбиталь. Распределение электронов по молекулярным орбиталям происходит по тем же правилам, что и распределение электронов по атомным орбиталям в изолированном атоме. Молекулярные орбитали образуются при определенных комбинациях атомных орбиталей. Их число, энергию и форму можно вывести исходя из числа, энергии и формы орбителей атомов, составляющих молекулу.
В общем случае, волновые функции, отвечающие молекулярным орбиталям в двухатомной молекуле, представляют как сумму и разность волновых функций атомных орбитале, умноженных на некоторые постоянные коэффициенты, учитывающие долю атомных орбиталей каждого атома в образовании молекулярных орбиталей (они зависят от электроотрицательности атомов):
φ(АВ) = с1ψ(А) ± с2ψ(В).
У большинства известных молекул в своб. состоянии основное состояние является синглетным. Молекулы с нечетным числом электронов, к числу к-рых относится, напр., NO, имеют обычно дублетное основное состояние. Среди молекул, имеющих в качестве основного триплетное состояние, прежде всего выделяют мол. кислород О2.
Билет№4
Роль молекул растворителя в процессах электролитической диссоциации.
Уравнения реакций.
MnO2+4HI->MnI2+2H2O+I2
H2SO3+Ca(OH)2->CaCO3+2H2O
Билет №6
Реакции самоокисления-самовосстановления (диспропорционирования).
Уравнения реакций.
2 K2CrO4+3 NaNO2+5 H2SO4 (разб.)-> 3 NaNO3 + Cr2(SO4)3 + 2 K2SO4 + 5 H2O
CuCO3+2 HCl-> CO2 + CuCl2 + H2O
Билет №8.
Уравнения реакций.
Cu+4HNO3(конц.)-> Cu(NO3)2 +2 NO2 + 2H2O
H3PO4+3KOH->K3PO4+3H2O
Билет №10.
Уравнения реакций.
FeCl2+Cl2+KOH->
2AlCl3+3Na2S-> Al2S3 + 6NaCl
Билет №12
Уравнения реакций.
3K2S+KMnO4+4H2SO4=3S+MnSO4+3K2SO4+4H2O
FeCl3+H2O= Fe(OH)Cl2 + HCl
Билет №14.
Планетарная модель атома водорода Резерфорда, постулаты Бора.
В первой атомной теории Дальтона предполагалось, что мир состоит из определенного числа атомов — элементарных кирпичиков — с характерными свойствами, вечными и неизменными.
Эти представления решительно изменились после открытия электрона. Все атомы должны содержать электроны. Но как электроны в них расположены? Физики могли лишь философствовать, исходя из своих познаний в области классической физики, и постепенно все точки зрения сошлись на одной модели, предложенной Дж.Дж. Томсоном. Согласно этой модели, атом состоит из положительно заряженного вещества, внутрь которого вкраплены электроны (возможно, они находятся в интенсивном движении), так что атом напоминает пудинг с изюмом. Томсоновскую модель атома нельзя было непосредственно проверить, но в ее пользу свидетельствовали всевозможные аналогии.
Рассеяние a-частиц при прохождении через фольгу вызывается кулоновскими силами, т.е. электрическим взаимодействием частицы и заряда атома. Гравитационное взаимодействие в 10 33 раз меньше, поэтому фактически роли не играет.
Какие же заряды в атоме вызывают рассеяние a-частиц? Электроны не могут этого сделать, так как их масса много меньше массы частицы: ma=7350me.При взаимодействии с электронами быстро движущаяся частица не изменяет направление своего движения.
Причиной рассеяния a-частицы является их взаимодействие с положительно заряженными частицами атома, занимающими очень малую область атома. Резерфорд назвал эту область ядром. В ядре сосредоточена почти вся масса атома и весь положительный заряд. Обобщив результаты опытов, Резерфорд предложил следующую модель строения атома:
1. в центре атома - положительно заряженное ядро:
-заряд ядра q = Z·e, где Z-порядковый номер элемента в таблице Менделеева, e =1.6·10-19 Кл - элементарный заряд;
-размер ядра 10-13 см;
-масса ядра фактически равна массе атома.
2. электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца:
-электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение.
-число электронов в атоме равно Z (порядковый номер элемента)
-электроны движутся с большой скоростью, образуя электронную оболочку атома.
Модель атома, предложенная Резерфордом, называется планетарной.
В 1913 году Бор показал, что несовпадение с экспериментом выводов, основанных на модели Резерфорда, возникла потому, что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел.
Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира - квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде трех постулатов. дополняющих (и "спасающих") атом Резерфорда.
Первый постулат:
Атомы имеют ряд стационарных состояний соответствующих определенным значениям энергий: Е1, Е2...En. Находясь в стационарном состоянии, атом энергии не излучает, несмотря на движение электронов.
Второй постулат:
В стационарном состоянии атома электроны движутся по стационарным орбитам, для которых выполняется квантовое соотношение:
m·V·r = n·h/2·p (1)
где m·V·r =L - момент импульса, n=1,2,3..., h-постоянная Планка.
Третий постулат:
Излучение или поглощение энергии атомом происходит при переходе его из одного стационарного состояния в другое. При этом излучается или поглощается порция энергии (квант), равная разности энергий стационарных состояний, между которыми происходит переход: e = h·u = Em-En (2)

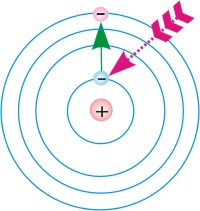 Схемы перехода атома:
Схемы перехода атома:
1.из основного стационарного состояния в возбужденное,
2.из возбужденного стационарного состояния в основное.
Уравнения реакций.
Zn+CuSO4= Cu↓ + ZnSO4
NaOCl+FeCl2+H2SO4(разб.)=
Билет №16
Уравнения реакций.
3Cl2+S+ 4H2O=H2SO4+6HCl
3Ba(OH)2 + 2H3PO4 (разб.) = Ba3(PO4)2+ 6H2O
Билет №18
Уравнения реакций.
6 KOH + 3 Br2 = KBrO3 + 5 KBr + 3 H2O
K2CO3+H2SO4= К2SO4 + H20 + CO2↑
Билет№20
Уравнения реакций
2 K2CrO4+3 NaNO2+5 H2SO4 (разб.)-> 3 NaNO3 + Cr2(SO4)3 + 2 K2SO4 + 5 H2O
AlCl3 + 3H2O = 3HCl + Al(OH)3
Билет №22.
Уравнения реакций.
SnCl2+KMnO4+HCl=SnCl4+MnCl2+KCl+H2O
NaHS+CH3COOH=CH3COONa+H2S
Билет №24
Уравнения реакций.
2KMnO4+10FeSO4+8H2SO4= 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Na3AsO4 + H2O =Na2HAsO4 + NaOH
Билет №2
Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость. Молекулы с нечетным числом электронов.
Молекула - физ.устойчивая система,состоящая из определенного числа ядер и электронов.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Пример: Н2+Н=>Н3 (такой молекулы не может быть,такое св-во называется-насыщаемость)
В методе молекулярных орбиталей для описания распределения электронной плотности в молекуле используется представление о молекулярной орбитали (подобно атомной орбитали для атома). Молекулярные орбитали - волновые функции электрона в молекуле или другой многоатомной химической частице. Каждая молекулярная орбиталь (МО), как и атомная орбиталь (АО), может быть занята одним или двумя электронами. Состояние электрона в области связывания описывает связывающая молекулярная орбиталь, в области разрыхления - разрыхляющая молекулярная орбиталь. Распределение электронов по молекулярным орбиталям происходит по тем же правилам, что и распределение электронов по атомным орбиталям в изолированном атоме. Молекулярные орбитали образуются при определенных комбинациях атомных орбиталей. Их число, энергию и форму можно вывести исходя из числа, энергии и формы орбителей атомов, составляющих молекулу.
В общем случае, волновые функции, отвечающие молекулярным орбиталям в двухатомной молекуле, представляют как сумму и разность волновых функций атомных орбитале, умноженных на некоторые постоянные коэффициенты, учитывающие долю атомных орбиталей каждого атома в образовании молекулярных орбиталей (они зависят от электроотрицательности атомов):
φ(АВ) = с1ψ(А) ± с2ψ(В).
У большинства известных молекул в своб. состоянии основное состояние является синглетным. Молекулы с нечетным числом электронов, к числу к-рых относится, напр., NO, имеют обычно дублетное основное состояние. Среди молекул, имеющих в качестве основного триплетное состояние, прежде всего выделяют мол. кислород О2.




 Схемы перехода атома:
Схемы перехода атома:


