Согласно этой теории, существуют вещества, способные в растворах и расплавах распадаться (диссоциировать) на ионы, вследствие чего растворы и расплавы этих веществ, проводят электрический ток. Эти вещества были названы электролитами.
Электролитами называют вещества, расплавы или водные растворы которых подвергаются электролитической диссоциации, т. е. распадаются на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
Сильными считаются электролиты, которые в разбавленных растворах находятся преимущественно в виде ионов, слабыми – такие, которые в разбавленных растворах находятся преимущественно в виде молекул.
Степенью диссоциации a называется отношение числа молекул, распавшихся в растворе на ионы, к общему числу молекул электролита в растворе.

N(X)–число продиссоциировавших молекул электролита X;
N0(X) – общее число молекул электролита X в растворе.
Степень электролитической диссоциации зависит от природы электролита и растворителя, температуры и от концентрации раствора. Более универсальной характеристикой электролита является его константа диссоциации (K) – константа равновесия процесса диссоциации, которая не зависит от концентрации.
Для процесса диссоциации некоторого электролита

константа диссоциации будет равна отношению равновесных концентраций образовавшихся ионов к равновесной концентрации молекулярной формы электролита: 
При составлении ионно-молекулярных уравнений реакций (реакций с участием не только молекул, но и ионов) следует руководствоваться следующими правилами:
химические формулы сильных электролитов записываются в ионной форме, т.е. в виде ионов, образующихся в результате их диссоциации;
в молекулярном виде следует записывать формулы слабых электролитов, неэлектролитов (простые вещества, оксиды, газообразные вещества), трудно- и малорастворимых веществ.
Для составления ионно-молекулярного уравнения необходимо:
− записать молекулярное уравнение реакции;
− составить полное ионно-молекулярное уравнение, для чего формулу каждого из участников реакции записать в молекулярной или ионной форме в соответствии с указанными выше правилами;
− составить краткое ионно-молекулярное уравнение, исключив из полного уравнения одинаковые ионы, т.е. те ионы, которые присутствуют в обеих частях уравнения в неизменном виде, а, следовательно, не участвуют в реакции.
Примеры составления ионно-молекулярных уравнений реакций
Реакции, идущие с образованием слабого электролита
1. Реакции нейтрализации, протекающие с образованием слабого электролита − воды:

Полное ионно-молекулярное уравнение:

Краткое ионно-молекулярное уравнение (сокращены одинаковые ионы: катионы калия и хлорид-анионы):

2. Реакции, идущие с образованием слабых кислот или оснований:



Реакции, идущие с образованием газообразного продукта



Реакции, идущие с образованием трудно- и малорастворимых соединений



№12
Электроли́ты — вещества, расплавы или растворы которых проводят электрический ток вследствие диссоциации на ионы, однако сами вещества не проводят электрический ток.
Исходя из степени диссоциации все электролиты делятся на две группы:
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или H2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
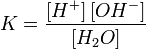
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН.
Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода, выраженной в молях на литр:
pH=-lg[ H+ ]
В воде концентрация ионов водорода определяется электролитической диссоциацией воды по уравнению
H2O=H++OH-
Константа диссоциации при 22° С составляет

Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной обшей концентрации воды, которая составляет: С[H2O ]=1000/18=55,55моль/л.
Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл.
В случае, если [ H+ ] =[ OH- ]эти концентрации (каждая из них) равны  моль/л, т.е [ H+ ] =[ OH- ]=10-7моль/л и среда нейтральная, в этих растворах
моль/л, т.е [ H+ ] =[ OH- ]=10-7моль/л и среда нейтральная, в этих растворах
pH=-lg[ H+ ]=7 и рОН=-lg[ OH-]=7
Если [ H+ ]>10-7моль/л, [ OH-]<10-7моль/л -среда кислая; рН<7.
Если [ H+ ]<10-7 моль/л, [ OH-]>10-7моль/л -среда щелочная; рН>7.
В любом водном растворе рН + рОН =14, где рОН=-lg[ OH-]
Буферные растворы – это растворы, при внесении в которые малых количеств кислоты или щелочи значение рН раствора не изменяется.
Наиболее часто применяемые буферные растворы содержат:
слабую кислоту и соль, образованную этой кислотой и сильным основанием (ацетатная буферная смесь: уксусная кислота и ацетат натрия);
слабое основание и соль, образованная этим основанием с сильной кислотой (водный раствор аммиака и хлорида аммония);
сильное основание и соль, образованную этим основанием и слабой кислотой (гидроксид натрия и гидрофосфат натрия);
слабую кислоту и сильное основание (гидроксид натрия и борная кислота);
смеси солей (гидрофосфаты натрия и калия).
Меняя соотношение между компонентами таких растворов, можно получать разные значения рН.
Действие буферных растворов основано на том, что входящие в них компоненты связывают Н+-ионы кислот или ОН--ионы оснований, вводимых в раствор или образующихся в растворе при протекании реакции.
Например, если к ацетатной буферной смеси добавить сильную кислоту (в малых количествах), то Н+-ионы добавляемой кислоты будут соединяться с СН3СОО- -ионами соли в малодиссоциированные молекулы соли с СН3СООН, а концентрация Н+-ионов в растворе увеличиваться не будет.
При добавлении (в малых количествах) щелочи добавляемые ОН--ионы будут связывать Н+-ионы буферной кислоты в малодиссоциированные молекулы воды, но концентрация протонов водорода сразу восстановится вследствие смещения равновесия диссоциации уксусной кислоты в сторону увеличения диссоциации кислоты. Таким образом, рН среды остается практически неизменным.
Количество молей сильной кислоты или щелочи, добавление которых к 1 л буферной смеси изменяет значение рН на единицу, называется буферной емкостью. Емкость буферного раствора возрастает при увеличении начальных концентраций его компонентов и максимальна при их равенстве.
Гидролизом соли называется обменная реакция взаимодействия соли с водой, приводящая к смещению равновесия диссоциации воды и, как правило, к изменению кислотности среды.
Гидролизу могут подвергаться только те соли, ионы которых способны связывать Н+ или ОН–- ионы воды в малодиссоциированные соединения, т.е. соли, образованные слабыми кислотами и (или) слабыми основаниями. Соли, образованные сильными кислотами и сильными основаниями, гидролизу не подвергаются.
В результате гидролиза солей образуется либо кислота (кислая соль) и основание, либо основание (основная соль) и кислота. Следовательно, процесс гидролиза соли можно рассматривать как процесс, обратный реакции нейтрализации. Так как реакции нейтрализации обычно идут практически до конца, то равновесие реакции гидролиза смещено в сторону реагирующих веществ. Концентрация продуктов гидролиза соли, как правило, мала.
Реакция среды при гидролизе соли, образованной сильным основанием и слабой кислотой, – щелочная (pH>7).
Реакция среды при гидролизе соли, образованной слабым основанием и сильной кислотой, – кислая (рН<7).
Гидролиз солей, образованных слабым основанием и слабой кислотой
Подобные соли легче других подвергаются гидролизу, так как ионы этих солей одновременно связываются обоими ионами воды с образованием двух слабых электролитов.
Реакция среды в растворах таких солей зависит от относительной силы кислоты и основания, т.е. водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований.
Степень гидролиза
Количественно процесс гидролиза можно характеризовать степенью гидролиза h (%).

Гидролиз солей в большинстве случаев протекает обратимо. Поэтому для процесса гидролиза, как и любого равновесного процесса можно записать выражение константы равновесия. Константа равновесия в данном случае называется константой гидролиза.
Для соли, гидролизующейся по катиону Me+ + HOH ⇆ MeOH + H+
 .
.
№13


















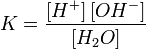

 моль/л, т.е [ H+ ] =[ OH- ]=10-7моль/л и среда нейтральная, в этих растворах
моль/л, т.е [ H+ ] =[ OH- ]=10-7моль/л и среда нейтральная, в этих растворах
 .
.


