Использование соединений серы (4) в пищевой промышленности.оксид серы (6),серная кислота и ее соли.качественная реакция на ион SO4 и SO3 СЕРА (лат. Sulfur), S, химический элемент с атомным номером 16, атомная масса 32,066. Химический символ серы S. Сера расположена в VIA группе периодической системы Д. И. Менделеева, в 3-м периоде, и принадлежит к числу халькогенов. Конфигурация внешнего электронного слоя 3s23p4. Наиболее характерны степени окисления в соединениях –2, +4, +6 (валентности соответственно II, IV и VI). В свободном виде сера представляет собой желтые хрупкие кристаллы или желтый порошок.Физические и химические свойства: атомы серы обладают уникальной способностью образовывать устойчивые гомоцепи, т. е. цепи, состоящие только из атомов S (энергия связи S–S составляет около 260 кДж/моль).. Ее кристаллическая решетка орторомбическая, Сера — достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами.S + O2 = SO2; S + 3F2 = SF6,2S + Cl2 = S2Cl2 (c примесью SCl2)С водородом при нагревании сера образует сероводород H2S и в небольшом количестве сульфаны (соединения состава H2Sn):H2 + S <-> H2S.Примеры реакций серы с металлами:2Na + S = Na2S, Ca + S = CaS, Fe + S = FeSОбразующиеся в этих реакциях сульфиды характеризуются не постоянным, а, как правило, переменным составом. Так, состав сульфида кальция может непрерывно изменяться в границах от CaS до CaS5. Полисульфиды типа СаSn или Na2Sn при взаимодействии, например, с соляной кислотой образуют сульфаны H2Sn, причем значение n может составлять от 1 до приблизительно 10.Концентрированная серная кислота при нагревании окисляет серу до SO2:S + 2H2SO4 = 2H2O + 3SO2.Царская водка (смесь азотной и соляной кислот) окисляет серу до серной кислоты.Разбавленная азотная кислота, соляная кислота без окислителей и серная кислота на холоде с серой во взаимодействие не вступают. При нагревании в кипящей воде или растворах щелочей сера диспропорционирует:3S + 6NaOH<> 2Na2S + Na2SO3 + 3H2O;Сера может присоединяться к сульфидамNa2S + (n–1)S = Na2Snи к сульфитам: Na2SO3 + S = Na2S2O3В результате протекания данной реакции из сульфита натрия Na2SO3 образуется тиосульфат натрия Na2S2O3.При нагревании сера реагирует почти со всеми элементами, кроме инертных газов, иода, азота, платины и золота.
Известно несколько оксидов серы. Кроме устойчивых диоксида серы SO2 [другие названия: сернистый газ, сернистый ангидрид, оксид серы (IV)] и триоксида серы SO3 [другие названия: серный газ, серный ангидрид, оксид серы (VI)], получены неустойчивые оксиды S2O (при пропускании тока SO2 через тлеющий разряд) и S8O (при взаимодействии H2S с SOCl2). Пероксиды SO4 и S2O7образуются при пропускании SO2 в смеси с кислородом через тлеющий разряд или за счет окисления SO2 озоном.Кислотному диоксиду серы SO2 соответствует неустойчивая кислота средней силы H2SO3 (сернистая кислота):Н2О + SO2 <> H2SO3,а кислотному триоксиду серы SO3 — сильная двухосновная серная кислота H2SO4:SO3 + H2O = H2SO4И сернистой кислоте H2SO3, и серной H2SO4 соответствуют по два ряда солей: кислые [соответственно гидросульфиты NaHSO3, Ca(HSO3)2 и др. и гидросульфаты КНSO4, NaНSO4 и другие] и средние [сульфиты Na2SO3, K2SO3 и сульфаты CaSO4, Fe2 (SO4)3].Сера входит в состав многих органических соединений. SO2 (сернистый ангидрид; сернистый газ)  Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H2Oрастворяется 40V SO2 при н.у.); более чем в два раза тяжелее воздуха, ядовит; t°пл. = -75,5°C; t°кип. = -10°С.Обесцвечивает многие красители, убивает микроорганизмы.Получение: 1) При сжигании серы в кислороде: S + O2 → SO22) Окислением сульфидов: 4FeS2 + 11O2 → 2Fe2O3 + 8SO23) Обработкой солей сернистой кислоты минеральными кислотами: Na2SO3 + 2HCl → 2NaCl + SO2 + H2O4) При окислении металлов концентрированной серной кислотой:Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2OХимические свойства: 1) Сернистый ангидрид - кислотный оксид. При растворении в воде образуется слабая и неустойчивая сернистая кислотаH2SO3 (существует только в водном растворе)SO2 + H2O ↔ H2SO3Сернистая кислота диссоциирует ступенчато:H2SO3 ↔ H+ + HSO3- (первая ступень, образуется гидросульфит – анион) HSO3- ↔ H+ + SO32- (вторая ступень, образуется анион сульфит) H2SO3 образует два ряда солей - средние (сульфиты) и кислые (гидросульфиты).Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO2 с резким запахом: Na2SO3 + 2HCl → 2NaCl + SO2 ↑+ H2O 2H+ + SO32- → SO2 ↑+ H2O Свойства сернистой кислоты Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.H2SO3 + I2 + H2O = H2SO4 + 2НI Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка. взаимодействие со щелочами Ba(OH)2 + SO2 → BaSO3↓(сульфит бария) + H2OBa(OH)2 + 2SO2 (избыток)→ Ba(HSO3)2(гидросульфит бария) взаимодействие с основными оксидами SO2 + CaO = CaSO3 2) Реакции окисления, SO2 - восстановитель (S+4 – 2ē → S+6)2 SO2 + O2 → 2 SO3 (катализатор – V2O5)SO2 + Br2 + 2H2O → H2SO4 + 2HBr5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4Водные растворы сульфитов щелочных металлов окисляются на воздухе: 2Na2SO3 + O2 → 2Na2SO4;2SO32- + O2 → 2SO42- 3) Реакции восстановления, SO2 - окислитель (S+4 + 4ē → S0) SO2 + С → S + СO2 (при нагревании)SO2 + 2H2S → 3S + 2H2O
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H2Oрастворяется 40V SO2 при н.у.); более чем в два раза тяжелее воздуха, ядовит; t°пл. = -75,5°C; t°кип. = -10°С.Обесцвечивает многие красители, убивает микроорганизмы.Получение: 1) При сжигании серы в кислороде: S + O2 → SO22) Окислением сульфидов: 4FeS2 + 11O2 → 2Fe2O3 + 8SO23) Обработкой солей сернистой кислоты минеральными кислотами: Na2SO3 + 2HCl → 2NaCl + SO2 + H2O4) При окислении металлов концентрированной серной кислотой:Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2OХимические свойства: 1) Сернистый ангидрид - кислотный оксид. При растворении в воде образуется слабая и неустойчивая сернистая кислотаH2SO3 (существует только в водном растворе)SO2 + H2O ↔ H2SO3Сернистая кислота диссоциирует ступенчато:H2SO3 ↔ H+ + HSO3- (первая ступень, образуется гидросульфит – анион) HSO3- ↔ H+ + SO32- (вторая ступень, образуется анион сульфит) H2SO3 образует два ряда солей - средние (сульфиты) и кислые (гидросульфиты).Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO2 с резким запахом: Na2SO3 + 2HCl → 2NaCl + SO2 ↑+ H2O 2H+ + SO32- → SO2 ↑+ H2O Свойства сернистой кислоты Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.H2SO3 + I2 + H2O = H2SO4 + 2НI Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка. взаимодействие со щелочами Ba(OH)2 + SO2 → BaSO3↓(сульфит бария) + H2OBa(OH)2 + 2SO2 (избыток)→ Ba(HSO3)2(гидросульфит бария) взаимодействие с основными оксидами SO2 + CaO = CaSO3 2) Реакции окисления, SO2 - восстановитель (S+4 – 2ē → S+6)2 SO2 + O2 → 2 SO3 (катализатор – V2O5)SO2 + Br2 + 2H2O → H2SO4 + 2HBr5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4Водные растворы сульфитов щелочных металлов окисляются на воздухе: 2Na2SO3 + O2 → 2Na2SO4;2SO32- + O2 → 2SO42- 3) Реакции восстановления, SO2 - окислитель (S+4 + 4ē → S0) SO2 + С → S + СO2 (при нагревании)SO2 + 2H2S → 3S + 2H2O
Серни́стаякислота — неустойчивая двухосновная неорганическая кислота средней силы. Химическая формула  .Химические свойстваКислота средней силы:
.Химические свойстваКислота средней силы: 
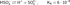 Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):  Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
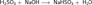 и средние — сульфиты (в избытке щёлочи):
и средние — сульфиты (в избытке щёлочи):  Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями: 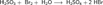 При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:  Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:  слабая двухосновная кислота, отвечающая степени окисления серы +4
слабая двухосновная кислота, отвечающая степени окисления серы +4
Применение Сернистая кислота и её соли применяют как восстановители, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей (хлора). Сернистую кислоту применяют при консервировании плодов и овощей. Гидросульфит кальция (сульфитный щелок, Са(HSO3)2) используют для переработки древесины в так называемуюсульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнин — вещество, связывающее волокна целлюлозы, в результате чего волокна отделяются друг от друга; обработанную таким образом древесину используют для получения бумаги).
SO3 (серный ангидрид) -Бесцветная летучая маслянистая жидкость, t°пл. = 17°C; t°кип. = 66°С; на воздухе "дымит", сильно поглощает влагу (хранят в запаянных сосудах).SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом. Получение1) 2SO2 + O2 → 2SO3 (катализатор – V2O5, при 450˚С) 2) Fe2(SO4)3 → Fe2O3 + 3SO3 (разложение при нагревании) Химические свойства 1) Серный ангидрид - кислотный оксид.Взаимодействие с водойПри растворении в воде дает сильную двухосновную серную кислоту:SO3 + H2O → H2SO4Диссоциация протекает ступенчато:H2SO4→ H+ + HSO4- (первая ступень, образуется гидросульфат – ион)HSO4- → H+ + SO42- (вторая ступень, образуется сульфат – ион)H2SO4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты)Взаимодействие со щелочами 2NaOH + SO3 → Na2SO4 + H2ONaOH + SO3 (избыток) → NaHSO4Взаимодействие с основными оксидамиNa2O + SO3 → Na2SO42) SO3 - сильный окислитель.



 Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H2Oрастворяется 40V SO2 при н.у.); более чем в два раза тяжелее воздуха, ядовит; t°пл. = -75,5°C; t°кип. = -10°С.Обесцвечивает многие красители, убивает микроорганизмы.Получение: 1) При сжигании серы в кислороде: S + O2 → SO22) Окислением сульфидов: 4FeS2 + 11O2 → 2Fe2O3 + 8SO23) Обработкой солей сернистой кислоты минеральными кислотами: Na2SO3 + 2HCl → 2NaCl + SO2 + H2O4) При окислении металлов концентрированной серной кислотой:Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2OХимические свойства: 1) Сернистый ангидрид - кислотный оксид. При растворении в воде образуется слабая и неустойчивая сернистая кислотаH2SO3 (существует только в водном растворе)SO2 + H2O ↔ H2SO3Сернистая кислота диссоциирует ступенчато:H2SO3 ↔ H+ + HSO3- (первая ступень, образуется гидросульфит – анион) HSO3- ↔ H+ + SO32- (вторая ступень, образуется анион сульфит) H2SO3 образует два ряда солей - средние (сульфиты) и кислые (гидросульфиты).Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO2 с резким запахом: Na2SO3 + 2HCl → 2NaCl + SO2 ↑+ H2O 2H+ + SO32- → SO2 ↑+ H2O Свойства сернистой кислоты Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.H2SO3 + I2 + H2O = H2SO4 + 2НI Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка. взаимодействие со щелочами Ba(OH)2 + SO2 → BaSO3↓(сульфит бария) + H2OBa(OH)2 + 2SO2 (избыток)→ Ba(HSO3)2(гидросульфит бария) взаимодействие с основными оксидами SO2 + CaO = CaSO3 2) Реакции окисления, SO2 - восстановитель (S+4 – 2ē → S+6)2 SO2 + O2 → 2 SO3 (катализатор – V2O5)SO2 + Br2 + 2H2O → H2SO4 + 2HBr5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4Водные растворы сульфитов щелочных металлов окисляются на воздухе: 2Na2SO3 + O2 → 2Na2SO4;2SO32- + O2 → 2SO42- 3) Реакции восстановления, SO2 - окислитель (S+4 + 4ē → S0) SO2 + С → S + СO2 (при нагревании)SO2 + 2H2S → 3S + 2H2O
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H2Oрастворяется 40V SO2 при н.у.); более чем в два раза тяжелее воздуха, ядовит; t°пл. = -75,5°C; t°кип. = -10°С.Обесцвечивает многие красители, убивает микроорганизмы.Получение: 1) При сжигании серы в кислороде: S + O2 → SO22) Окислением сульфидов: 4FeS2 + 11O2 → 2Fe2O3 + 8SO23) Обработкой солей сернистой кислоты минеральными кислотами: Na2SO3 + 2HCl → 2NaCl + SO2 + H2O4) При окислении металлов концентрированной серной кислотой:Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2OХимические свойства: 1) Сернистый ангидрид - кислотный оксид. При растворении в воде образуется слабая и неустойчивая сернистая кислотаH2SO3 (существует только в водном растворе)SO2 + H2O ↔ H2SO3Сернистая кислота диссоциирует ступенчато:H2SO3 ↔ H+ + HSO3- (первая ступень, образуется гидросульфит – анион) HSO3- ↔ H+ + SO32- (вторая ступень, образуется анион сульфит) H2SO3 образует два ряда солей - средние (сульфиты) и кислые (гидросульфиты).Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO2 с резким запахом: Na2SO3 + 2HCl → 2NaCl + SO2 ↑+ H2O 2H+ + SO32- → SO2 ↑+ H2O Свойства сернистой кислоты Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.H2SO3 + I2 + H2O = H2SO4 + 2НI Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка. взаимодействие со щелочами Ba(OH)2 + SO2 → BaSO3↓(сульфит бария) + H2OBa(OH)2 + 2SO2 (избыток)→ Ba(HSO3)2(гидросульфит бария) взаимодействие с основными оксидами SO2 + CaO = CaSO3 2) Реакции окисления, SO2 - восстановитель (S+4 – 2ē → S+6)2 SO2 + O2 → 2 SO3 (катализатор – V2O5)SO2 + Br2 + 2H2O → H2SO4 + 2HBr5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4Водные растворы сульфитов щелочных металлов окисляются на воздухе: 2Na2SO3 + O2 → 2Na2SO4;2SO32- + O2 → 2SO42- 3) Реакции восстановления, SO2 - окислитель (S+4 + 4ē → S0) SO2 + С → S + СO2 (при нагревании)SO2 + 2H2S → 3S + 2H2O .Химические свойстваКислота средней силы:
.Химические свойстваКислота средней силы: 
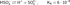 Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):  Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):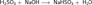 и средние — сульфиты (в избытке щёлочи):
и средние — сульфиты (в избытке щёлочи):  Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями: 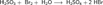 При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:  Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:  слабая двухосновная кислота, отвечающая степени окисления серы +4
слабая двухосновная кислота, отвечающая степени окисления серы +4


