Атом, его составные части (ядро, протоны, нейтроны, электроны), их заряд, масса. Химический элемент. Изотопы.
А́том — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Состоит из нуклонов – протонов(+) и нейтронов (0). Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами (наоборот – изотонами). Прото́н — элементарная частица, электрический заряд равен +1.Масса протона ~1 а.е.м. Ядро атома водорода состоит из одного протона. Нейтро́н —элементарная частица, не имеющая электрического заряда. Масса = 1 а.е.м. Электро́н — отрицательно заряженная элементарная частица. Из электронов состоят электронные оболочки атомов, где их число и положение определяет почти все химические свойствавеществ. Движение свободных электронов обусловливает такие явления, какэлектрический ток в проводниках и вакууме.Заряд равен −1,602176565(35)·10−19 Кл. Масса электрона равна 9,10938291(40)·10−28 г. Химическийэлемент — совокупность атомов с одинаковым зарядом ядра и числомпротонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе Менделеева. Формой существования химических элементов в свободном виде являются простые вещества. Порядковый номер элемента в ней равен заряду ядра, который, в свою очередь, численно равен числу содержащихся в ядре протонов. Суммарное число протонов и нейтронов в ядре равномассовому числу А. Количество протонов равно количеству электронов. Изото́пы — разновидности атомов какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа. Пример изотопов: 168O (заряд ядра = 8, атомная масса = 16), 178O, 188O — три стабильных изотопа кислорода.
Периодический закон Д.И.Менделеева. Структура периодической системы: периоды, группы, подгруппы. Особенности электронного строения атомов главных и побочных подгрупп.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов». Период — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки. Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует типичный неметалл. Группа — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением.Номер группы определяется количеством электронов на внешней оболочке атома (валентных электронов) и, как правило, соответствует высшей валентности атома. В короткопериодном варианте периодической системы группы подразделяются на подгруппы— главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побоч ны е (подгруппы В), содержащие d-элементы. Элементы одной подгруппы обладают сходными химическими свойствами.У атомов элементов главных подгрупп заполняются электронами последние уровни, а у побочных - предпоследние. Число электронов на последнем уровне у элементов главных подгрупп совпадает с номером их группы, у элементов побочных подгрупп – нет.
Изменение свойств элементов в периодической системе
см. п. 4
О связи элементов ПС элементов со строением атома смотри начало 4 билета
Ионные реакции.
Ионные реакции — реакции между ионами в растворе. Например, реакциюAgNO3 + NaCl = NaNO3 + AgClможно представить в ионном виде (реакция расписывается на ионы, не расписываются осадки, газы, вода, слабые кислоты и основания, а также малорастворимые и нерастворимые соединения) например AgCl нерастворим в воде и на ионы не расписывается:Ag+ + NO3− + Na+ + Cl− = AgCl + Na+ + NO3−Одинаковые ионы сокращаются и получается сокращенное ионное уравнение. Так как взаимодействие произошло между ионами Ag+ и ионами Cl−, то выражение Ag+ + Cl− = AgClи есть ионное уравнение рассматриваемой реакции. Оно проще молекулярного и в то же время отражает сущность происходящей реакции.
Условия необратимости ионной реакции: 1. Если в результате реакции выделяется малодиссоциирующее вещество – вода. Молекулярное уравнение реакции щелочи с кислотой:  Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.Полное ионное уравнение реакции:K+ + OH– + H+ + Cl– = K+ + Cl– + H2O.Cокращенное ионное уравнение реакции: H+ + OH– = H2O. Молекулярное уравнение реакции основного оксида с кислотой: CaO + 2HNO3 = Ca(NO3)2 + H2O.Полное ионное уравнение реакции:
Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.Полное ионное уравнение реакции:K+ + OH– + H+ + Cl– = K+ + Cl– + H2O.Cокращенное ионное уравнение реакции: H+ + OH– = H2O. Молекулярное уравнение реакции основного оксида с кислотой: CaO + 2HNO3 = Ca(NO3)2 + H2O.Полное ионное уравнение реакции:
 Cокращенное ионное уравнение реакции: CaO + 2H+ = Ca2+ + H2O. Молекулярное уравнение реакции нерастворимого основания с кислотой: 3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2
Cокращенное ионное уравнение реакции: CaO + 2H+ = Ca2+ + H2O. Молекулярное уравнение реакции нерастворимого основания с кислотой: 3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2  + 6H2O. Полное ионное уравнение реакции:
+ 6H2O. Полное ионное уравнение реакции:  В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением. Молекулярное уравнение реакции амфотерного оксида с кислотой: Al2O3 + 6HCl = 2AlCl3 + 3H2O.Полное ионное уравнение реакции:Al2O3 + 6H+ + 6Cl– = 2Al3+ + 6Cl– + 3H2O. Cокращенное ионное уравнение реакции:Al2O3 + 6H+ = 2Al3+ + 3H2O.
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением. Молекулярное уравнение реакции амфотерного оксида с кислотой: Al2O3 + 6HCl = 2AlCl3 + 3H2O.Полное ионное уравнение реакции:Al2O3 + 6H+ + 6Cl– = 2Al3+ + 6Cl– + 3H2O. Cокращенное ионное уравнение реакции:Al2O3 + 6H+ = 2Al3+ + 3H2O.
2. Если в результате реакции выделяется нерастворимое в воде вещество. Молекулярное уравнение реакции растворимой соли со щелочью: CuCl2 + 2KOH = 2KCl + Cu(OH)2  .Полное ионное уравнение реакции: Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2
.Полное ионное уравнение реакции: Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2  .
.
Cокращенное ионное уравнение реакции: Cu2+ + 2OH– = Cu(OH)2  . М олекулярное уравнение реакции двух растворимых солей: Al2(SO4)3 + 3BaCl2 = 3BaSO4
. М олекулярное уравнение реакции двух растворимых солей: Al2(SO4)3 + 3BaCl2 = 3BaSO4  + 2AlCl3.Полное ионное уравнение реакции:
+ 2AlCl3.Полное ионное уравнение реакции:  Cокращенное ионное уравнение реакции:
Cокращенное ионное уравнение реакции: 
Молекулярное уравнение реакции нерастворимого основания с кислотой: Fe(OH)3 + H3PO4 = FePO4  + 3H2O. Полное ионное уравнение реакции:
+ 3H2O. Полное ионное уравнение реакции:  В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
3. Если в результате реакции выделяется газообразное вещество. Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой: K2S + 2HCl = 2KCl + H2S  .Полное ионное уравнение реакции: 2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S
.Полное ионное уравнение реакции: 2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S  . Cокращенное ионное уравнение реакции: S2– + 2H+ = H2S
. Cокращенное ионное уравнение реакции: S2– + 2H+ = H2S  . М олекулярное уравнение реакции растворимой соли (карбоната) с кислотой: Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2
. М олекулярное уравнение реакции растворимой соли (карбоната) с кислотой: Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2  Полное ионное уравнение реакции:
Полное ионное уравнение реакции:  Cокращенное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:  О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV). Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой: 3СaCO3 + 2H3РO4 = Са3(PO4)2
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV). Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой: 3СaCO3 + 2H3РO4 = Са3(PO4)2  + 3H2O + 3CO2
+ 3H2O + 3CO2  Полное ионное уравнение реакции:
Полное ионное уравнение реакции: 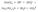 В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
По природе лиганда
1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.
2) Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
3) Карбонилы — комплексные соединения, в которых лигандами являются молекулы оксида углерода(II): [Fe(CO)5], [Ni(CO)4].
4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
5) Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
Элементы VIIА подгруппы.
Галогены - химические элементы 7-й группы периодической таблицы химических элементов Д.И. Менделеева. Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается. Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.FClBrI---------> не металлические свойства ослабевают, окислительная способность падает. Г2 + 2e --> 2Г-Физические свойства простых веществ - все галогены токсичны, плохо растворимы в H2O1VH2O – 2.3VCl2 (20°C)2F2 + 2H2O -->4HF + O2Cl2; Br2; J2 – подвергаются гидролизу (образуется хлорная, бромная либо йодная вода).Г2 + H2O<-->НГ + НГО
Химические свойства. F2 не реагирует с C; N2; O2Cl2 не реагирует с C; N2 Галогеноводороды H 2 + Г 2 --> 2НГ (синтез)HF – взрыв HCl – на светуHJ – при нагреванииCaF2 + H2SO4(конц)-->CaSO4 + 2HFNaCl + H2SO4 -->NaHSO4 + HCl(газ) NaCl + NaHSO4 -->Na2SO4 + HCl(газ)(дляJ; Br) РГ3 + H2O<--> 3НГ + H3PO4 НГ – растворяется в воде с образованием кислоты.HFHClHBrHJ ---------->(сила кислот увеличивается, устойчивость уменьшается, восстановительные свойства усиливаются)HClO – хлорноватистая (гипохлориты)HClO2 – хлористая (хлориты)HClO3 – хлорноватая (хлораты)HClO4 – хлорная (перхлораты) HClOHClO2HClO3HClO4--------------------->(окислительные свойства уменьшаются, сила кислот увеличивается)
Оксиды и гидроксиды.
CO2 + 2H2 -->C + 2H2O
CO2 + H2O <--> H2CO3
SiO2 + H2O --> (неидет)
SnO + H2SO4 --> SnSO4 +H2O
SnO + NaOH + H2O <--> Na[Sn(OH)3]
2SnO + O2 --> 2SnO2
Sn(OH)2 + 3HCl --> H[SnCl3] + 2H2O
Sn(OH)2 + NaOH --> Na[Sn(OH)3]
Pb(OH)2 + 2HCl --> PbCl2 + 2H2O
Pb(OH)2 + NaOH --> Na2[Pb(OH)4]
Pb(OH)2 + CO2 --> Pb2(OH)2CO3
Атом, его составные части (ядро, протоны, нейтроны, электроны), их заряд, масса. Химический элемент. Изотопы.
А́том — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Состоит из нуклонов – протонов(+) и нейтронов (0). Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами (наоборот – изотонами). Прото́н — элементарная частица, электрический заряд равен +1.Масса протона ~1 а.е.м. Ядро атома водорода состоит из одного протона. Нейтро́н —элементарная частица, не имеющая электрического заряда. Масса = 1 а.е.м. Электро́н — отрицательно заряженная элементарная частица. Из электронов состоят электронные оболочки атомов, где их число и положение определяет почти все химические свойствавеществ. Движение свободных электронов обусловливает такие явления, какэлектрический ток в проводниках и вакууме.Заряд равен −1,602176565(35)·10−19 Кл. Масса электрона равна 9,10938291(40)·10−28 г. Химическийэлемент — совокупность атомов с одинаковым зарядом ядра и числомпротонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе Менделеева. Формой существования химических элементов в свободном виде являются простые вещества. Порядковый номер элемента в ней равен заряду ядра, который, в свою очередь, численно равен числу содержащихся в ядре протонов. Суммарное число протонов и нейтронов в ядре равномассовому числу А. Количество протонов равно количеству электронов. Изото́пы — разновидности атомов какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа. Пример изотопов: 168O (заряд ядра = 8, атомная масса = 16), 178O, 188O — три стабильных изотопа кислорода.



 Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.Полное ионное уравнение реакции:K+ + OH– + H+ + Cl– = K+ + Cl– + H2O.Cокращенное ионное уравнение реакции: H+ + OH– = H2O. Молекулярное уравнение реакции основного оксида с кислотой: CaO + 2HNO3 = Ca(NO3)2 + H2O.Полное ионное уравнение реакции:
Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.Полное ионное уравнение реакции:K+ + OH– + H+ + Cl– = K+ + Cl– + H2O.Cокращенное ионное уравнение реакции: H+ + OH– = H2O. Молекулярное уравнение реакции основного оксида с кислотой: CaO + 2HNO3 = Ca(NO3)2 + H2O.Полное ионное уравнение реакции: Cокращенное ионное уравнение реакции: CaO + 2H+ = Ca2+ + H2O. Молекулярное уравнение реакции нерастворимого основания с кислотой: 3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2
Cокращенное ионное уравнение реакции: CaO + 2H+ = Ca2+ + H2O. Молекулярное уравнение реакции нерастворимого основания с кислотой: 3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2  + 6H2O. Полное ионное уравнение реакции:
+ 6H2O. Полное ионное уравнение реакции:  В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением. Молекулярное уравнение реакции амфотерного оксида с кислотой: Al2O3 + 6HCl = 2AlCl3 + 3H2O.Полное ионное уравнение реакции:Al2O3 + 6H+ + 6Cl– = 2Al3+ + 6Cl– + 3H2O. Cокращенное ионное уравнение реакции:Al2O3 + 6H+ = 2Al3+ + 3H2O.
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением. Молекулярное уравнение реакции амфотерного оксида с кислотой: Al2O3 + 6HCl = 2AlCl3 + 3H2O.Полное ионное уравнение реакции:Al2O3 + 6H+ + 6Cl– = 2Al3+ + 6Cl– + 3H2O. Cокращенное ионное уравнение реакции:Al2O3 + 6H+ = 2Al3+ + 3H2O. Cокращенное ионное уравнение реакции:
Cокращенное ионное уравнение реакции: 
 В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды. .Полное ионное уравнение реакции: 2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S
.Полное ионное уравнение реакции: 2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S  Cокращенное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:  О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV). Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой: 3СaCO3 + 2H3РO4 = Са3(PO4)2
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV). Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой: 3СaCO3 + 2H3РO4 = Са3(PO4)2 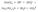 В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.


