

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
С помощью него осуществляют выбор индикатора, решают некоторые другие вопросы.
Чем больше скачок титрования, тем точнее будут результаты анализа и более широкий выбор индикаторов для его проведения.
На величину скачка титрования влияют, в первую очередь, кислотные и основные свойства исходных веществ, их содержание в растворе, а также температура реакционной среды.
Чем более сильными являются используемые кислота и основание, и чем выше их концентрация в растворе, тем скачок титрования больше. Так, при молярной концентрации химического эквивалента НСl и NaOH, равной 0,1 моль/дм3, величина скачка титрования составляет почти 6 единиц рН (рис. 15).
В случае сантимолярных растворов этих же исходных веществ (0,01 моль/дм3) скачок титрования составляет уже 4 единицы рН. Обычно на практике редко используют растворы с концентрацией химического эквивалента вещества больше 0,2 моль/дм3. Это связано с тем, что значительно возрастают ошибки титрования за счёт неточности измерения количественных характеристик (объема, массы растворенной навески) более концентрированных растворов.
Повышение температуры оказывает существенное влияние на скачок титрования в сторону его уменьшения вследствие возрастания константы диссоциации воды. Отсюда следует, что кислотно-основное титрование лучше проводить, не прибегая к нагреванию.
Для титрования можно использовать только те индикаторы, интервал перехода которых полностью лежит на скачке титрования. Причём, чем более симметрично он расположен относительно точки эквивалентности, тем более предпочтительным является данный индикатор (в идеале точка эквивалентности должна лежать в середине интервала перехода). Показатель титрования (рТ) индикатора при этом тоже будет лежать на скачке титрования и может отклониться от точки эквивалентности в ту или иную сторону. Наиболее оптимальным является случай, когда рТ индикатора совпадает на графике с точкой эквивалентности, но это происходит далеко не всегда. В случае несовпадения значений рН для рТ индикатора и точки эквивалентности возникает так называемая индикаторная ошибка, связанная с недотитровыванием части исследуемого раствора или, наоборот, с добавлением небольшого избытка титранта. Однако следует подчеркнуть, что если рТ индикатора лежит внутри скачка титрования, то индикаторная ошибка составляет не более 0,3% и, таким образом, существенно не влияет на результаты анализа.
Сопоставляя данные таблицы 1 и вид графика на рис. 15, можно сделать вывод, что при титровании соляной кислоты щёлочью (NаOH) в качестве индикатора можно использовать метиловый оранжевый (рТ≈4) или фенолфталеин (рТ≈9). В первом случае рТ индикатора будет иметь меньшее значение, чем рН в точке эквивалентности, и мы будет немного не дотитровывать кислоту. Во втором случае рТ индикатора лежит выше точки эквивалентности на скачке титрования. Вследствие этого мы добавим щелочи немного больше, чем нужно (другими словами, мы слегка перетитруем исследуемый раствор).
При титровании слабой кислоты (СН3СООН) сильным основанием (NаOH) точка эквивалентности смещается в щелочную область (рН>7) из-за гидролиза образующейся соли (СН3CООNa) и лежит выше линий нейтральности на кривой титрования с проходящим через рН = 7 и параллельной оси абсцисс (рис. 16). Скачок титрования становится менее выраженным. Например, при сравнении с предыдущим случаем (рис. 15) он уменьшается на 3 единицы рН. Уменьшение (сужение) скачка титрования выражено тем сильнее, чем более слабой является исследуемая кислота. Для кислот, имеющих значение (рКа>7), скачок титрования будет практически отсутствовать, т.е. он выродится в точку перегиба на кривой титрования. Такие кислоты нельзя количественно измерить в водном растворе с помощью титриметрии. Необходимо использовать в этом случае неводное титрование, т.е. в растворителе, который бы значительно усилил кислотные свойства слабой кислоты.
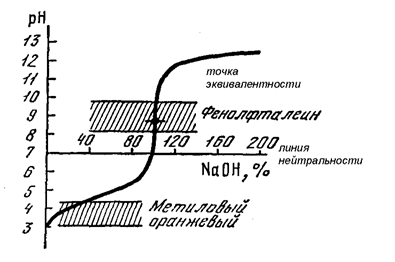
Рис. 16. Кривая титрования слабой кислоты (СН3СООН)
сильным основанием (NaOH)
Как видно из рис. 16, метиловый оранжевый нельзя использовать в качестве индикатора при титровании уксусной кислоты или любой другой слабой кислоты, т.к. его интервал перехода лежит ниже скачка титрования. В противном случае мы будем получать заниженные результаты вследствие недотитровывания исследуемого раствора.
А вот интервал перехода фенолфталеина лежит внутри скачка титрования, поэтому его можно применять в качестве индикатора при титровании слабой кислоты. Соответственно, для этих же целей можно использовать и другие индикаторы, интервал перехода которых и величина рТ лежат в области значений рН >7: тимолфталеин, ализариновый красный и т.д. (табл. 1).
При взаимодействии слабого основания с сильной кислотой наблюдаются такие же отличительные способности (по сравнению с реакцией нейтрализации между сильными электролитами), как и при титровании слабой кислоты щелочью. Так, вследствие гидролиза соли, образующейся в ходе реакции, точка эквивалентности тоже не совпадает с точкой нейтральности, но смещается в данном случае уже в кислую область (рН<7). Величина скачка титрования тоже становится заметно меньше (рис. 17) по сравнению с кривой титрования сильной кислоты щелочью (рис. 15).
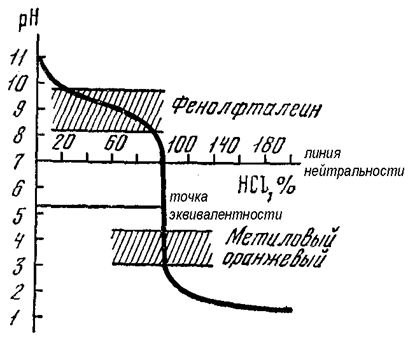
Рис. 17. Кривая титрования слабого основания (NН3 · Н2О)
сильной кислотой (HCl)
Причем, чем слабее выражены основные свойства у титруемого вещества, тем в меньшей степени проявляется скачок титрования. На рисунке 17 показана кривая титрования слабого основания NН3 · Н2О сильной кислотой НCl. Как следует из ее вида, для фиксирования точки эквивалентности в данном случае могут быть использованы только те индикаторы, интервал перехода которых смещен в кислую область значений рН: метиловый оранжевый, бромфеноловый синий, метиловый красный (табл. 1). Интервал перехода фенолфталеина, тимолфталеина и других индикаторов, рТ которых лежит при рН>7, не укладывается в скачок титрования и лежит за его пределами. При использовании данных индикаторов мы будем перетитровывать исследуемый раствор и получать завышенные результаты анализа.
При взаимодействии слабой кислоты и слабого основания изменение рН происходит постепенно на протяжении всего процесса титрования. Скачок титрования на соответствующей кривой практически отсутствует, вследствие чего точно определить момент эквивалентности и подобрать для данного случая соответствующий индикатор становится невозможным.
На основании данного заключения в кислотно-основном методе анализа в качестве рабочих растворов (титрантов) не используют растворы слабой кислоты либо слабого основания.
Кривые титрования многоосновных (полипротонных)
кислот, многокислотных оснований и их солей
Многоосновные кислоты и многокислотные основания в водных растворах диссоциируют ступенчато. Кривые титрования данных соединений могут иметь в соответствии с этим несколько (два и более) скачков титрования и точек эквивалентности. На рисунке 18 представлена кривая титрования трёхосновной фосфорной кислоты (H3PO4) щелочью (NaOH). Отчётливо видно наличие двух скачков титрования. Первый из них соответствует достижению первой точки эквивалентности, когда кислота оттитровывается по первой ступени
Н3PO4 + NaOH = NaH2PO4 + H2O
с образованием однозамещённого дигидрофосфата натрия.
Второй скачок титрования соответствует взаимодействию кислоты с NaOH по второй ступени с образованием двухзамещённого гидрофосфата натрия:
NaH2PO4 + NaOH = Na2HPO4 + H2O
Третий скачок титрования на графике, соответствующий реакции:
Na2HPO4 + NaOH = Na3PO4 + H2O,
отсутствует, т.к. константа диссоциации фосфорной кислоты на третьей стадии очень мала (≈10-13).
При необходимости можно оттитровать Н3PO4 по всем трём стадиям. Для этого в исследуемый раствор вводят CaCl2, в результате чего образуется малорастворимый Ca3(PO4)2
2H3PO4 + 3 CaCl2 = Ca3(PO4)2↓ + 6HCl,
а выделившееся эквивалентное количество соляной кислоты титруют обычным способом.
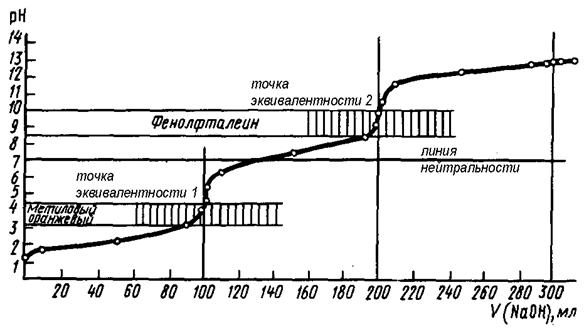
Рис. 18. Кривая титрования трехосновной фосфорной кислоты (H3PO4) сильным основанием (NaOH)
Как следует из рис. 18, каждой стадии нейтрализации фосфорной кислоты соответствует свой индикатор. Если мы будем использовать метиловый оранжевый, то оттитруем фосфорную кислоту только по первой стадии. При использовании фенолфталеина оттитруем фосфорную кислоту как двухосновную с образованием двухзамещенной соли. Соли слабых многоосновных кислот и щелочных металлов при взаимодействии с сильными кислотами ведут себя как слабые основания, и кривые титрования таких веществ тоже имеют несколько точек эквивалентности и скачков титрования (рис. 19) вследствие ступенчатого протекания реакции:
Na2CO3 + HCl = NaHCO3 + NaCl – точка эквивалентности 1
NaHCO3 + HCl = NaCl + CO2 + H2O – точка эквивалентности 2
Na2CO3 + 2 HCl = 2NaCl + CO2 + H2O
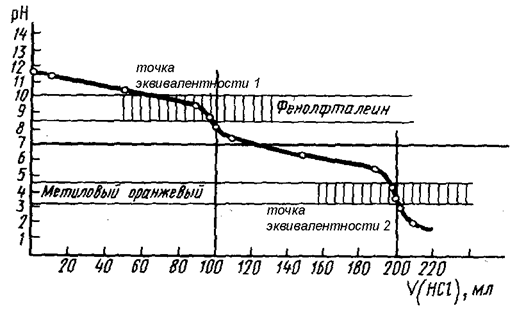
Рис. 19. Кривая титрования раствора Na2CO3 сильной кислотой (HCl)
В смеси сильных кислот можно установить только их общую суммарную концентрацию, раздельное определение компонентов невозможно. Кривая титрования такой смеси не отличается от кривой титрования одной сильной кислоты (рис. 15).
При титровании сильной кислоты в присутствии слабой наблюдаются два скачка титрования (рис. 20) и используются 2 индикатора, причём первой оттитровывается с использованием метилового оранжевого сильная кислота, и скачок титрования в данном случае невелик. Соответственно, и погрешность измерения может достигать нескольких процентов.
HCl + NaOH = NaCl + H2O – точка эквивалентности 1
CH3COOH + NaOH = CH3COONa + H2O – точка эквивалентности 2.
Зато скачок титрования, соответствующий нейтрализации слабой кислоты, является хорошо выраженным. При титровании в присутствии фенолфталеина можно точно определить суммарное содержание обеих кислот в смеси.
Титрование смеси нескольких слабых кислот практически не отличается от титрования многоосновной кислоты, подробно рассмотренной нами выше.
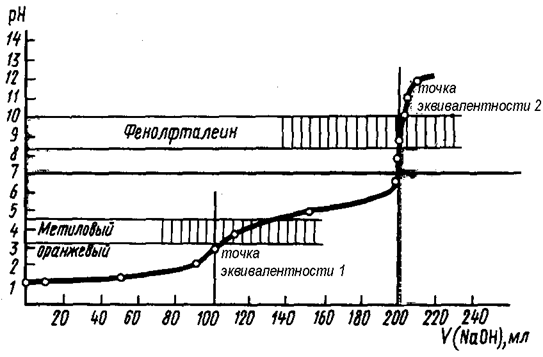
Рис. 20. Кривая титрования смеси кислот
(НСl и СН3СООН) раствором NaOH
Точное количественное определение более сильной кислоты в этой смеси возможно, если константы диссоциации присутствующих кислот различаются на четыре и более порядка.
|
|
|

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...
© cyberpedia.su 2017-2025 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!