Тезисы лекции:
Коллигативные свойства оказались справедливыми в полной мере только для растворов органических веществ в воде и для растворов в органических растворителях. При исследовании водных растворов солей, кислот, оснований было обнаружено, что изменение соответствующего свойства в зависимости от состава раствора значительно превышает ожидаемую величину. Кроме того, растворы, для которых характерны отклонения от законов разбавленных растворов, обладают значительной электропроводностью. Вещества, растворы или расплавы которых проводят электрический ток, называют электролитами. Процесс распада вещества при его растворении на ионы называют электролитической диссоциацией.
При растворении кислот, оснований и солей в воде происходит диссоциация этих веществ с образованием электрически заряженных частиц – катионов и анионов. Электролитическая проводимость растворов солей кислот и оснований в воде пропорциональна общей концентрации ионов в растворе. Растворенные вещества, почти полностью диссоциирующие на ионы, называют сильными электролитами. Кроме того различают средние и слабые электролиты. Сила электролита может быть охарактеризована с помощью степени диссоциации  .
.  показывает отношение числа молекул, продиссоциировавших на ионы, к общему числу растворенных молекул. Степень электролитической диссоциации зависит как от природы растворенного вещества, так и от концентрации раствора, увеличиваясь с его разбавлением. По значению
показывает отношение числа молекул, продиссоциировавших на ионы, к общему числу растворенных молекул. Степень электролитической диссоциации зависит как от природы растворенного вещества, так и от концентрации раствора, увеличиваясь с его разбавлением. По значению  для растворов молярной концентрации эквивалента 0,1 моль/л электролиты условно делят на три группы: сильные (
для растворов молярной концентрации эквивалента 0,1 моль/л электролиты условно делят на три группы: сильные (
 30%), средней силы (
30%), средней силы ( =3 – 30%) и слабые (
=3 – 30%) и слабые (
 3%).
3%).
С учетом электролитической диссоциации можно использовать законы разбавленных растворов и к растворам электролитов, вводя поправочный коэффициент i – изотонический коэффициент Вант-Гоффа. Изотонический коэффициент связан со степенью ионизации выражением  =
=  .
.
Более удобной характеристикой электролита является константа диссоциации, не зависящая от концентрации раствора. Закон разбавления Оствальда, связывающий Кд, с и  , выражается уравнением Кд=
, выражается уравнением Кд=  . При малых значениях
. При малых значениях  разность 1 -
разность 1 -  можно принять за единицу, тогда Кд = с
можно принять за единицу, тогда Кд = с  2 и
2 и  =
= 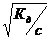 .
.
Вода является слабым электролитом. Константа диссоциации воды при 220С составляет 1.8·10-16. Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной общей концентрации воды, которая составляет 1000/18 = 55,55 моль/л. Тогда
[H+][OH¯ ]=K[H2O] = 1,8·10-16·55,55 = 1·10-14=Kw.
Для воды и ее растворов произведение концентраций ионов H+ и OH¯ - величина постоянная при данной температуре. Она называется ионным произведением воды Kw и при 220С составляет 1·10-14. Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов водорода, если известна концентрация гидроксильных ионов, и наоборот. Понятие кислая, нейтральная и щелочная среда приобретают количественный смысл. В случае, если [H+]=[OH¯ ], эти концентрации порознь равны 10-7моль/л и среда нейтральна. Если[H+]<10-7, то среда – щелочная, если [H+]>10-7, среда – кислая. Еще удобнее для характеристики среды пользоваться логарифмами концентрации ионов
H+ и OH¯, взятыми с обратными знаками. Эти величины называются соответственно водородным и гидроксильным показателями и обозначаются символами рН и рОН.
Направление обменной реакции между двумя электролитами в растворе определяется возможностью образования их ионами:
Малорастворимого соединения, выпадающего в виде осадка;
Малодиссоциированного соединения, иона или устойчивой комплексной частицы;
Газа.
Чем меньше растворимость образовавшегося малорастворимого соединения, тем сильнее равновесие смещается в сторону его образования. Гомогенные равновесия, которые устанавливаются при образовании малодиссоциированного соединения, значительно смещены вправо и тем в большей степени, чем меньше константа его диссоциации. В тех случаях, когда образующиеся малодиссоциированные соединения представляют собой газы, растворенные в воде или кране непрочные соединения, разлагающиеся с образованием газов, реакции протекают необратимо при условии, если образующиеся газы удаляют из сферы реакции. К процессам, идущим в сторону образования малодиссоциированных соединений, относятся также реакции нейтрализации. Они протекают необратимо только в случае нейтрализации сильных кислот сильными основаниями. Необратимость таких реакций обусловлена тем, что в образующихся системах единственным и весьма малодиссоциированным соединением является вода. Во всех других случаях реакций нейтрализации равновесия сильно смещены вправо, т.е. в сторону образования воды, но не до конца, так как вода в них не единственное малодиссоциированное вещество.
Гидролиз солей, или их обменное взаимодействие с водой, происходит лишь в тех случаях, когда ионы, образующиеся в результате электролитической диссоциации соли, - катион, анион или оба вместе – способны образовывать с ионами воды малодиссоциированные соединения. Гидролизу подвергаются соли, образованные: а) слабыми кислотами и сильными основаниями; б) слабыми основаниями и сильными кислотами и в) слабыми кислотами и слабыми основаниями.
Количественной характеристикой гидролиза солей могут служить константы равновесия. В выражении константы равновесия имеется концентрация воды, которая практически мало меняется при изменении концентрации соли, вследствие чего ее условно можно считать величиной постоянной.
Кравн·[H2O]= Кгидролиза. Константа гидролиза позволяет приближенно вычислить h – степень гидролиза соли, т.е. отношение числа молекул, подвергшихся гидролизу, к общему числу молекул соли, а также рН раствора.
Основная литература:1-6
Дополнительная литература:11-35
Планы практических занятий
Практические занятия как отдельная форма проведения занятий не предусмотрены.
Планы лабораторных заданий
Вопросник
1. Правила работы в лаборатории и организация рабочего места.
2. Химическая посуда и особенности работы с ней.
3. Техника выполнения отдельных операций: взятие вещества для проведения опыта; взвешивание; нагревание; растворение твердых веществ; осаждение; отделение осадка от раствора; промывание осадка; выпаривание растворов и высушивание осадков; прокаливание; сплавление; определение плотности жидкости; определение вида осадка и формы кристаллов.
4. Современные методы очистки веществ. Очистка веществ в различных агрегатных состояниях. Особенности очистки твердых веществ. Перекристаллизация, возгонка, перегонка и др.
5. Как в лабораторных условиях можно определить молярную массу эквивалента вещества?
6. Как практически определяются атомные и молекулярные массы веществ?
7. Как характеризовать состав комплексных соединений?
8. Соединения с комплексным анионом
9. Соединения с комплексным катионом
10. Как получать соединения, содержащие в молекуле комплексный катион и анион?
11. Комплексные соединения в реакциях обмена
12. Исследование прочности комплексных ионов. Разрушение комплексов.
13. Комплексные соединения в окислительно-восстановительных процессах
14. Каково влияние концентрации реагирующих веществ на скорость химической реакции в гомогенной системе?
15. Влияние температуры на скорость химической реакции в гомогенной системе
16. Влияние катализатора на скорость химической реакции
17. Влияние величины поверхности реагирующих веществ на скорость химической реакции в гетерогенной системе
18. Влияние изменения концентрации реагирующих веществ на равновесие химической реакции
19. Как отличать характер изменения энтальпии системы при экзо- и эндотермическом процессе?
20. Определение теплоты нейтрализации сильного основания сильной кислотой
21. Определение теплоты нейтрализации слабого основания слабой кислотой
22. Определение теплоты гидратации
23. Что такое калориметр, как он устроен?
24. Приготовление растворов различной концентрации
25. Определение растворимости различных солей
26. Приготовление пересыщенных растворов
27. Электропроводность растворов электролитов
28. Ионные процессы (реакции обмена)
29. Определение концентрации кислоты при помощи реакции нейтрализации
30. Сравнение химической активности кислот
31. Смещение равновесия диссоциации слабого электролита
32. Условия выпадения осадка
33. Дробное осаждение
34. Условие растворения осадков в результате химического взаимодействия
35. Влияние величины произведения растворимости электролита на его способность к химическому взаимодействию
36. Получение одних малорастворимых соединений из других
37. Индикаторы. Окраска индикаторов в кислой и щелочной среде.
38. Определение рН раствора при помощи индикаторов.
39. Инструментальное определение рН раствора.
40. Гидролиз солей.
41. Реакция среды в растворах различных солей
42. Образование основных и кислых солей при гидролизе
43. Совместный гидролиз двух солей
44. Атомы, молекулы простых веществ и элементарные ионы в качестве окислителей и восстановителей
45. Сложные ионы в окислительно-восстановительных процессах
46. Значение среды в окислительно-восстановительных процессах
47. Реакции, в которых окислитель или восстановитель расходуются также на связывание получающихся продуктов
48. Окислительно-восстановительная двойственность
49. Внутримолекулярные окислительно-восстановительные процессы.
50. Реакции диспропорционирования
51. Органические вещества в качестве восстановителей
52. Исследование активности металлов
53. Изготовление гальванического элемента
54. Электролиз водных растворов
Основная литература: 8
Дополнительная литература: 28-30
Методические рекомендации:
При выполнении лабораторных работ рекомендуется оформлять лабораторный журнал, в котором необходимо отразить последовательность выполнения того или иного опыта, зарисовать необходимую установку, при необходимости изложить предполагаемый результат эксперимента, произвести все предварительные расчеты и подробно изложить все наблюдения по проводимой работе. После выполнения всех опытов, относящихся к одной теме, полученные результаты рекомендуется оформить в виде научной статьи.
При подготовке к выполнению экспериментальных работ можно пользоваться как источниками, предложенными в списке основной и дополнительной литературы, так и любыми другими специальными практикумами и руководствами по экспериментальной неорганической химии.
2.5.Планы занятий в рамках самостоятельной работы студентов под руководством преподавателя.



 .
.  30%), средней силы (
30%), средней силы ( 3%).
3%). .
. . При малых значениях
. При малых значениях 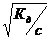 .
.

