Тезисы лекции:
До конца 19 века в науке господствовало убеждение, что атом есть наименьшая частица простого вещества, предел его делимости. Однако открытие таких явлений, как радиоактивности, явления электролиза, открытие катодных лучей и некоторых элементарных частиц, открытие рентгеновских лучей, свидетельствовали о сложности строения атомов.
С того момента, как было установлено, что атом является сложной системой, усилия ученых были направлены на установление внутренней структуры атома. Появились первые модели атома: Томсона, Нагаоки, Павлова, Чичерина. Опыты Резерфорда (1911), а позднее Чэдвика (1920) по рассеянию α-частиц привели к планетарной модели атома: в центре сосредоточено положительно заряженное ядро очень малого размера, но большой массы, а вокруг вращаются отрицательно заряженные частицы (электроны). Недостатки планетарной модели привели к появлению модели Бора (1913).
Бор увязал законы классической механики с квантовой теорией, созданной в начале 20 века (Планк, Эйнштейн). По Бору, электрон в атоме водорода может находиться лишь на определенных энергетически дозволенных орбитах, радиусы которых относятся друг к другу как квадраты натурального ряда чисел. При возбуждении атома электрон переходит на одну из более удаленных орбит и запас энергии его возрастает. При возвращении на первоначальную орбиту, электрон порождает квант электромагнитного излучения, отвечающего той или иной линии спектра. Так Бор объяснил происхождение спектров, увязав их со строением атома.
В основе современного учения о строении атома лежат представления квантовой механики о двойственной корпускулярно-волновой природе микрочастиц. Электрону, как любому микрообъекту, присуща двойственная корпускулярно-волновая природа. Таким образом, в законах движения электрона проявляется неразрывность двух качественно различных форм существования материи: вещества и поля.
Развитие представлений волновой механики показало несостоятельность положения о движении электрона вокруг ядра по определенным орбитам, подобно движению планет вокруг Солнца. В действительности электрон, обладая свойствами волны, движется по всему атомному объему, образуя электронное облако, которое для разных электронов может иметь различную форму. При этом плотность электронного облака в той или иной части атомного объема неодинакова. Отсюда следует, что точное одновременное определение скорости и местонахождения электрона невозможно. Это положение квантовой механики носит название принципа неопределенности Гейзенберга.
Электрон обладает волновыми свойствами - это значит, что его движение в атоме можно описать волновым уравнением. Такое уравнение было предложено в 1926 году австрийским ученым Шредингером и носит его имя:
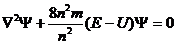
Входящую в это уравнение величину  называют волновой функцией. Функция
называют волновой функцией. Функция  определенного физического смысла не несет и является аналогом амплитуды так называемой электронной волны, т.е. амплитудой вероятности пребывания электрона в данной точке пространства. А квадрат волновой функции характеризует вероятность нахождения электрона в некоторой точке внутриатомного пространства. Определяя значение функции
определенного физического смысла не несет и является аналогом амплитуды так называемой электронной волны, т.е. амплитудой вероятности пребывания электрона в данной точке пространства. А квадрат волновой функции характеризует вероятность нахождения электрона в некоторой точке внутриатомного пространства. Определяя значение функции  , удовлетворяющее уравнение Шредингера, мы находим то околоядерное пространство, в котором с наибольшей вероятностью пребывает электрон. Это околоядерное пространство мы называем атомной орбиталью АО.
, удовлетворяющее уравнение Шредингера, мы находим то околоядерное пространство, в котором с наибольшей вероятностью пребывает электрон. Это околоядерное пространство мы называем атомной орбиталью АО.
Состояние электрона в атоме описывается четырьмя параметрами, которые называются квантовыми числами. Главное квантовое число (n) характеризует энергию электрона или энергетический уровень, на котором он находится. Оно определяет размеры атомной орбитали и может принимать значения от 1 до  . Орбитальное квантовое число (l), характеризует различное электрическое состояние электронов в данном квантовом слое. Это квантовое число характеризует угловой момент количества движения электронов, зависит от главного квантового числа и принимает значения от 0 до n-1. Магнитное квантовое число
. Орбитальное квантовое число (l), характеризует различное электрическое состояние электронов в данном квантовом слое. Это квантовое число характеризует угловой момент количества движения электронов, зависит от главного квантового числа и принимает значения от 0 до n-1. Магнитное квантовое число 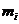 связано с магнитным моментом электрона и характеризует пространственную направленность АО относительно избранного направления или относительно направления магнитного поля. И, наконец, состояние электрона описывается спиновым квантовым числом s, характеризующим собственный магнитный момент электрона, обусловленный движением электрона вокруг собственной оси.
связано с магнитным моментом электрона и характеризует пространственную направленность АО относительно избранного направления или относительно направления магнитного поля. И, наконец, состояние электрона описывается спиновым квантовым числом s, характеризующим собственный магнитный момент электрона, обусловленный движением электрона вокруг собственной оси.
Распределение электронов в атомах элементов определяется тремя основными положениями: принципом Паули, правилом Хунда, принципом наименьшей энергии. В соответствии с принципом Паули в атоме не может быть двух электронов с одинаковым набором всех квантовых чисел. И как следствие этого принципа: на каждой АО может находиться только два электрона с противоположными спинами, а максимальное число электронов соответствует количеству 2n2.
Последовательность размещения электронов по АО в невозбужденном атоме должна отвечать наибольшей связи их с ядром, т.е. электрон должен обладать наименьшей энергией. При этом, как установил Клечковский, энергетически выгодному отвечает состояние с меньшей суммой главного и орбитального квантовых чисел. В то же время, если для двух подуровней суммы значений n+l равны, то энергетически выгодному отвечает состояние с меньшим значением главного квантового числа.
При распределении электронов по вырожденным орбиталям выполняется правило Хунда, т.е. заполнение осуществляется таким образом, чтобы суммарное спиновое число электронов было максимальным.
На основании этих положений можно представить распределение электронов по квантовым слоям и АО в атомах любых элементов. Написать электронную формулу атома элемента – это значит распределить все электроны по соответствующим уровням и подуровням в соответствии с указанными выше положениями. Так, для атома кобальта с порядковым номером 27, электронная формула выглядит следующим образом:
1s22s22p63s23p64s23d7.
Основная литература: 1-9
Дополнительная литература: 11, 12, 14, 16, 17
Тема лекции:
Химическая связь
Тезисы лекции:
Атомы в определенном качественном и количественном отношении объединяются в молекулы благодаря возникновению между ними химических связей. Химические связи между атомами различных элементов отличаются по своей природе: способу образования, энергии, длине и т.д. Исторически связи делятся на следующие типы: ковалентные, ионные и металлические.
Ковалентная связь может быть образована как обменным механизмом, т.е. за счет перекрывания электронных облаков двух связывающихся атомов, так и донорно-акцепторным механизмом, когда ковалентную связь образуют атом-донор, представляющий пару электронов и атом-акцептор, обладающий вакантной орбиталью.
Самым главным при образовании ковалентной связи по любому механизму является возникновение общей пары электронов для двух рассматриваемых атомов. Различают полярную и неполярную ковалентную связь. Неполярной ковалентная связь получается в том случае, когда связывающиеся между собой атомы имеют одну и ту же электроотрицательность (Н2, О2 и т.д.)
При образовании полярной ковалентной связи, в результате смещения общей пары электронов к более электроотрицательному, на одном из атомов сосредоточивается избыточный положительный, на другом – избыточный отрицательный заряды. Так возникает диполь. Мерой полярности молекулы –диполя является дипольный момент. Зная дипольный момент молекулы, можно судить о ее геометрической структуре.
Чем больше смещение связывающей электронной пары к одному из атомов, тем ближе связь к ионной. Чисто ионной связи не бывает, поскольку это пример научной абстракции, поэтому об этом виде связи можно говорить как о предельном случае полярной ковалентной связи. В отличие от ковалентной связи ионная связь является ненаправленной и ненасыщаемой.
Кроме перечисленных типов связи существует еще водородная связь. Атом водорода в соединениях с сильно электроотрицательными элементами приобретает значительный –избыточный положительный заряд и становится способным образовывать дополнительную связь с другими атомами электроотрицательных элементов. Наличие водородной связи приводит к образованию полимеров-ассоциатов типа (Н2О)n, (НF)n и повышению температуры плавления и кипения веществ.
Исходя из современных корпускулярно-волновых представлений о природе электрона, квантово-механическое описание ковалентной связи предусматривает использование методов валентных связей (МВС) и молекулярных орбиталей (ММО).
Метод валентных связей основывается на положениях: ковалентная связь образуется двумя неспаренными электронами с противоположными спинами по обменному или донорно-акцепторному механизму; прочность и направление ковалентной связи определяется областью перекрывания обобществленных электронов.
К характерным особенностям ковалентной связи относятся насыщаемость, направленность и поляризуемость. Определенная последовательность связей атомов в молекулах и их направленность в пространстве определяют геометрию молекулы. В свою очередь направленность связей в пространстве может быть объяснена понятием о гибридизации АО центрального атома. Гибридизация - выравнивание АО по форме и по энергии – осуществляется в соответствии с правилами:1) гибридизации подвергаются АО, близкие по энергии; 2) в гибридизации может принимать участие АО, несущая валентную электронную пару (например 2s2-орбиталь кислорода в молекуле воды); 3) склонность к гибридизации в рядах сходных по свойствам элементов падает с увеличением радиусов атомов.
По ММО при образовании молекул из атомов, исходные атомные орбитали преобразуются в молекулярные орбитали (МО). В результате молекулу можно рассматривать как многоцентровой атом, в котором каждый электрон движется по МО в поле остальных электронов и всех ядер. Каждой молекулярной орбитали соответствует определенный набор молекулярных квантовых чисел. Последовательное заполнение молекулярных орбиталей электронам подчиняется принципу наименьшей энергии, принципу Паули и правилу Хунда.
Из исходных n АО всегда образуется n МО. При сложении (перекрывании) АО согласно ЛКАО образуются связывающие МО со сравнительно низким значением энергии, при вычитании (отталкивании) АО – разрыхляющие МО с более высоким уровнем энергии, чем у исходных АО. Образование МО из АО изображают в виде энергетической диаграммы, где по вертикали откладывают значения энергии Е орбиталей:
В атомах элементов от лития до азота имеет место энергетическая близость 2s- и 2p-орбиталей, поэтому электроны на МО  и
и 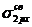 взаимно отталкиваются. В результате МО
взаимно отталкиваются. В результате МО 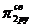 и
и 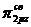 становятся энергетически более выгодными, чем
становятся энергетически более выгодными, чем 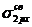 -орбиталь.
-орбиталь.
В ММО кратность связи или порядок связи определяется как полуразность между числом связывающих и разрыхляющих электронов на МО. Чем выше значение ПС, тем больше прочность связи, тем меньше длина связи. При ПС, равном нулю, молекула становится неустойчивой и ее существование невозможно.
В случае применения ММО к рассмотрению многоатомных молекул, на энергетических диаграммах помимо образования МО из АО необходимо показать предварительную гибридизацию исходных АО центрального атома.
Основная литература: 1-6,9,10
Дополнительная литература: 11-19
Тема лекции:
Комплексные соединения
Тезисы лекции:
К концу 19в. накоплен большой материал по особой группе соединений, состав которых не находил объяснений с позиций классической теории валентности. В 1893г. Альфред Вернер предлагает координационную теорию, объясняющую устройство таких соединений, которые он называет комплексными.
Комплексные соединения – наиболее устойчивые соединения высшего порядка, которые в водном растворе либо вообще не распадаются на свои составные части, либо распадаются в самой незначительной степени.
В соответствии с теорией Вернера в каждом комплексном соединении различают внутреннюю и внешнюю сферу. В химических реакциях, в процессах растворения, в структуре кристалла, внутренняя сфера или собственно комплекс, выступает как самостоятельная единица. Центральный элемент внутренней сферы комплекса, вокруг которого группируются ионы или молекулы, называют комплексообразователем или центральным атомом (ц.а.). В качестве таковых чаще всего выступают атомы переходных металлов. Ионы или молекулы, координирующиеся возле ц.а. во внутренней сфере называются лигандами.
Число мест во внутренней сфере комплекса, которое может быть занято лигандами, называют координационным числом или координационной валентностью.Координационное число (к.ч.) зависит от центрального атома: чем больше радиус комплексообразователя, тем выше к.ч., чем больше степень окисления ц.а., тем выше к.ч.
Классифицировать комплексные соединения можно по разным признакам. Так, по количеству мест, занимаемых лигандом, различают монодентатные и бидентатные комплексы. По принадлежности к определенному классу соединений выделяют комплексные кислоты, комплексные основания и комплексные соли. По характеру заряда внутренней сферы комплексные соединения подразделяют на катионные, анионные и нейтральные. По характеру лигандов выделяют аквакомплексы, аммиакаты, ацидокомплексы, гидроксокомплексы, аминаты и т.д. Кроме того, существуют бикомплексы (соли с комплексными катионом и анионом), сверхкомплексы (в которых количество лигандов больше, чем координационная валентность). По количеству комплексообразователей различают моноядерные и полиядерные соединения. Наличие циклов во внутренней сфере позволяет выделять циклические комплексы, которые обычно называют хелатами.
Для комплексных соединений характерны различные виды изомерии. Ионизационной метамерией называют существование веществ с одинаковым составом, в водном растворе, диссоциирующих на различные ионы. Солевые изомеры содержат в качестве лигандов неорганические изомеры. Различное распределение лигандов в бикомплексах приводит к координационной изомерии. Характер пространственного расположения лигандов относительно центрального атома обусловливает геометрическую цис-, транс- и оптическую изомерию.
Природу химической связи в комплексных соединениях пытались объяснить многие ученые. Так, Коссель и Магнус в электростатической теории предполагали наличие ионной связи между центральным атомом и лигандами. Но эта теория не объясняет существования комплексов с неполярными лигандами и центральным атомом в нулевой степени окисления (например, карбонилы). К недостаткам этой теории можно отнести и отсутствие объяснений магнитных и оптических свойств комплексных соединений.
Метод валентных связей развивает идеи о парноэлектронной связи в координационных соединениях. С точки зрения МВС связь между ц.а. и лигандом – донорно-акцепторная. Лиганд является донором электронной пары, а комплексообразователь предоставляет свободную орбиталь. Чем больше перекрывание между ц.а. и лигандом, тем прочнее связь. Орбитали центрального атома подвергаются гибридизации, причем тип гибридизации определяется числом, природой и электронной структурой лиганда. Гибридизация определяет пространственную структуру комплекса. Дополнительное упрочение комплекса, в соответствии с МВС, обусловлено тем, что наряду с 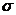 -связью может возникать дополнительное
-связью может возникать дополнительное  -связывание. Магнитные свойства теория МВС объясняет исходя из заселенности орбиталей. Но, как и предыдущая теория, МВС не объясняет оптических свойств комплексных соединений, так как не учитывает возбужденного состояния, кроме того, не дает оценку энергий для различных структур комплексов.
-связывание. Магнитные свойства теория МВС объясняет исходя из заселенности орбиталей. Но, как и предыдущая теория, МВС не объясняет оптических свойств комплексных соединений, так как не учитывает возбужденного состояния, кроме того, не дает оценку энергий для различных структур комплексов.
Теория кристаллического поля (ТКП) основана на электростатической модели. Связь между ц.а. и лигандом – ионная, причем ц.а. рассматривается детально, а лиганд – как бесструктурная заряженная точка, создающая электростатическое поле. Основное внимание ТКП уделяет тем изменениям, которые происходят в центральном атоме под действием лигандов. В поле лигандов снимается вырождение d-орбитали центрального атома (чаще всего переходного металла), так как различны формы этих орбиталей и их расположение в пространстве. В октаэдрическом поле лигандов пятикратно вырожденная d-орбиталь расщепляется и, энергетически наиболее выгодными, становятся d 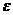 орбитали, а d
орбитали, а d  орбитали – менее выгодными. Энергия расщепления зависит от силы лиганда. В тетраэдрическом или квадратном поле лигандов, картина расщепления совсем другая.. Заполнение электронами по-разному расщепленных орбиталей приводит к существованию высокоспиновых и низкоспиновых комплексных соединений. К недостаткам этой теории относят то, что она не учитывает определенной доли ковалентности в связи между ц.а. и лигандом, кроме того, она не объясняет существования комплексов, в которых лигандами выступают нейтральные молекулы. Последний недостаток разрешается в теории поля лигандов.
орбитали – менее выгодными. Энергия расщепления зависит от силы лиганда. В тетраэдрическом или квадратном поле лигандов, картина расщепления совсем другая.. Заполнение электронами по-разному расщепленных орбиталей приводит к существованию высокоспиновых и низкоспиновых комплексных соединений. К недостаткам этой теории относят то, что она не учитывает определенной доли ковалентности в связи между ц.а. и лигандом, кроме того, она не объясняет существования комплексов, в которых лигандами выступают нейтральные молекулы. Последний недостаток разрешается в теории поля лигандов.
ММО в применении к комплексным соединениям детально учитывает электронную структуру не только комплексообразователя, но и лигандов. Валентные электронные системы располагаются на многоцентровых МО, охватывающих ядра ц.а. и всех лигандов, входящих в состав комплекса. Для построения МО используются АО комплексообразователя и лиганда, удовлетворяющие ряду требований. Образование связывающих молекулярных орбиталей (СМО) происходит в результате максимального перекрывания электронных облаков, дающего выигрыш в энергии. Разрыхляющая МО образуется в результате отрицательного перекрывания. Если АО центрального атома не перекрывается или почти не перекрывается с АО лиганда, энергия их не меняется и АО превращается в МО с той же энергией и получается несвязывающая молекулярная орбиталь (НМО).
Основная литература: 1-7, 9-10
Дополнительная литература: 12,13, 19-24.
Тема лекции:



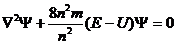
 называют волновой функцией. Функция
называют волновой функцией. Функция  . Орбитальное квантовое число (l), характеризует различное электрическое состояние электронов в данном квантовом слое. Это квантовое число характеризует угловой момент количества движения электронов, зависит от главного квантового числа и принимает значения от 0 до n-1. Магнитное квантовое число
. Орбитальное квантовое число (l), характеризует различное электрическое состояние электронов в данном квантовом слое. Это квантовое число характеризует угловой момент количества движения электронов, зависит от главного квантового числа и принимает значения от 0 до n-1. Магнитное квантовое число 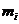 связано с магнитным моментом электрона и характеризует пространственную направленность АО относительно избранного направления или относительно направления магнитного поля. И, наконец, состояние электрона описывается спиновым квантовым числом s, характеризующим собственный магнитный момент электрона, обусловленный движением электрона вокруг собственной оси.
связано с магнитным моментом электрона и характеризует пространственную направленность АО относительно избранного направления или относительно направления магнитного поля. И, наконец, состояние электрона описывается спиновым квантовым числом s, характеризующим собственный магнитный момент электрона, обусловленный движением электрона вокруг собственной оси. и
и 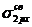 взаимно отталкиваются. В результате МО
взаимно отталкиваются. В результате МО 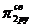 и
и 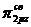 становятся энергетически более выгодными, чем
становятся энергетически более выгодными, чем 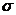 -связью может возникать дополнительное
-связью может возникать дополнительное  -связывание. Магнитные свойства теория МВС объясняет исходя из заселенности орбиталей. Но, как и предыдущая теория, МВС не объясняет оптических свойств комплексных соединений, так как не учитывает возбужденного состояния, кроме того, не дает оценку энергий для различных структур комплексов.
-связывание. Магнитные свойства теория МВС объясняет исходя из заселенности орбиталей. Но, как и предыдущая теория, МВС не объясняет оптических свойств комплексных соединений, так как не учитывает возбужденного состояния, кроме того, не дает оценку энергий для различных структур комплексов.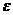 орбитали, а d
орбитали, а d  орбитали – менее выгодными. Энергия расщепления зависит от силы лиганда. В тетраэдрическом или квадратном поле лигандов, картина расщепления совсем другая.. Заполнение электронами по-разному расщепленных орбиталей приводит к существованию высокоспиновых и низкоспиновых комплексных соединений. К недостаткам этой теории относят то, что она не учитывает определенной доли ковалентности в связи между ц.а. и лигандом, кроме того, она не объясняет существования комплексов, в которых лигандами выступают нейтральные молекулы. Последний недостаток разрешается в теории поля лигандов.
орбитали – менее выгодными. Энергия расщепления зависит от силы лиганда. В тетраэдрическом или квадратном поле лигандов, картина расщепления совсем другая.. Заполнение электронами по-разному расщепленных орбиталей приводит к существованию высокоспиновых и низкоспиновых комплексных соединений. К недостаткам этой теории относят то, что она не учитывает определенной доли ковалентности в связи между ц.а. и лигандом, кроме того, она не объясняет существования комплексов, в которых лигандами выступают нейтральные молекулы. Последний недостаток разрешается в теории поля лигандов.


