

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...
Топ:
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Дисциплины:
|
из
5.00
|
Заказать работу |
Анализ и классификация катионов
Для определения катионов разработаны и применяются на практике такие классификации, как: сероводородная (сульфидная); кислотно-основная; гидроксидно-пероксидная; фосфатно-аммиачная и др. Под аналитической классификацией катионов понимают выделение в осадок небольших групп ионов из смеси путем последовательного воздействия системы групповых реагентов.
В основе любой классификации лежит принцип сходства химических свойств элементов: способность ряда ионов образовывать малорастворимые соединения (осадки). В качестве реагентов подбираются вещества, которые в минимальной степени в дальнейшем будут влиять на ход определения, либо легко могут быть удалены. В первую очередь это кислоты, гидроксиды и соли аммония.
Сероводородная классификация одна из самых простых по структуре (таблица 2.1), однако ее применение в настоящее время ограничено из-за использования высокотоксичного сероводорода. Другие методы анализа были разработаны с целью замены токсичных реагентов на более безопасные и состоят обычно из 5 или 6 групп катионов.
В реальной практике анализ выполняется на основе комплексного подхода: выбирают те реактивы, реагенты и схемы его проведения, которые позволяют достичь желаемого результата наиболее экономным путем.
Согласно сероводородной классификации, как видно из таблицы 2.1, все катионы разбиты на 5 аналитических групп, осаждение которых выполняется с помощью системы групповых реагентов в следующей последовательности:
Группа: V IV III II I
реагент:  ®
®  ®
®  ®
®  ® нет
® нет
рН: 


 .
.
Определение начинают с выделения и отделения 5-й группы катионов, образующих нерастворимые в воде и кислотах хлориды. Затем в среде  (рН=
(рН=  ) проводят осаждение 4-й группы катионов в виде сульфидов, устойчивых как в кислой, так и в нейтральной среде. Для последующих с помощью аммиачного буфера изменяют кислотность среды на щелочную и последовательно выделяют в осадок 3-ю и 2-ю группы катионов в виде соответствующих сульфидов, гидроксидов и карбонатов.
) проводят осаждение 4-й группы катионов в виде сульфидов, устойчивых как в кислой, так и в нейтральной среде. Для последующих с помощью аммиачного буфера изменяют кислотность среды на щелочную и последовательно выделяют в осадок 3-ю и 2-ю группы катионов в виде соответствующих сульфидов, гидроксидов и карбонатов.
Таким образом, врастворе после воздействия системы групповых реагентов остаются только катионы 1-й аналитической группы, которая не осаждается полностью ни одним из реагентов.
Дальнейшая идентификация катионов в группах основана на различие их растворимости, что позволяет разделить группы на подгруппы. Так в 4-й группе катионов выделяют подгруппу меди и подгруппу мышьяка; в 3-й группе – это подгруппы цинка и алюминия. Определение индивидуальных катионов внутри групп и подгрупп выполняют комбинацией дробного и систематического метода.
 Таблица 2.1 – Сероводородная классификация катионов
Таблица 2.1 – Сероводородная классификация катионов
| Аналити-ческая группа | Катионы | Условия осаждения | Групповой реагент | Соединения, образующие осадок | Характеристика группы |
| первая | 1) подгруппа аммония:  , ,  , , 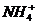 .
2) подгруппа магния: .
2) подгруппа магния:  и др. и др.
| - | нет | - | Сульфиды и карбонаты растворимы в воде, карбонат магния растворим в растворах солей аммония |
| вторая |  , ,  , , 

| 

| 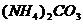
| 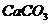 , ,  , , 
| Сульфиды растворимы, а карбонаты нерастворимы в воде |
| третья | 1) подгруппа алюминия: 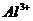 , ,  .
2) подгруппа цинка: .
2) подгруппа цинка:  , ,  , ,  , ,  , , 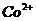 , ,  и др. и др.
|  буфер
буфер

| 
|  , ,  , ,  , , 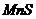 , ,  , ,  , ,  , , 
| Сульфиды (или гидроксиды) нерастворимы в воде и растворимы в разбавленных минеральных кислотах |
| четвёртая | 1) подгруппа меди:   , , 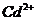 , ,  , ,  и др.
2) подгруппа мышьяка: и др.
2) подгруппа мышьяка:  , ,  , ,  , ,  , ,  , ,  и др. и др.
| 
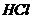
| H2S |  , ,  , , 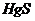 , ,  , ,  , ,  , ,  , , 
| Сульфиды нерастворимы в разбавленных кислотах, сульфиды  подгруппы растворимы в подгруппы растворимы в  с образованием аммиакатов, сульфиды с образованием аммиакатов, сульфиды  подгруппы растворимы в полисуль-фидах с образованием тио-солей подгруппы растворимы в полисуль-фидах с образованием тио-солей
|
| пятая |  , , 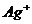 , , 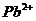 , ,  , , 
| 
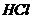
| 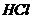
|  , ,  , , 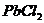 , , 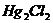
| Хлориды и сульфиды нерастворимы в воде и разбавленных минеральных кислотах |
ЛАБОРАТОРНАЯ РАБОТА 3 - 5
Теоретическая часть
Обнаружение ионов с помощью специфических и высокоселективных реакций в отдельных порциях анализируемого раствора, без предварительного разделения компонентов, называют дробным методом анализа. Недостатком этого метода является низкая чувствительность. Если используемые реакции не достаточно селективны, а мешающее действие других ионов устранить не удаётся, то в этом случае применяют систематический ход анализа.
Систематический метод – это определённая последовательность реакций, целью которой является выделение только одного определяемого иона. Для этого сначала на раствор со смесью ионов действуют групповыми реагентами, выделяя в осадок сходные по свойствам ионы. Осадок отделяют от раствора, растворяют подходящим растворителем и вновь делят на более мелкие группы, используя различие в растворимости уже других соединений выделенных ионов. Далее операции осаждения, отделения и растворения осадков продолжают до тех пор, пока либо в растворе, либо в осадке не останется только один ион, который идентифицируют любой характерной реакцией.
Несмотря на высокую чувствительность, такой подход мало продуктивен, поэтому на практике используют комбинацию обоих методов – дробного и систематического, причём дробный метод применяют преимущественно для определения ионов внутри групп и подгрупп. Таким образом, систематический анализ не следует противопоставлять дробному, так как эти методы на практике взаимно дополняют друг друга.
Для проведения систематического анализа катионов существует несколько общепринятых схем (классификаций). Наиболее тесно связанной с периодическими свойствами элементов является сероводородная классификация (табл. 2.1), в несколько изменённом виде называемая также сульфидной. По этой классификации катионы разделяют на пять аналитических групп, при этом анализ начинают проводить с 5-й группы.
Не смотря на то, что ион аммония относится к первой аналитической группе, он всегда определяется до начала систематического анализа и в случае обнаружения удаляется. Эта необходимость вызвана тем, что соединения аммония обладают высокой летучестью, то есть ионы аммония могут быть потеряны в ходе анализа. Так же эти ионы способны образовывать со многими катионами устойчивые комплексные соединения – аммиакаты, и тем самым мешать их определению. Кроме того, он входит в состав ряда групповых реагентов и в аммиачный буфер, и будет всегда присутствовать в конечном растворе вне зависимости от его наличия в испытуемом образце.
Для проведения систематического анализа анионов чаще всего применяют схему, основанную на растворимости солей бария и серебра (табл. 3.1). В отличие от катионов, большинство анионов редко мешают обнаружению друг друга. Обычно определение начинают с 1-й аналитической группы (добавлением  ), так как некоторые бескислородные анионы могут давать осадки с ионами серебра, мешая тем самым идентификации анионов 2-й группы.
), так как некоторые бескислородные анионы могут давать осадки с ионами серебра, мешая тем самым идентификации анионов 2-й группы.
После отделения осадка с анионами 1-й группы, анализ раствора можно вести дробным методом в произвольной последовательности, так как 3-я группа практически не мешает определению анионов 2-й группы (за исключением некоторых качественных реакций ОВР).
Приборы и реактивы
Штатив с пробирками, держатель пробирок, фильтровальная бумага, нихромовая проволока, индикаторная бумага, газовая горелка.
Сухие соли:  ,
, 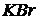 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 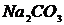 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 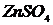 ,
,  ,
,  ,
, 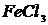 .
.
Жидкие реактивы: 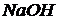 (
( и
и  ),
), 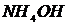 ,
, 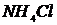 ,
,  ,
,  ,
, 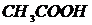 ,
, 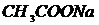 ,
,  ,
,  ,
,  ,
,  ,
,  ,
, 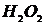 ,
,  ,
,  ,
,  ,
,  ,
,  ,
,  (или
(или 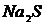 ),
),  (или
(или 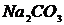 ), раствор дитизона в
), раствор дитизона в  , ализарин (1,2-диоксиантрахинон), реактивы Неслера (смесь
, ализарин (1,2-диоксиантрахинон), реактивы Неслера (смесь  с
с 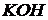 ), Ильинского (1-нитрозо-2-нафтол), Чугаева (диметилглиоксим).
), Ильинского (1-нитрозо-2-нафтол), Чугаева (диметилглиоксим).
Порошкообразные реактивы: металлический  (или
(или  ),
),  (или
(или  ),
),  ,
,  .
.
4 Указания по технике безопасности
Смотрите на стр. 7 (лабораторная работа 1).
Лабораторная работа № 3
Предварительные испытания
Цель работы: Выполнив предварительные испытания, определить предполагаемый состав неизвестных солей.
1 Методика и порядок выполнения работы
1.1. Получить в пробирку у лаборанта пробу соли неизвестного состава, причемсначала выполняют полный анализ и определяют состав 1-й соли. После проверки результатов, получить 2-ю соль и выполнить ее анализ по той же схеме, что и первой.
1.2. Провести пирохимическую реакцию с кристалликом соли на наличие пирохимически активных катионов.
1.3. Определить цвет сухих солей, а затем растворить пробу в небольшом количестве воды (примерно 
 объема пробирки), затем. довести полученный раствор до полного объема и перемешать. Указать цвет раствора и сделать вывод о том, ионы каких аналитических групп могут присутствовать или отсутствовать в пробе. Если проба не содержит соль белого цвета, то сделать вывод об отсутствии катионов
объема пробирки), затем. довести полученный раствор до полного объема и перемешать. Указать цвет раствора и сделать вывод о том, ионы каких аналитических групп могут присутствовать или отсутствовать в пробе. Если проба не содержит соль белого цвета, то сделать вывод об отсутствии катионов 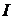 и
и  групп (не выполняются п. 2.6–2.8); отдельных ионов (указать их)
групп (не выполняются п. 2.6–2.8); отдельных ионов (указать их)  -й и
-й и  -й групп.
-й групп.
1.4. Используя универсальный индикатор, определить кислотность ( ) раствора и сделать вывод о наличии гидролиза соли и его типе или о его отсутствии. Сделать вывод: растворы катионов и анионов каких групп могут дать такое значение рН. Указать в отчете эти катионы, анионы или же целиком группы ионов.
) раствора и сделать вывод о наличии гидролиза соли и его типе или о его отсутствии. Сделать вывод: растворы катионов и анионов каких групп могут дать такое значение рН. Указать в отчете эти катионы, анионы или же целиком группы ионов.
Запись данных опыта. Данные опыта занести в таблицу 3.1.
Внимание! Для каждой соли делаются отдельно все 3 таблицы испытаний (предварительные испытания; анализ катионов; анализ анионов), причем каждая таблица занимает целиком разворот отчета.
Таблица 3.1 – Предварительные испытания
| № испы-тания | Определяемый ион или свойство | Реагент, условия проведения реакций | Наблюдения (аналитические признаки реакций) | Выводы; уравнения реакций |
| СОЛЬ № 1 | ||||
 , ,  , , 
| Пирохимическая реакция | |||
| Цвет солей и раствора | - | |||
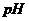
| индикаторная бумага | |||
| Вывод: | ||||
| СОЛЬ № 2 | ||||
| Вывод: |
2 Содержание отчета и его форма
Каждый студент должен иметь лабораторный журнал, который является документом, отражающим всю его работу.
Все наблюдения и выводы по экспериментальной работе, проделанной в лаборатории, студент заносит в лабораторный журнал непосредственно после ее выполнения.
Рекомендуется следующая схема записи:
1. Дата.
2. Номер и название лабораторной работы.
3. Цель работы.
4. Название и описание хода опытов.
5. Наблюдения.
6. Уравнения химических реакций.
7. Выводы и расчеты (формулы, таблицы, графики).
Лабораторная работа № 4
Вопросы для защиты работ № 3-5
1. Дробный и систематический анализ: сущность этих методов и их взаимосвязь, достоинства и недостатки.
2. Групповой реагент. Требования к реактивам, применяемым в качестве групповых реагентов.
3. Почему в ходе систематического анализа ионы аммония необходимо обнаруживать в первую очередь? Как можно их определить и удалить?
4. На что указывает кислая, щелочная или нейтральная среда растворов солей? Какие предварительные заключения можно сделать на этой основе?
5. Составить схему разделения следующих катионов согласно сероводородной классификации, указывая аналитические группы, групповые реагенты и условия их обнаружения, формы осадков:
1)  ; 6)
; 6)  ; 11)
; 11)  ;
;
2)  ; 7)
; 7)  ; 12)
; 12) 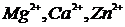 ;
;
3) 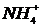 ,
,  ; 8)
; 8)  ; 13)
; 13)  ;
;
4)  ; 9)
; 9)  ; 14)
; 14)  ;
;
5)  ; 10)
; 10)  ; 15)
; 15)  .
.
6. Напишите качественные реакции обнаружения следующих ионов, указав реагент, аналитический признак и условия проведения:
1)  ; 7)
; 7)  ;
;
2)  ; 8)
; 8)  ;
;
3)  ; 9)
; 9)  ;
;
4)  ; 10)
; 10) 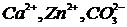 ;
;
5) 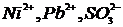 ; 11)
; 11)  ;
;
6)  ; 12)
; 12)  .
.
7. Почему анализ катионов начинают с 5-й группы, а анионов – с 1-й?
8. Катионы каких групп и почему легко определять дробным способом?
9. Какой фактор лежит в основе деления групп катионов на подгруппы?
10. Какие анионы целесообразно определять через перевод их в катионную форму?
11. Укажите факторы, повышающие чувствительность качественных реакций.
12. Какие анионы легко определить путем воздействия кислот на порошок соли. Приведите соответствующие уравнения реакций.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная
1. Цитович, И. К. Курс аналитической химии / И. К. Цитович. – М.: Высш. шк., 2007. – 495 с.
2. Харитонов, Ю. Я. Аналитическая химия. Аналитика /Ю. Я. Харитонов. – М.: Высш. шк., 2001. – Ч. 1 – 225 с.
3. Слепышева, О. А. ЭУК «Аналитическая химия и ФХМА» / О. А. Слепышева. – Ставрополь: СевКавГТУ, 2007. – Гл. 3.
Дополнительная
4. Алексеев, В. Н. Качественный полумикроанализ / В. Н. Алексеев. – М.: Мир, 1972. – 504 с.
Приложение № 1
Таблица. – Способы проведения качественных реакций
| Способ проведе-ния реакции | Опреде-ляемый ион | Порядок выполнения | Аналитический признак, уравнение реакции |
| Капельный | 
| В центр фильтровальной бумаги нанести 1–2 капли раствора  и 1–2 капли реагента и 1–2 капли реагента  . В центр образовавшегося пятна внести 1 каплю раствора, содержащего ионы . В центр образовавшегося пятна внести 1 каплю раствора, содержащего ионы  . .
| Цвет пятна: черно-серый.
1.  ;
2. ;
2. 
|
| Экстрак-ционный | 
| К 1 мл раствора, содержащего  , добавить ацетатный буфер (внести по 10 к. реактивов , добавить ацетатный буфер (внести по 10 к. реактивов  и и  ), а затем 5 к. дитизона (реагент). Пробирку закрыть и сильно встряхнуть. Дать расслоиться фазам. ), а затем 5 к. дитизона (реагент). Пробирку закрыть и сильно встряхнуть. Дать расслоиться фазам.
| Цвет фазы экстрагента (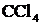 ): алый, в виде кольца вверху пробирки. Внизу возможно выпадение капель красного цвета. ): алый, в виде кольца вверху пробирки. Внизу возможно выпадение капель красного цвета.
|
| Способ проведе-ния реакции | Опреде-ляемый ион | Порядок выполнения | Аналитический признак, уравнение реакции |
| Микро-кристалло-скопичес-кий | 
| На предметное стекло поместить 2-3 к. раствора соли натрия, подсушить и после охлаждения добавить 1 к. раствора уранилацетата цинка:  (реагент). Рассмотрите кристаллы под микроскопом и зарисуйте их. (реагент). Рассмотрите кристаллы под микроскопом и зарисуйте их.
| Цвет кристаллов: лимонный
Форма кристаллов: тетраэдр.

|
| Микро-кристал-лоскопи-ческий | 
| На предметное стекло поместить 2–3 к. раствора соли кальция. Добавить 1–2 к. раствора  (реагент) и подсушить. Рассмотреть под микроскопом полученный препарат. (реагент) и подсушить. Рассмотреть под микроскопом полученный препарат.
| Цвет кристаллов: белый.
Форма кристаллов: игольчатая, в виде «снежинок».
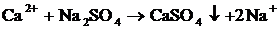
|
| Пирохими-ческий | 
| Петлю из нихромовой проволоки промыть дистиллированной водой и прокалить в пламени газовой горелки. Захватить влажной петлёй кристаллик соли и внести его в среднюю горячую часть пламени. Наблюдать появление окраски. | Цвет пламени: интенсивно желтый. |

| Цвет пламени: сиреневый (лиловый) слабый. | ||

| Цвет пламени: ярко-красный. | ||
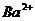
| Цвет пламени: бледно-зеленый. | ||

| Цвет пламени: окрашивания не наблюдается, искрится. | ||
| Способ проведе-ния реакции | Опреде-ляемый ион | Порядок выполнения | Аналитический признак, уравнение реакции |
| Пробир-ный | 
| 1 мл раствора  отобрать в пробирку, добавить туда 4–5 к. отобрать в пробирку, добавить туда 4–5 к.  и раствор осторожно нагреть на пламени горелки до кипения. Универсальным индикатором определить и раствор осторожно нагреть на пламени горелки до кипения. Универсальным индикатором определить 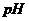 выделившегося газа. выделившегося газа.
| Выделение бесцветного газа с характерным запахом аммиака.
Цвет индикатора: синий.
Значение 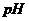 > 8. > 8.

|
Приложение № 2
Таблица – Качественные реакции катионов в растворах индивидуальных солей
| Определяемый ион, (цвет раствора) | Условия проведения | Реагент | Аналитический признак, уравнение реакции |
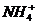 (бесцветный.)
(бесцветный.)
| Среда щелочная: 5-6 к. 
| Реактив Неслера
( ) )
| Выпадение мелкокристаллического осадка кирпичного (красновато-оранжевого) цвета.

|
 (бесцветный).
(бесцветный).
| Среда щелочная:
2-3 капли  и и 
| 
| Выпадение мелкокристаллического осадка белого цвета.
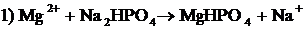 ; ;
 суммарная реакция:
суммарная реакция:
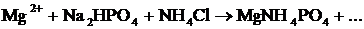
|
 (бесцветный)
(бесцветный)
| Среда кислая: 3-4 к. 
| 
| Выпадение мелкокристаллического осадка светло-желтого цвета.

|
| Определяемый ион, цвет соли | Условия проведения | Реагент | Аналитический признак, уравнение реакции |
 (желтый).
(желтый).
| Среда нейтральная | 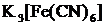
| Выпадение аморфного студенистого осадка синего цвета (турнбулева синь).

|
 (оранжевый). (оранжевый).
| Среда кислая: 1-2 капли 
| 
| Выпадение аморфного студенистого осадка темно-синего цвета (берлинская лазурь).
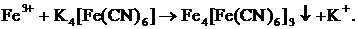
|
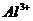 (бесцветный)
(бесцветный)
| Внести 2-3 к. 2н раствора  (среда) и 1-2 к. ализарина (реагент). Пробирку нагреть. После охлаждения внести по каплям (среда) и 1-2 к. ализарина (реагент). Пробирку нагреть. После охлаждения внести по каплям  (до полного изменения окраски раствора). (до полного изменения окраски раствора).
| ализарин | .
Цвет раствора до добавления  - фиолетовый или красный, а по мере добавления - фиолетовый или красный, а по мере добавления  переходит в желто-оранжевый (морковный). переходит в желто-оранжевый (морковный).
|
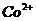 (розовый)
(розовый)
| Среда кислая: 4-5 капель 
| Реактив Ильинского | Выпадение аморфного хлопьевидного осадка красного цвета.

|
| Определяемый ион, цвет соли | Условия проведения | Реагент | Аналитический признак, уравнение реакции |
 (темно синий)
(темно синий)
| Среда щелочная: 2-3 к.  , пробирку осторожно нагреть. Затем прибавлять , пробирку осторожно нагреть. Затем прибавлять  до образования характерной окраски до образования характерной окраски
| 
| При нагревании зеленый цвет раствора гидроксида хрома меняется на желтый, а образовавшийся осадок исчезает.
 ; ;

|
 (светло-зеленый)
(светло-зеленый)
| Среда щелочная: 2-3 к. 
| Реактив Чугаева | Образование аморфного студенистого осадка малинового цвета: ( ). ).
|
 (бесцветный)
(бесцветный)
| Среда нейтральная; пробирку нагреть | 
| Образование аморфного студенистого осадка светло-желтого цвета.

|
 (сине-зеленый)
(сине-зеленый)
| среда нейтральная | 
| Выпадение аморфного студенистого осадка бурого (красно-коричневого) цвета.
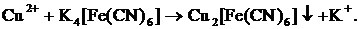
|
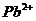 (бесцветный)
(бесцветный)
| среда нейтральная | 
| Выпадение мелкокристаллического осадка ярко-желтого цвета.

|
Приложение № 3
Таблица – Качественные реакции анионов в растворах индивидуальных солей
| Определя-емый ион, | Условия проведения | Реагент | Аналитический признак, уравнение реакции |

| Реакция с групп-повым реагентом (малоселективная) выполняется в кислой (1 – 2 кап.  ) или нейтральной среде ) или нейтральной среде
| 
|  – образование аморфного творожистого осадка белого цвета. – образование аморфного творожистого осадка белого цвета.

|

|  – образование аморфного творожистого осадка бледно-желтого цвета. – образование аморфного творожистого осадка бледно-желтого цвета.

| ||

|  – образование аморфного творожистого осадка светло-желтого цвета. – образование аморфного творожистого осадка светло-желтого цвета.
 . .
| ||

| Среда нейтральная |  или или 
| Выпадение мелко кристаллического осадка желтого цвета.

|

| Среда нейтральная | 
| Выпадение мелкокристаллического осадка белого цвета.
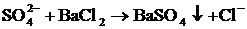 . .
|
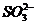 (добавить в последнюю очередь)
(добавить в последнюю очередь)
| Среда кислая: 4-5 капель 
|  раствор ярко-фиолетового цвета.
раствор ярко-фиолетового цвета.
| Происходит обесцвечивание раствора 

|
| Определя-емый ион, | Условия проведения | Реагент | Аналитический признак, уравнение реакции |

| Среда нейтральная | 
| Реагент  красного цвета. Образовался аморфный осадок белого цвета. красного цвета. Образовался аморфный осадок белого цвета.

|

| Среда кислая – создаётся реагентом, пробирку нагреть | 
| Выделение бесцветного газа, без запаха с
рН  5. 5.

|

| Среда кислая:
2-3 капли 
| 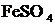 (кристаллический) (кристаллический)
| Раствор окрашивается в коричневый цвет, наблюдается выделение газа. |

| Среда: щелочная – 1 – 2 кап.  , пробирку осторожно нагреть до выделения газа , пробирку осторожно нагреть до выделения газа
| порошок
 или или 
| Выделение бесцветного газа с характерным запахом аммиака.
Цвет индикатора: синий.
Значение 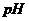  10. 10.

|
Анализ и классификация катионов
Для определения катионов разработаны и применяются на практике такие классификации, как: сероводородная (сульфидная); кислотно-основная; гидроксидно-пероксидная; фосфатно-аммиачная и др. Под аналитической классификацией катионов понимают выделение в осадок небольших групп ионов из смеси путем последовательного воздействия системы групповых реагентов.
В основе любой классификации лежит принцип сходства химических свойств элементов: способность ряда ионов образовывать малорастворимые соединения (осадки). В качестве реагентов подбираются вещества, которые в минимальной степени в дальнейшем будут влиять на ход определения, либо легко могут быть удалены. В первую очередь это кислоты, гидроксиды и соли аммония.
Сероводородная классификация одна из самых простых по структуре (таблица 2.1), однако ее применение в настоящее время ограничено из-за использования высокотоксичного сероводорода. Другие методы анализа были разработаны с целью замены токсичных реагентов на более безопасные и состоят обычно из 5 или 6 групп катионов.
В реальной практике анализ выполняется на основе комплексного подхода: выбирают те реактивы, реагенты и схемы его проведения, которые позволяют достичь желаемого результата наиболее экономным путем.
Согласно сероводородной классификации, как видно из таблицы 2.1, все катионы разбиты на 5 аналитических групп, осаждение которых выполняется с помощью системы групповых реагентов в следующей последовательности:
Группа: V IV III II I
реагент: История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем... Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций... Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства... Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы... ®
®




© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!